煤制合成天然气中甲烷化过程的分析与计算
2014-05-03周华群张谦温张天釜陈维群孔繁华
周华群,张谦温,陈 静,张天釜,陈维群,孔繁华
(1.中国石油 石油化工研究院,北京 100195;2.Power Environmental Energy Research Institute,Covina California CA91722,America;3.北京石油化工学院 化学工程系,北京 102617)
甲烷化是指CO和CO2在H2参与下转化为CH4的过程。在合成氨和燃料电池等工业中,常用甲烷化方法脱除由合成气制得的H2中的微量CO[1]。在城市煤气生产中,也用甲烷化方法将煤气中高浓度的CO部分转化为CH4,从而提高煤气热值并降低有毒气体浓度[2]。近年来,煤制合成天然气(SNG)技术受到广泛关注,已呈现大规模工业化的趋势[1,3]。合成气甲烷化是煤制SNG的关键步骤之一,它与H2净化和城市煤气生产中的甲烷化相比,特点是高浓度CO的完全甲烷化,反应热效应更为突出,由此需要更高Ni含量的催化剂以适应高温过程[1,4-6],并需考虑在中低温时可忽略的热力学平衡限制[1]。
目前,合成气完全甲烷化成套工艺有Topsøe工艺、Davy工艺和Lurgi工艺等[1,3]。其中,Lurgi工艺装置已有20 a以上的工业验证,是世界上唯一一套长期运行的煤制SNG装置。Lurgi工艺采用两级固定床串联,第1级采用大循环比操作,出口温度低于500 ℃,主要生产中压蒸汽[1,7]。这与现今所提倡的高温甲烷化多产高压蒸汽的主流方案有差距。Topsøe工艺、Davy工艺以及现在提出的Lurgi新工艺,均采用可耐650~700 ℃高温的催化剂,多级固定床串/并联,最大量生产高压蒸汽,能量利用效率较高[3]。高温甲烷化工艺方案的细节未见公开,仅可根据催化剂指标和甲烷化过程的特点做出分析和推测。
本工作依据自制Ni/Al2O3催化剂的评价结果,结合现有工艺,对类似性能的催化剂应用于煤制SNG过程中的甲烷化工艺进行了探讨,期望为甲烷化工艺的中试乃至工业试验设计方案提供参考。
1 实验和计算方法
1.1 催化剂的制备和评价
采用共沉淀方法[8-10],使用硝酸镍、硝酸铝、硝酸镁、硝酸钙溶液,按n(Ni)∶n(Al)∶n(Ca)∶n(Ce)=1∶0.65∶0.2∶0.1的比例制备Ni/Al2O3催化剂,筛分出20~40目颗粒备用。
在微型填充床反应器中评价催化剂,反应前催化剂先在5%(φ)H2-95%(φ)N2的氛围下于350 ℃下还原4 h,再将n(CO)∶n(H2)=1∶3的混合气预热至200 ℃后通入催化剂床层。通过调节催化剂装填量和合成气流量控制反应气态空速为2 000~10 000 h-1,其他反应条件为:反应压力3~4 MPa、反应温度200~650 ℃。采用北京北分天普仪器技术有限公司SP-3420型气相色谱仪在线分析气体产物的组成。
1.2 计算方法
甲烷化绝热温升的计算从250 ℃下某初始组成开始,按反应热和体系平均热容计算不同转化程度下的温度,计算终止于该温度下的平衡组成。
按Gibbs最小自由能法[11]计算热力学平衡组成,该方法只计算给定物种,不需确定具体反应路径,计算涉及物种包括H2、CO、CO2、H2O、CH4、C2H6、N2及固体焦炭。
过程能量效率计算基于Aspen Plus流程模拟结果。本流程模拟中选择来自固定床气化的典型原料组成(见表1),其中CH4含量较高,接近CO含量。第1级反应器入口压力定为4 MPa,各级反应均达到热力学平衡,出口高温物流用于发生蒸汽,按照夹点分析计算理论最大蒸汽发生量,夹点给定为10 ℃,蒸汽分为3个等级:高压蒸汽(540 ℃、10 MPa),210 ℃给水;中压蒸汽(450 ℃、4 MPa),170 ℃给水;低压蒸汽(250 ℃、1 MPa),90 ℃给水。首先最大量地生产高压蒸汽,余热再依次最大量地生产中压和低压蒸汽。给水所携带的热量不计入本单元能量。
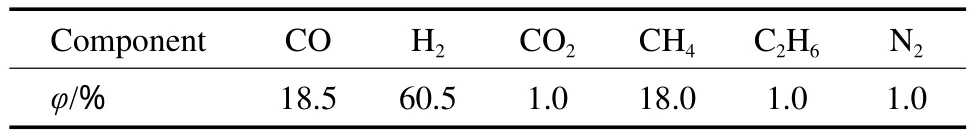
表1 能量计算中合成气原料的组成Table 1 Syngas compositions in energy calculation
有效能计算取环境温度为298.13 K,物流i经某一操作至物流i+1的有效能损失为:
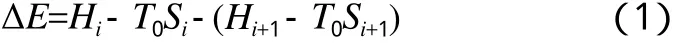
式中,ΔE为有效能损失,MJ;Hi为物流i的焓,MJ;T0为环境温度,K;Si为物流i的熵,MJ/K。因体系涉及化学反应,有效能数值与所定义的参考状态相关,故只计算有效能的变化值。
2 结果与讨论
2.1 催化剂的性能
自制Ni/Al2O3催化剂的基本参数见表2。由表2可见,自制Ni/Al2O3催化剂的Ni含量与商业Ni/Al2O3催化剂[4]基本相当。

表2 自制Ni/Al2O3催化剂的基本参数Table 2 Parameters of Ni/Al2O3 catalyst
自制Ni/Al2O3催化剂在4 MPa、300~650 ℃、气态空速2 000~10 000 h-1的条件下表现出较好的催化性能,产物主要为CH4(不计蒸汽),在低温下有少量C2H6生成,600 ℃以上会生成超过5%(φ)的CO2,可归为热力学平衡的作用,CO转化率和CH4选择性见图1。由图1可见,Ni/Al2O3催化剂的起始活化温度约为250 ℃,300 ℃以上CO几乎完全转化。在更低温度(175~200 ℃)下,甲烷化条件下会产生羰基Ni,导致催化剂失活,仅靠提高温度无法恢复催化剂的活性。而实验范围内的空速对反应转化率影响很小,这一现象与文献结果[6,10,12-13]一致。推测在类似实验条件下,即使控制反应器的表观恒温,但反应器内部的反应热效应对甲烷化仍起到一定的自促进作用。
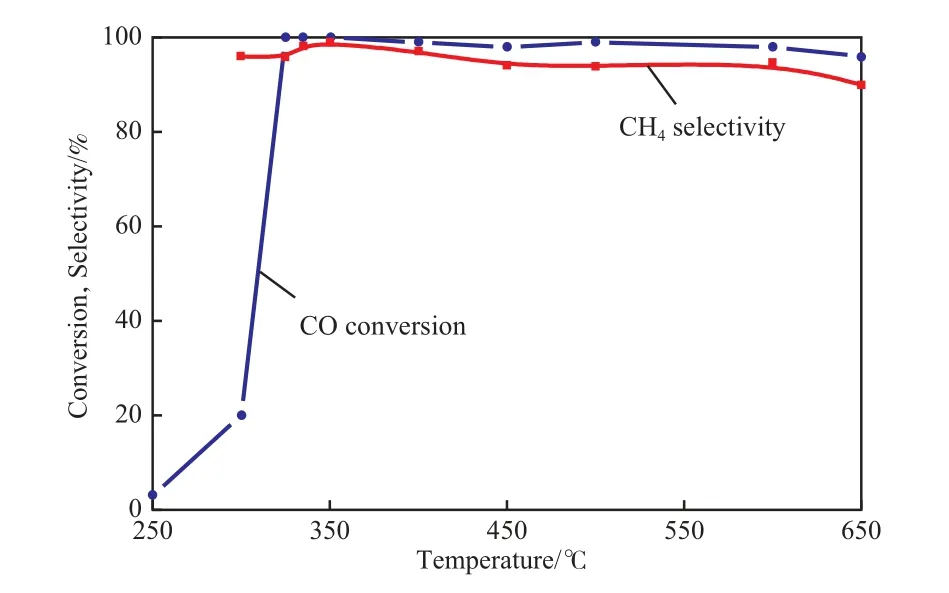
图1 Ni/Al2O3催化剂上甲烷化反应中的CO转化率和CH4选择性Fig.1 CO conversion and CH4 selectivity in the methanation over the Ni/Al2O3 catalyst.
还考察了Ni/Al2O3催化剂的稳定性。在3~4 MPa、300~500 ℃、气态空速2 000~10 000 h-1的条件下反应1 000 h以上,再在650 ℃下反应50 h,未发现CO转化率和CH4选择性有明显变化,且最终在催化剂上未发现积碳。
根据Ni/Al2O3催化剂的评价结果,Ni/Al2O3催化剂的适用条件为:温度250~650 ℃、气态空速不大于10 000 h-1、压力3~4 MPa,甲烷化的过程应避免处于200 ℃左右的温度下。以下基于这一条件对甲烷化反应工艺进行设计和计算。
2.2 绝热反应温升
甲烷化过程中发生的主要反应如下[1]:
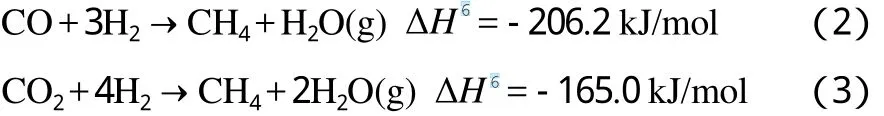
由于甲烷化原料中CO2的含量通常很低,对总热效应贡献较小,故仅考察CO甲烷化反应,反应的绝热温升见图2。由图2可见,以CO的碳基含量为横坐标,温升与反应转化深度(反应转化深度越深,CO碳基含量越低)基本呈线性关系,当原料的n(CO)∶n(H2)=1∶3时(见图2(1)),CO碳基含量每降低1百分点温度升高18.6 ℃;当CO转化率接近40%时达到热力学平衡,此时温度已超过900 ℃。若甲烷化原料中已存在一定量CH4或原料已完成部分甲烷化,计算结果见图2(2)~(5)。如果甲烷化过程中不额外添加和去除蒸汽,则图2(2)~(5)可表示从原料(n(CO)∶n(H2)∶n(CH4)=1∶3∶1)到合成SNG的完全甲烷化过程中反应转化深度与温升的关系,且全过程中曲线斜率接近,大致为CO碳基含量每降低1百分点温度升高25~30 ℃。
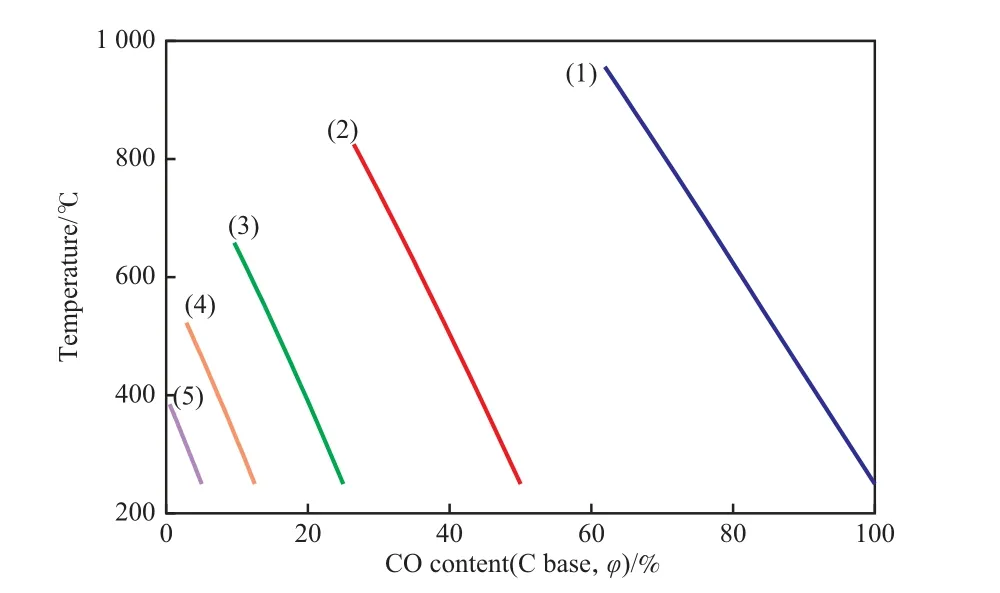
图2 CO甲烷化反应的绝热温升Fig.2 Adiabatic temperature rise in the CO methanation.Reaction conditions:initial temperature 250 ℃,4 MPa.
2.3 热力学平衡
甲烷化体系的热力学平衡组成除了受温度、压力和原料组成影响外,还与限定的反应产物有关,即组成体系中是否包含可能生成的CO2、焦炭及轻烃等。本计算中选择以下3种组成体系:Ⅰ)CO,H2,CH4,H2O;Ⅱ)CO,H2,CH4,H2O,CO2;Ⅲ)CO、H2、CH4、H2O、CO2、C2H6和焦炭。分别针对3种组成体系进行计算。前两种体系的计算结果见图3。
图3中给出的是不同温度下CH4,CO,CO2的干基平衡组成,图中将CO和CO2统一记作COx。低温(低于400 ℃)时CO和CO2均可接近完全转化;而在较高温度下,特别是高于600 ℃时,甲烷化反应明显受到平衡限制。以650 ℃为例,当只存在CO甲烷化反应时,CO的平衡含量约为7%(φ);而当体系中存在CO2时,即催化剂具有变换功能或存在CO2甲烷化的逆反应时,CO的平衡含量降至2%(φ),但COx的平衡含量仍约为7%(φ),即多转化的CO主要形成了CO2。通常,Ni/Al2O3催化剂的变换活性不太明显,且CO2甲烷化及其逆反应的速率相对CO低得多[7,12-13],因此对实际条件下的CO甲烷化反应,很可能出现的是:CO转化率超过了仅计算CO甲烷化的平衡转化限制,但未达到包含CO2的平衡点。而按COx统一计算碳氧化合物,则不论是否包含CO2的平衡体系,均有近似相同的平衡转 化深度。
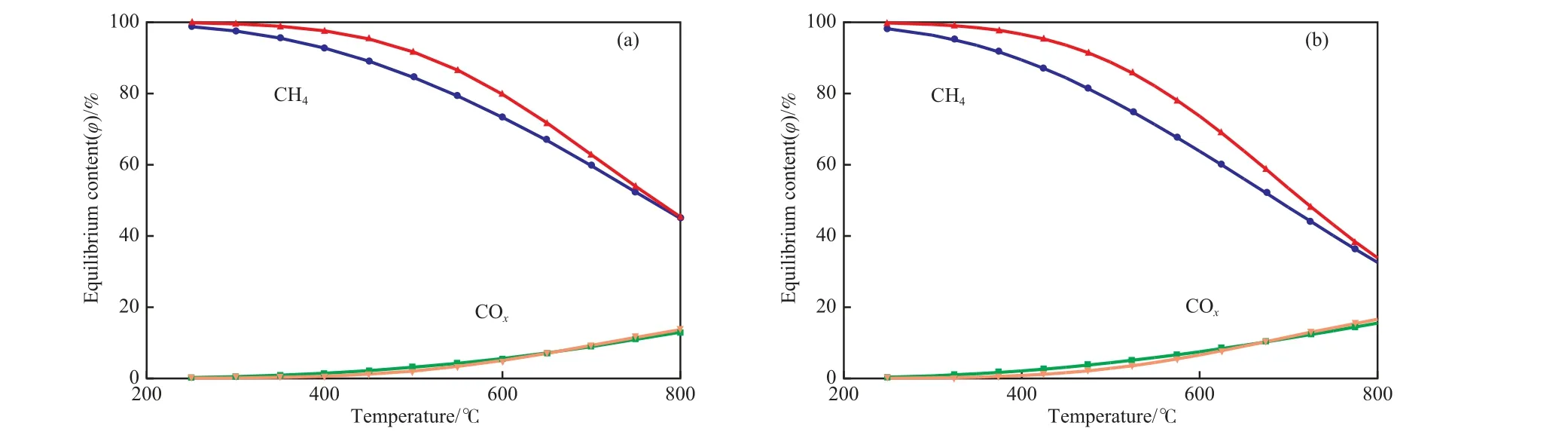
图3 甲烷化反应的热力学平衡计算结果Fig.3 Equilibrium compositions of the methanation.Reaction condition:4 MPa.
图3中两种原料体系基本上对应固定床气化和气流床气化为源头的合成气组成。当初始组成中已含有一定含量的CH4后,COx的平衡组成略有降低,CH4平衡含量相应有所增加。
对于组成体系Ⅲ,热力学计算结果显示,在所考察的温度范围内平衡组成中几乎不含C2H6。这与文献[1,7]中实际条件下的反应结果相符,Lurgi气化炉的合成气原料和甲烷化过程中存在少量C2H6,在甲烷化条件下最终几乎完全转化。在所计算的H2含量高的体系中焦炭的平衡含量也几乎为0,限于条件,计算采用的是纯无定形炭的数据,催化剂表面沉积的焦炭的化学势可能比纯无定形炭略低。
2.4 多级绝热固定床工艺
根据热力学平衡和反应热效应分析结果,甲烷化过程的理想反应工艺是高温快速反应和低温完全反应的串联,其中高温反应需考虑温升和催化剂使用温度的限制。目前,高温甲烷化通常采用绝热甲烷化或等温甲烷化,其中流化床等温反应是一个方向[1]。基于催化剂的特点,本工作仅讨论绝热甲烷化,这也是现今甲烷化的主流技术。
固定床绝热甲烷化一般采用多级串联、级间冷却或稀释原料气的方式。以3级反应器为例,简化的甲烷化工业装置中常见的反应器连接方式见图4。由图4可见,图4a为第1级反应器(R1)出口循环稀释原料,即R1实际进料组成A为原料F与R1出口B按流量比的混合值,Lurgi工艺(2级反应器)和Tremp工艺(3级反应器)属于此类;图4b为原料分流,分别进入R1和第2级反应器(R2),且R2出口循环稀释原料,即R1或R2进料组成为原料F分别与R2或R1出口C或B的混合值,Davy工艺[1]属于此类。循环与分流仅针对高温甲烷化;而对低温完全甲烷化(或补充甲烷化)工艺,反应器简单串联即可,可根据产品需要设定一个或数个反应器。反应工艺具体参数因商业秘密未见公开。

图4 甲烷化固定床工艺的反应器连接方式Fig.4 Reactor connections of fi xed bed methanation processes.
根据甲烷化反应温升和热力学平衡结果,可对多级串联的甲烷化工艺过程做出近似的定量分析。在催化剂使用温度区间(上、下限)和甲烷化的平衡转化限制(以原料组成n(CO)∶n(H2)∶n(CH4)=1∶3∶1为例)范围内,单个甲烷化反应器内的组成和温度变化见图5。参照图2可形成一条直线,起于250 ℃和入口组成,终止于平衡组成或催化剂使用温度上限。图5a中以A,B,C为起点的3条温升线即可表示图4a中3级反应器的转化、温升和级间冷却的过程。A点是R1出口循环与原料F的混合组成,线段AF/AB即为循环比。
采用较小的循环比,当R1入口COx含量高于图5a中的A点时,反应将终止于催化剂使用温度上限,即反应深度由动力学控制;而采用较高循环比时,则可利用平衡限制控制反应深度。两种控制方案的优缺点在合成气变换工艺中有实例可参考[14],通常动力学控制可采用较小的反应器和较少的催化剂,但控制难度大;而平衡控制下催化剂效率可能较低。具体对于甲烷化反应,催化剂在使用期内会逐渐失活[1],若采用动力学控制,常用的逐步提高温度来弥补活性下降的方法将可能导致出口温度高于催化剂使用温度限制,不得不调整各级反应的转化深度,因此平衡控制更容易被接受。
采用平衡控制,将R1出口平衡点定于平衡线和催化剂使用温度上限的交点附近是合适的,即如图5中所示,可充分发挥高温催化剂的性能,减小循环比从而降低压缩机功耗。对于图4a工艺,确定了R1温升的限制点,也就确定了各级反应器的出口组成和温度。本工作的催化剂使用温度上限为650℃,按图5a所示,采用图4a中的3级反应器,可实现最终SNG产品中COx含量(碳基)约1%(φ),即CH4含量约为95%(φ)。若催化剂不耐高温,仅可在500 ℃以下使用,则如图5a中B和C为起点的温升线所示,2级反应就可获得类似的产品组成,此时循环比为BF/BC,远大于高温下3级反应器的条件。
对于图4b所示的原料有分流的甲烷化工艺,基于同样的原因,R1出口平衡点也应控制在平衡组成与催化剂使用温度上限交点(见图5b)。调整分流比和循环比,R2的入口点B’可在A和B之间移动,存在多种操作条件的选择。例如在适当的分流和循环比时,B’与A可以重合,即R1与R2的组成变化和温升相同,可以视为并联方式。但当B’越趋向A时,则在同样反应级数的条件下,最终SNG产品中CH4含量越低,在R1和R2类似并联连接时,需要4级反应器才能达到与图4a的3级反应器相同的效果。
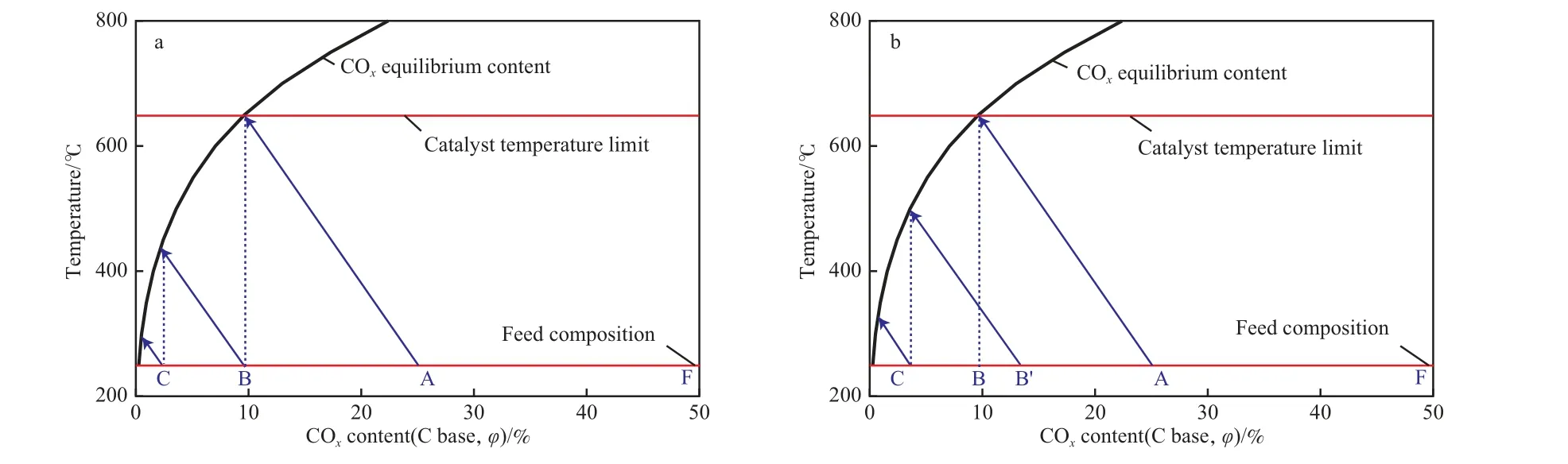
图5 CO转化率与反应温升、平衡限制和催化剂温度限制的关系Fig.5 Relationships of CO conversion to temperature rise and equilibrium limitation and catalyst temperature tolerance.Reaction conditions:temperature limit 250-650 ℃,4 MPa.
2.5 能量利用效率
据文献[15]报道,煤制SNG的能量利用效率为55%~66%,按式(2)所示,仅甲烷化步骤的反应热就占最终SNG热值的1/4左右。即使是Lurgi气化炉为源头的煤制SNG过程,其甲烷化原料中已含约18%(φ)的CH4,反应热也约为SNG热值的14%。由此可见,甲烷化过程的能量利用效率是衡量该工艺技术水平的一项关键指标。
反应热的利用一般是发生蒸汽,不仅应考虑回收热的数量,还需考虑热的品位,因此尽可能地发生高压蒸汽是合理的,可用有效能损失来判断几种工艺在热量回收品位上的效果。基于这一设定,对前述几种多级绝热固定床工艺分别作了流程模拟计算,在得到组成相近的SNG产品的前提下,考察不同反应工艺的能量利用效率,计算结果见表3。
由表3可见,采用图4a-2级反应器工艺(Lurgi工艺),虽然R1出口有大量500 ℃左右温位的热量,大于高压蒸汽饱和温度(312 ℃),但在不借助界区外热源的前提下,无法使蒸汽过热至540 ℃,故只能产生中压蒸汽。因此,尽管热量回收率高达92.13%,但有效能回收率仅58.46%,在几种工艺中有效能回收率最低。
可发生高压过热蒸汽的几种工艺中,蒸汽产量由几股高温物流的温度和流量综合决定,其中蒸汽过热阶段的热量充足,限制在于汽化阶段。计算结果表明,不论原料是否分流,降低循环比、提高R1出口温度,可增产高压蒸汽。本工作中催化剂使用温度上限为650 ℃,图4a-3级反应器工艺中R1出口温度设为650 ℃,以及图4b-4级反应器工艺中将R1和R2出口温度均设为650 ℃,可实现相同的高压蒸汽产量(为1.69 kg),热量相当于总反应热的83%。因此,在追求高压蒸汽产量时,应尽可能将出口温度提至催化剂使用温度上限。而适当提高循环比、增加高温物流的流量,虽然高压蒸汽产量有所降低,却可增加中、低压蒸汽产量,有可能提高总热量回收率。需要说明的是,增大循环比的同时会增大压缩机功耗。由于反应器及蒸汽发生设备的压降无法准确计算,将R1~3分别给定0.3,0.2,0.1 MPa的压降,并计算理论等熵压缩功耗以供参考。综合考虑,采用原料分流的工艺(见图4b-3级反应器)、设定R1和R2出口温度分别为650 ℃和500 ℃的方案的有效能利用率最高,达到65.19%,考虑到SNG产品中CH4含量偏低,可根据需要再串联一个补充甲烷化反应器。
具体工艺方案的选择,应根据实际蒸汽需求量来确定,尤其是甲烷化装置的热量与煤制SNG全流程的热量综合利用时,应从全厂角度进行优化。
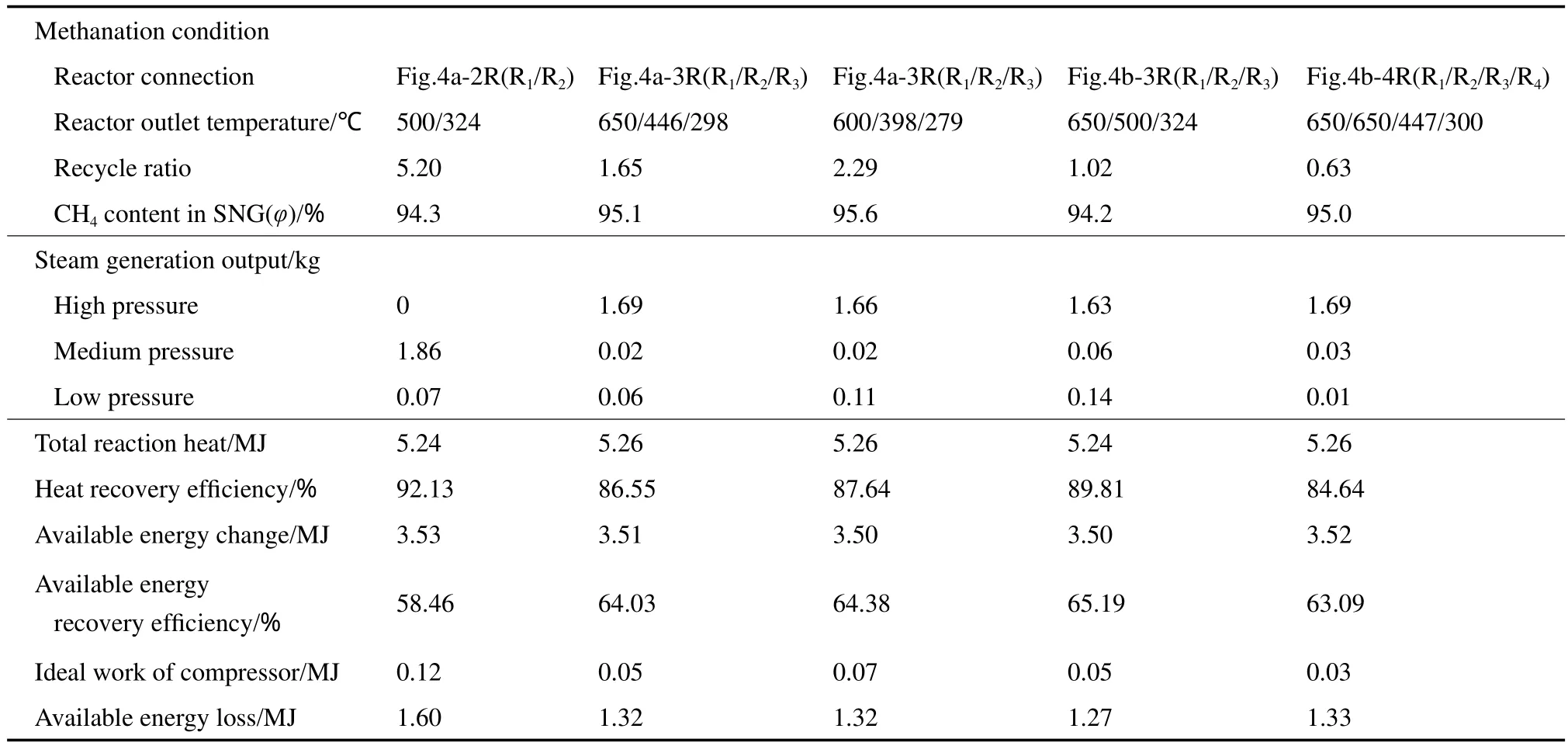
表3 甲烷化工艺条件与能量利用效率的关系Table 3 Relationship between the methanation conditions and energy ef fi ciency(based on 1 Nm3 SNG)
3 结论
1)在原料初始组成n(CO)∶n(H2)∶n(CH4)=1∶3∶1的条件下,CO甲烷化反应的绝热温升为CO碳基含量每降低1百分点温度升高25~30 ℃。
2)甲烷化反应在高温时明显受到热力学平衡限制,反应中存在CO2甲烷化及其逆反应时,CO平衡转化率高于仅含CO甲烷化反应的平衡转化率,高出部分主要生成CO2。
3)甲烷化反应适合采用热力学平衡控制,第1级反应器出口平衡点应选在催化剂使用温度上限处的热力学平衡点附近。
4)甲烷化单元独立产生蒸汽时,尽量提高高温甲烷化反应器的出口温度,可最大化地生产高压蒸汽;适当降低高温甲烷化反应器出口温度、增加循环比,可提高综合有效能利用率。
[1]Kopyscinski J,Schildhauer J T,Biollaz S M A.Production of Synthetic Natural Gas(SNG) from Coal and Dry Biomass—A Technology Review from 1950 to 2009[J].Fuel,2010,89(8):1763-1783.
[2]于广锁,于建国,潘惠琴,等.城市煤气甲烷化研究综述[J].化肥设计,1997,35(3):55-58.
[3]晏双华,双建永,胡四斌.煤制合成天然气工艺中甲烷化合成技术[J].化肥设计,2010,48(2):19-22.
[4]ROSS J R H.Metal Catalysed Methanation and Steam Reforming[M]//Bond G C,Webb G.eds.Catalysis Specialist Periodical Reports:Vol.7.London:Royal Society of Chemistry,1985:14-27.
[5]路霞,陈世恒,王万丽,等.CO甲烷化Ni基催化剂的研究进展[J].石油化工,2010,39(3):340-345.
[6]王鑫,郭翠梨,张俊涛,等.改性的Ni基催化剂上CO甲烷化性能的研究[J].石油化工,2012,41(3):260-264.
[7]Zahnstecher L W.Coal Gasi fi cation via the Lurgi Process,Topic Report:VolumeⅠ.Production of SNG[M].Alexandria:Natl Technical Information,1984:127-133.
[8]Kruissink E C.Coprecipitated Nickel-Alumina Methanation Catalysts[M].Delft:Delft University Press,1981:7-37.
[9]Liu Qihai,Liu Zili,Liao Liewen,et al.Selective CO Methanation over Amorphous Ni-Ru-B/ZrO2Catalyst for Hydrogen-Rich Gas Puri fi cation[J].J Nat Gas Chem,2010,19(5):497-502.
[10]马胜利,谭猗生,张清德,等.α-Ni/γ-Al2O3催化剂催化一氧化碳甲烷化反应的研究[J].天然气化工,2009,34(6):1-3.
[11]White W B,Johnson S M,Dantzig G B.Chemical Equilibrium in Complex Mixtures[J].J Chem Phys,1958,28(5):751-755.
[12]单译,郭瓦力,吕海丽,等.富氢气氛下CO选择性甲烷化反应行为及工艺条件[J].天然气化工,2011,36(2):14-17.
[13]蔡进.煤制合成天然气甲烷化反应研究[J].化学工业与工程技术,2011,32(2):16-20.
[14]王志峰.新型煤气化装置耐硫变换工艺技术特点分析[J].化肥设计,2011,49(2):19-22.
[15]李大尚.煤制合成天然气工艺技术经济分析[J].煤化工,2010(2):1-7.
