2种PCR试剂盒定量检测血清HBV DNA含量的比较
2014-04-28张继万周建丽张晓芳罗丽莎王海滨
张继万,周建丽,张晓芳,罗丽莎,王海滨
2种PCR试剂盒定量检测血清HBV DNA含量的比较
张继万,周建丽,张晓芳,罗丽莎,王海滨
目的探讨AMPLIPREP-COBASTAQMAN法(罗氏COBAS法)和北京鑫诺美迪PCR-荧光探针“一管法”检测血清HBV DNA含量的性能差异。方法采用2种方法同步检测175例乙型肝炎患者血清样本,并将黄疸、溶血和脂血标本作为干扰样本,分析2种方法的相关性、一致性和抗干扰性。取一已知定量为2.24×109IU/ml的标本,用阴性血清做1+9(即1∶10)的稀释,并依次稀释至2.24×10 IU/ml,比较2种方法的线性范围和灵敏性的差异。结果175份均有数值的标本中,2种试剂检测结果比较差异无统计学意义。2种试剂对黄疸、溶血和脂血标本的定量值影响不大。对于HBV DNA>1.70×108IU/m l的样本,罗氏COBAS法结果只显示>1.70×108IU/m l,而“一管法”无须稀释仍能准确定量;对于HBVDNA<1.00×102IU/m l的样本,“一管法”仅能检测到病毒,而罗氏COBAS法的稳定性和线性更好。结论PCR-荧光探针“一管法”与进口罗氏COBAS法具有良好的一致性,且省时、省力,价格低廉,适合在我国推广应用。
DNA,病毒;乙型肝炎,慢性;试剂盒,诊断
全球约有20多亿人既往感染过HBV,其中约3.5亿为慢性HBV感染者[1]。我国是乙型肝炎(乙肝)大国,人群乙肝表面抗原阳性率约7.18%,严重影响我国人口健康,因此切实提高乙肝临床诊疗水平具有十分重要的意义[2]。由于发病人数众多,结合国情寻找价廉而疗效肯定的药物以及能满足临床需求的检测项目,具有非常重要的现实意义。本文对进口全自动HBV DNA定量技术和国产“一管法”试剂盒的准确性和灵敏性等指标进行比较研究,评价2种方法在我国不同层次医院应用的地位,为临床检测项目的选择提供科学依据。
1 材料与方法
1.1 材料175份乙肝血清样本来自于解放军第三〇二医院门诊及住院患者,用2种方法同时检测。
1.2 黄疸、溶血和脂血标本的选择与制备
1.2.1 对照样本的选择分别选择HBV DNA含量为1.00×109IU/ml、1.00×106IU/ml和1.00×104IU/ml无黄疸、溶血和脂血的血清为对照样本。采用无黄疸、溶血和脂血的HBV DNA阴性血清为稀释液,按照1┼4(即1∶5稀释)比例制备实验对照血清。
1.2.2 含黄疸、溶血和脂血干扰血清的制备选择HBV DNA阴性的高黄疸(TBIL>500μmol/L)、高脂血(TG>5.5mmol/L)和全血冻融的标本为稀释液,分别对对照血清做1┼4稀释,制备出含有黄疸、溶血和脂血的高、中、低拷贝的干扰标本。
1.3 主要试剂和仪器采用罗氏AMPLIPREP-COBASTAQMAN法(以下简称“罗氏COBAS法”)全自动核酸提取和扩增系统,检测下限为20.00 IU/ml,以及北京鑫诺美迪PCR-荧光“一管法”,最低检测下限为5.00×102IU/ml,采用上海宏石公司SLAN荧光定量仪进行扩增。
1.4 HBV DNA定量检测
1.4.1 罗氏COBAS法加1ml血清到样本管,然后将磁珠、裂解液和洗液等试剂放入仪器中指定位置。当DNA在高温(80℃)洗脱后,仪器自动将反应液加入提取的核酸中。最后,在PCR扩增仪进行扩增。
1.4.2 “一管法”在PCR反应管底分别加入3μl“核酸释放剂”,然后加入3μl标准品、质控品和待检样本,吸打混匀,95℃静置10min,加入35μl的PCR反应液进行PCR扩增。
1.5 统计学处理应用SPSS l7.0软件对实验结果进行统计分析。计量资料呈正态分布,以±s表示,2组间比较采用成组t检验。组间计数资料比较采用χ2检验或精确概率检验。P<0.05表示差异有统计学意义。
2 结果
2.1 2种方法相关性比较在175份样本中,对2种方法检测HBV DNA定量>5.00×102IU/m l的90份进行相关分析,二者的相关系数为0.948(图1)。
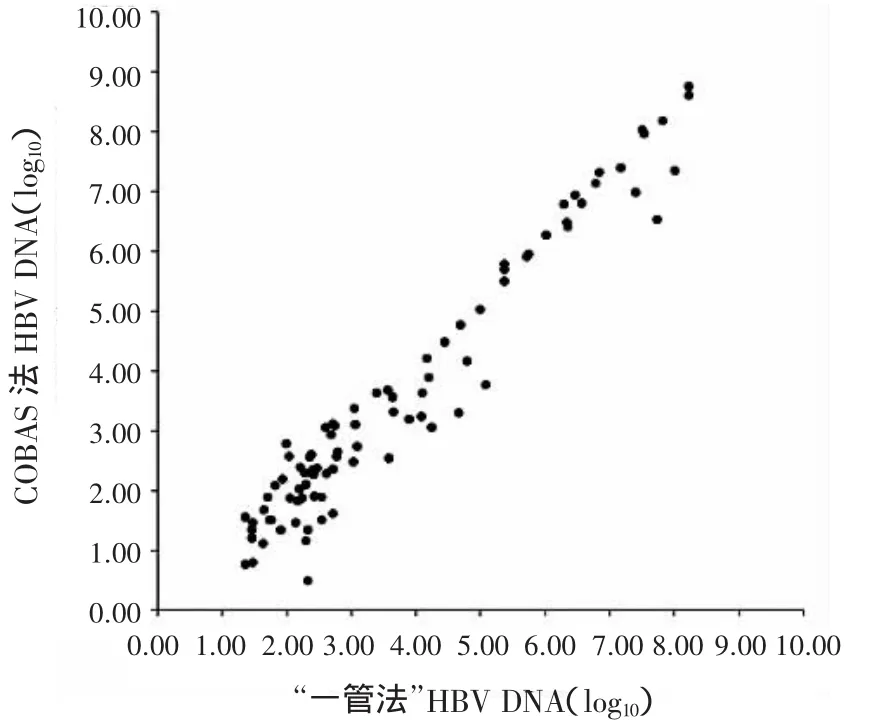
图1 罗氏COBAS法和“一管法”HBV DNA定量相关性比较Figure 1 Com parison of the correlation of HBV DNA quantification by Roche COBAS TaqM an HBV assay and one-tube nested PCR assay
2.2 2种方法一致性比较按目前临床通用临界值5.00×102IU/m l进行2种方法的一致性分析,>5.00×102IU/ml的标本为阳性,<5.00×102IU/ml的标本为阴性。在175份血清样本中,2种方法检测结果均为阳性的标本有90份,均为阴性的标本有76份。二者阳性符合率为94.74%,阴性符合率为95.00%,粗一致性为94.85%(表1)。
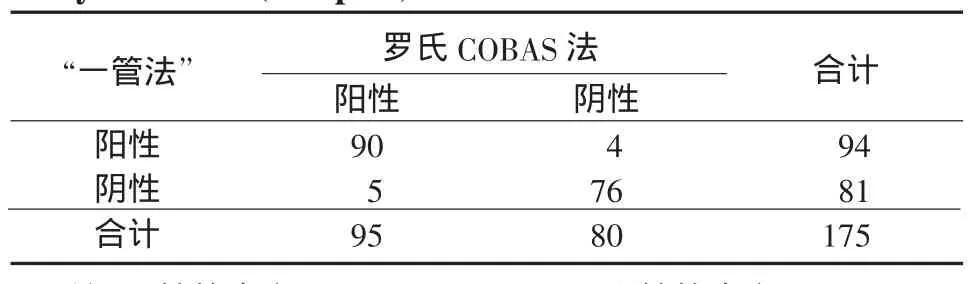
表1 2种方法一致性比较(份)Table 1 Comparison of the consistency between the two assay methods(sam ples)
2.3 2种方法定量范围和灵敏性比较选取1份HBV DNA定量>1.00×109IU/ml的强阳性样本(经HBV核酸国家标准品定值),用阴性血清做1┼9(即1∶10)的稀释,然后用2种方法进行定量。结果表明,对于浓度为1.00×102IU/m l~1.70×108IU/ml的样本,2种试剂的定量结果与理论靶值均具有良好的一致性,二者的平均值与理论浓度的对数线性相关系数分别为0.999 5和0.999 4;对于<1.00×102IU/ml的样本,“一管法”能检测到病毒,但定量值不再呈10倍递减,罗氏COBAS法仍呈10倍递减;对于>1.70×108IU/ml的样本,罗氏COBAS法结果只显示>1.70×108IU/ml(若要精确的定量值,须稀释后再做),“一管法”仍呈10倍递增,可准确定量HBV DNA含量高于8个数量级以上的临床样本,而无须稀释(表2、图2)。
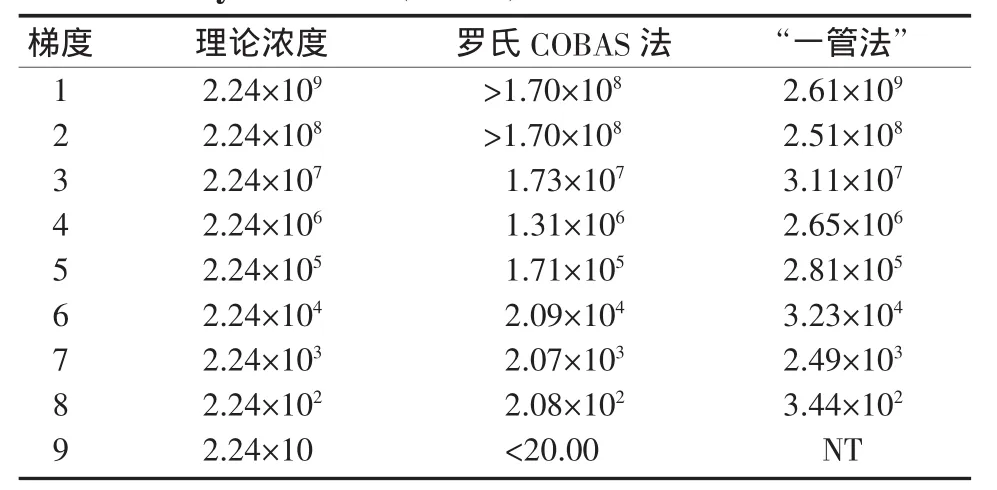
表2 2种试剂检测梯度稀释样本定量结果比较(IU/m l)Table 2 Comparison of HBV DNA quantification between the two assay methods(IU/m l)
2.4 2种方法检测黄疸、溶血和脂血标本的结果比较含有黄疸、溶血和脂血的HBV DNA阳性标本对2种不同核酸提取方法进行的荧光PCR结果都产生不同程度的影响。黄疸标本对“一管法”的扩增效率产生的影响最大,脂血标本影响最小(图3)。含有黄疸、溶血和脂血的HBV DNA阳性标本对荧光PCR定量结果影响不大,因其Ct值仅有细微差别。
3 讨论
我国在全球范围内首先将HBV DNA定量指标列为临床抗病毒治疗的参考指标,在乙肝抗病毒治疗方面具有丰富经验[3-6]。核苷(酸)类似物等抗病毒药物的广泛应用,可降低患者的血清病毒含量,因此临床对HBV DNA检测的灵敏性要求越来越高[7-10]。近几年国产试剂盒的质量一直稳步提升,其检测灵敏度也由5年前的<1.00×103IU/ml,提升到1.00×102~5.00×102IU/ml,并且检测结果与国际通用技术具有一定的可比性。罗氏COBAS法在检测中使用的血清量为500μl,而“一管法”仅使用3μl,因此有前者的灵敏度要高于后者166.7(500/3)倍的视觉,但在实际研究中并未发现这样的差异[11-13]。研究表明,血清量的增加除了能提高视觉上的灵敏度外,还存在被大家忽视的PCR干扰物质如蛋白及离子等呈倍数增加[14],而且核酸提取过程中核酸丢失的问题亦容易被忽略。研究指出,磁珠的核酸丢失可高达90%以上[15]。“一管法”直接将3μl血清加入PCR反应管中,经过蛋白温度变性处理即进行PCR扩增,3μl之所以可对5.00× 102IU/ml(约3×103copies/ml)的血清标本进行定量,一则无核酸丢失,二则其理论灵敏度为50 IU/ml(约3×102copies/ml),完全可满足目前临床检测需求。
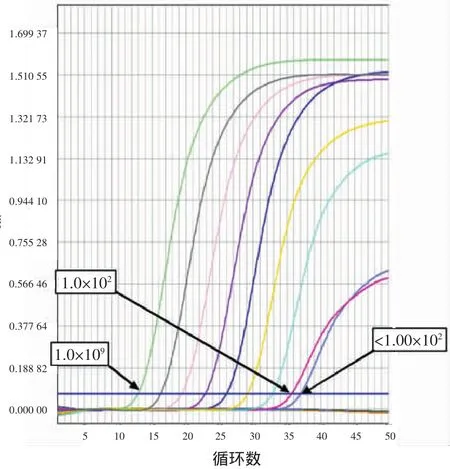
图2 “一管法”10倍梯度稀释扩增曲线Figure 2 Am plification curves for 10-fold dilution series by one-tube nested PCR assay
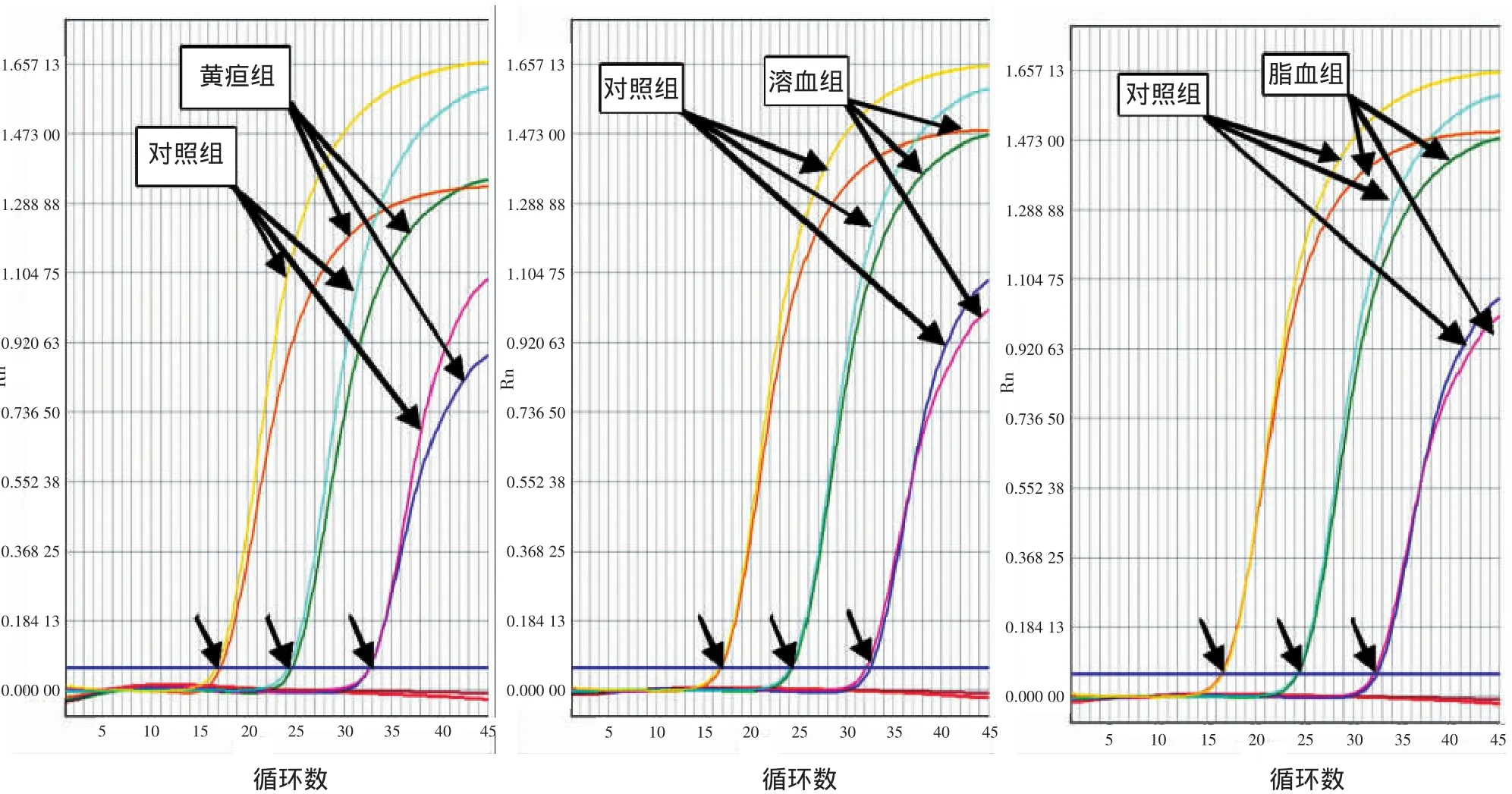
图3 “一管法”提取高、中、低拷贝干扰血清的扩增曲线Figure 3 Amp lification curves for high,medium and low levels of HBV DNA in interference sera by one-tube nested PCR assay
本文对175份血清标本进行研究的结果提示,二者均具有良好的相关性、较好的一致性和优秀的抗干扰性能。罗氏COBAS法有5项标本定量为>5.00×102IU/ml,而“一管法”定量为<5.00× 102IU/ml;反之,“一管法”有4项标本定量为>5.00×102IU/m l,罗氏COBAS法定量为<5.00× 102IU/ml。重复检测发现,这9份标本全部为临界值。因此对临床需求的5.00×102~1.00×108IU/m l的标本而言,2种方法均能准确满足。对HBV DNA含量>1.00×108IU/ml的血清标本,“一管法”可无须稀释标本即可提供准确结果,罗氏COBAS法却无法实现,而临床对高次方标本的HBV DNA需求并不十分强烈。罗氏COBAS法的优势是对HBV DNA含量<5.00×102IU/m l的标本进行准确定量,其定量灵敏度高达20.00 IU/ml。按2005年专家共识的要求,建议对血清HBV DNA含量>2.00×104IU/ml的患者行核苷类似物治疗[16]。因此具有较高灵敏度的试剂盒临床使用价值并不高,但因临床医生和患者对治疗结果的“挑剔”,提高试剂盒的灵敏度符合现实需求。
“一管法”病原体核酸荧光定量PCR检测法与罗氏COBAS法相比,除了价格低,耗时短外,还具有抗干扰性能良好,高含量HBV DNA标本无须稀释,操作简便,污染概率低等优势。虽然低拷贝样本中的稳定性及线性欠佳,但结合我国国情,适合临床检测,值得推广。
[1]申焕军,陈敬银,张中伟,等.慢性乙型肝炎患者HBV血清标志物与HBVDNA的相关性分析[J].传染病信息,2013,26(2):111-114.
[2]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].传染病信息,2011,24(1):Ⅲ-ⅩⅤ.
[3]Su H,Zhang Y,Xu D,et al.Occult hepatitis B virus infection in anti-HBs-positive infants born to HBsAg-positive mothers in China[J].PLoSOne,2013,8(8):e70768.
[4]Morris CJ,Hill M,de Medina M,et al.Comparison of detection and quantification of HBV DNA in chronic HBeAg negative and positive patients by Abbott RealTime HBV and Roche Cobas TaqMan HBV assays[J].JVirol Methods,2013,193(2):391-393.
[5]Ntziora F,Paraskevis D,Haida C,etal.Ultrasensitive amplification refractory mutation system real-time PCR(ARMS RT-PCR)assay for detection of minority hepatitis B virus-resistant strains in the era of personalizedmedicine[J].J Clin Microbiol,2013,51(9): 2893-2900.
[6]Kim H,Shin S,Oh EJ,et al.Comparison of the AdvanSure HBV real-time PCR test with three other HBV DNA quantification assays[J].Ann Clin Lab Sci,2013,43(2):230-237.
[7]Katsoulidou A,Manesis E,Rokka C,et al.Development and assessment of a novel real-time PCR assay for quantitation of hepatitis D virus RNA to study viral kinetics in chronic hepatitis D[J].JViral Hepat,2013,20(4):256-262.
[8]Loustaud-Ratti V,Wagner A,Carrier P,etal.Distribution of total DNA and cccDNA in serum and PBMCs may reflect the HBV immune status in HBsAg+and HBsAg-patients coinfected or not with HIV or HCV[J].Clin Res Hepatol Gastroenterol,2013,37(4): 373-383.
[9]Park Y,Kim BS,Choi KH,etal.A novelmultiplex real-time PCR assay for the concurrent detection of hepatitis A,B and C viruses in patientswith acutehepatitis[J].PLoSOne,2012,7(11):e49106.
[10]Germer JJ,Abraham P,Mandrekar JN,et al.Evaluation of the AbbottHBVRUOsequencing assay combinedwith laboratory-modified interpretive software[J].JClin Microbiol,2013,51(1):95-100.
[11]Afshar RM,Mollaie HR.Detection of HBV resistance to lamivudine in patients with chronic hepatitis B using Zip nucleic acid probes in Kerman,southeastof Iran[J].Asian Pac JCancer Prev,2012,13 (8):3657-3661.
[12]Izmirli S,Celik DG,Yuksel P,et al.The detection of occult HBV infection in patients with HBsAg negative pattern by real-time PCRmethod[J].Transfus Apher Sci,2012,47(3):283-287.
[13]Shen ZY,Zheng WP,Deng YL,et al.Variations in the S and P regions of the hepatitis B virus genome under immunosuppression in vitro and in vivo[J].Viral Immunol,2012,25(5):368-378.
[14]Tas T,Kaya S,Onal S,et al.The detection of HBV DNA with polymerase chain reaction in blood donors with isolated hepatitis B core antibody[J].Med Glas(Zenica),2012,9(2):227-230.
[15]Blackard JT,Martin CM,Sengupta S,et al.Limited infection with occult hepatitis B virus in drug users in the USA[J].Hepatol Res, 2013,43(4):413-417.
[16]Liaw YF,Leung N,Guan R,et al.Asian-Pacific consensus statement on themanagement of chronic hepatitis B:a 2005 update[J]. Liver Int,2005,25(3):472-489.
(2014-05-11收稿 2014-06-27修回)
(责任编委 王永怡 本文编辑 陈玉琪)
Comparison of two PCR assays for serum HBV DNA quantification
ZHANG Ji-wan,ZHOU Jian-li,ZHANG Xiao-fang,LUO Li-sha,WANG Hai-bin*
Department of Infectious Diseases,Sichuan Provincial Corps Hospital, Chinese People's Armed Police Forces,Leshan,Sichun 614000,China
*Corresponding author,E-mail:haibin_wang@sohu.com
Objective To investigate the performance differences in detecting serum HBV DNA quantification between Roche COBASTaqMan HBV assay and one-tube nested PCR assay.Methods The serum samples from 175 patientswith hepatitis B were detected by Roche COBASTaqMan HBV assay and one-tube nested PCR assay,with the jaundice,hemolytic and lipemic samples as interference samples,so as to analyze the correlation,consistency and interference performance of the two assays.A known sample with 2.24×109IU/ml of HBV DNA was diluted by 1∶10 in negative serum in turn,and finally to an HBV DNA level of 2.24×10 IU/ m l.The linear range and sensitivity of the two assays were analyzed.Results There was no significant difference in HBV DNA quantification of the 175 samples detected by the two assays.HBV DNA quantification in the jaundice,hemolytic and lipemic samples detected by the two assays was not significantly different.For samples with HBV DNA>1.70×108IU/ml,Roche COBAS TaqMan HBV assay only showed HBV DNA level of>1.70×108IU/m l,but HBV DNA could be accurately quantified without being diluted by one-tube nested PCR assay.For sampleswith HBV DNA<1.00×102IU/ml,one-tube nested PCR assay could only detect the virus,but Roche COBASTaqMan HBV assay had better stability and linearity.Conclusions The detection result of HBV DNA quantification by one-tube nested PCR assay is consistent with that by Roche COBAS TaqMan HBV assay,and one-tube nested PCR assay,as a timesaving,laborsaving,and cheap method for quantifying HBV DNA levels,is suitable for application in China.
DNA,viral;hepatitis B,chronic;reagent kits,diagnostic
R342.4;R512.62
A
1007-8134(2014)04-0219-04
军队“十二五”面上课题(CWJ11J298)
614000乐山,武警四川省总队医院传染科(张继万、周建丽、张晓芳、罗丽莎);100039北京,解放军第三〇二医院临床检验医学中心(王海滨)
王海滨,E-mail:haibin_wang@sohu.com
