养血清脑颗粒对大鼠脑缺血再灌注损伤后神经干细胞增殖分化的影响☆
2014-04-28楼小亮席秋江胡雪勇李晓萍范华谭建萍
楼小亮 席秋江 胡雪勇 李晓萍 范华 谭建萍
养血清脑颗粒对大鼠脑缺血再灌注损伤后神经干细胞增殖分化的影响☆
楼小亮*席秋江*胡雪勇*李晓萍*范华*谭建萍*
目的探讨养血清脑颗粒对内源性神经干细胞增殖分化的影响和神经保护机制。方法应用TTC染色和免疫荧光双标技术观察脑缺血再灌注损伤后3 d、7 d、14 d、21 d神经缺损程度、脑梗死体积、Brdu平均荧光强度值和Brdu+Nestin荧光强度测定及治疗后的影响。结果①除假手术组外,模型对照组、养血清脑低剂量组和养血清脑高剂量大鼠均出现不同程度的神经功能缺损和脑梗死,各组大鼠不同时间点神经缺损评分和脑梗死体积均不一样,差异均有统计学意义(P<0.01);②治疗后第3、7、14、21天侧脑室下区(subventricular zone,SVZ)和海马齿状回颗粒下层(subgranular zone,SGZ)Brdu阳性细胞或Nestin阳性细胞其平均荧光强度值不同时间点间比较均有统计学差异(P<0.01)。低、高剂量组Brdu阳性细胞平均荧光强度值和Brdu+Nestin免疫双标荧光强度值均高于模型组(P<0.01)。结论养血清脑颗粒能促进缺血再灌注脑损伤大鼠神经功能恢复减轻脑梗死体积,对脑缺血再灌注损伤后神经干细胞增殖分化有促进作用。
养血清脑颗粒 MCAO模型 大鼠神经干细胞
近年来,中医药在针对急性脑梗死的治疗研究中取得了一定的成效,养血清脑颗粒是一种中药复方制剂,其主要成分为川芎、当归、细辛、熟地等,具有增加脑血流量,改善软脑膜微循环,缓解脑血管痉挛的药理基础,从而起到改善慢性脑缺血,保护神经元的作用[1],在临床脑血管病的治疗中广泛应用[2-6],但其对缺血再灌注损伤后神经元是否有预防保护作用仍不清楚。故本研究采用BrdU标记技术和免疫组化方法观察养血清脑颗粒对脑缺血再灌注损伤后神经干细胞分化和增殖的影响,从神经再生角度探讨该药的神经保护作用机制,为临床用药提供理论依据。
1 材料与方法
1.1 动物与分组健康雄性SD大鼠116只,鼠龄8周,体重250~280 g(购自上海市西普乐-必凯实验动物有限公司,动物合格证号:2008001605415)。随机分为假手术组(n=20),模型组(n=32),养血清脑低剂量组(n=32),养血清脑高剂量组(n=32)。每组再分4个亚组,分别在缺血再灌注后4个时间点3 d、7 d、14 d、21 d处死动物。
1.2 模型的建立以10%水合氯醛0.3 mL/kg腹腔麻醉,仰卧姿势固定于手术台上。分离动脉鞘,分离出右颈总、右颈外、右颈内动脉和伴行的迷走神经,结扎右颈总、右颈外动脉,之间近分叉处备一根线不要系紧,用来插栓线时防止出血。以动脉夹夹闭右颈内动脉近分叉处,备线近心端用眼科剪将动脉剪一小口,根据大鼠重量所选线栓自小口刺入右颈内动脉,松开动脉夹,插入鱼线,进入颈内动脉后,当线头前端到达大脑前动脉处遇阻力,停止送线,成功后结扎备线。栓塞右侧大脑中动脉,栓线尾端部分固定于皮肤上。缺血达到2 h后小心抽出栓线,即形成再灌注。
1.3 神经功能评分标准大脑中动脉闭塞后,分别在缺血后2 h、缺血再灌注3 d、7 d、14 d、21 d,参考longa评定神经功能缺损程度的5级4分法标准[7]进行神经功能评分。
1.4 给药方法将养血清脑颗粒溶于蒸馏水中配成溶液,浓度为10 g/100 mL,根据预实验以及人体和大鼠用药对比的结果,养血清脑低剂量组按0.5 g/kg给药;高剂量组按1 g/kg灌胃;模型对照组以等量蒸馏水灌胃。各组大鼠于再灌注清醒后即给药,2次/d,直至处死前。
1.5 BrdU标记方法行免疫组化的SD大鼠在处死前两天需腹腔注射BRDU生理盐水标记,按100 mg/kg,2次/d,处死大鼠需内外固定以备免疫组化分析。
1.6 TTC染色先肉眼观察出血情况,再用2%TTC溶液37℃避光孵育30 min,用10%甲醛固定。正常脑组织可染成深红色,梗死灶为白色,数码照相机摄片。所得图片用Image-pro plus6.0图像分析软件计算梗死体积。计算公式为:CIV= [RT-(LT-LI)]×d,CIV为相对梗死体积,RT为右半球面积,LT为左半球面积,LI为梗死面积,d为切片厚度。
1.7 免疫组织化学ABC染色切片放入24孔板内,用0.01 MPBS漂洗3遍后,加入3%Triton-x 100的0.01MPBS破膜以及0.03%H2O2去除过氧化物酶后。含2%正常羊血清(NGS)和3%BSA的0.01MPBS,室温30 min;加入小鼠抗Brdu(1:50 ZM-0013中杉金桥)和兔抗Nestin(1:50 BA-1289 BOSTER)4℃孵育24 h。0.01MPBS漂洗3次,每次10 min;加入山羊抗小鼠IgG/FITC(1:100 ZF-0312中杉金桥)和山羊抗兔IgG/TRITC(1:100 ZF-0316中杉金桥)1:200),室温避光2 h。4.0.01MPBS漂洗3次,荧光封片剂封片后荧光倒置显微镜下拍片保存。各组另取两张片为阴性对照,一张不加入一抗,另一张不加入二抗,余步骤同上。
1.8 统计学方法采用SPSS10.0进行统计处理,数据采用±s)表示,各组间比较采用重复资料的方差分析,检验水准α=0.05。
2 结果
2.1 脑缺血再灌注神经功能缺损评分除假手术组外,大鼠造模后均出现不同程度的神经功能缺损,提尾时损伤对侧前肢不能伸直,走路向对侧旋转或倾倒。各组大鼠不同时间点神经缺损评分不一样,而且不同组不同时间的变化趋势也不一样,差异有统计学意义(P<0.01);三组间神经缺损评分不一致,差异有统计学意义(P<0.01);但不同剂量的养血清脑颗粒组之间结果比较有差异,但无统计学意义(P>0.05)(见表1)。
2.2 TTC染色与脑梗死体积测定大脑中动脉阻塞2 h时后,各组造模大鼠均出现同侧大脑半球的梗塞。各组大鼠不同时间点脑梗塞体积不一样,而且不同组不同时间的变化趋势也不一样,差异有统计学意义(P<0.01),缺血第7天的梗塞体积增大到最大,其中养血清脑颗粒组与模型组梗塞体积相比较有差异,差异有统计学意义(P<0. 01)。但不同剂量养血清脑颗粒组之间结果比较有差异,但无统计学意义(P>0.05)(见表2)。
2.3 脑缺血再灌注损伤后不同时间Brdu和Nestin的变化免疫组化双标显示不同组别不同时段Brdu阳性细胞主要分布在缺血侧海马齿状回颗粒下层(SGZ)、侧脑室室管膜及室管膜下区(SVZ)和皮质,部分Brdu阳性细胞同时与Nestin染色呈阳性,见图1、2、3、4;随缺血再灌注时间的延长,平均荧光强度值增加,其中造模后第14天侧SVZ区Brdu阳性细胞平均光密度值最高,与其他时间段相比,有显著差异(P<0.01),第7天海马齿状回颗粒下层Brdu阳性细胞平均光密度值最高,与其他时间段相比,有统计学差异(P<0.01)。
在SVZ和SGZ区Nestin阳性细胞平均光密度值均于第7天表达最高,与各时段相比有统计学差异(P<0.01)。其中Brdu+Nestin免疫双标均在第7天表达明显(见图3、4)。表明在SVZ和SGZ存在大量的神经干细胞增殖分化。

表1 各组大鼠神经功能评分

表2 养血清脑颗粒对脑梗死体积的影响(mm3)
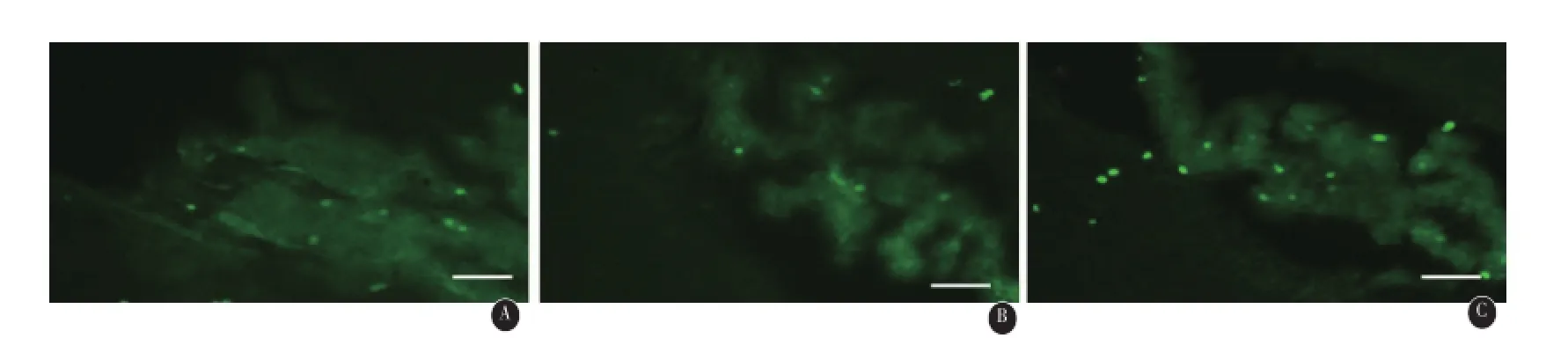
图1 缺血再灌注第14天模型组与治疗组侧脑室室管膜及室管膜下区(SVZ)Brdu免疫荧光标记图片:A示模型组、B低剂量组、C高剂量组,比例尺为50μm

图2 缺血再灌注第7天模型组与治疗组海马齿状回颗粒下层(SGZ)Brdu免疫荧光标记图A模型组、B低剂量组、C高剂量组,比例尺为50μm

图3 缺血再灌注第7天模型组与治疗组侧脑室室管膜及室管膜下区(SVZ)Brdu+Nestin免疫双标图片A模型组、B低剂量组、C高剂量组,比例尺为50μm

图4 缺血再灌注第7天模型组与治疗组海马齿状回颗粒下层(SGZ)Brdu+Nestin免疫双标图片A模型组、B低剂量组、C高剂量组,比例尺为50μm
2.4 脑缺血再灌注损伤后不同时间大鼠脑缺血SVZ和SGZ区的Brdu阳性细胞治疗后第3、7、14、21天SVZ和SGZ区Brdu阳性细胞平均荧光强度值不同时间点间比较有统计学差异(P<0.01)。三组比较有统计学差异(P<0.01),任意两组比较也均有统计学差异(P<0.01),高剂量组Brdu阳性细胞平均荧光强度值高于低剂量组,其中造模后第14天SVZ区的阳性细胞平均荧光强度值最高(见表3)。造模后第7天SGZ区的阳性细胞平均荧光强度值最高(见表3)。
2.5 脑缺血再灌注损伤后不同时间大鼠脑缺血SVZ和SGZ区的nestin阳性细胞治疗后第3、7、 14、21天SVZ和SGZ区nestin阳性细胞平均荧光强度值不同时间点间比较有统计学差异(P<0.01)。三组比较有统计学差异(P<0.01),任意两组比较也均有统计学差异(P<0.01),高剂量组nestin阳性细胞平均荧光强度值高于低剂量组,其中造模后第7天SVZ区的阳性细胞平均荧光强度值最高(见表4)。造模后第7天SGZ区的阳性细胞平均荧光强度值最高(见表4)。
3 讨论
我们发现脑卒中患者神经缺损均有一定程度的恢复,说明脑卒中可以诱导一定数量的神经元再生,但绝大多数新生成的神经元均过早死亡。缺血后14 d由干细胞生成的神经细胞逐渐减少,在3~5周后回到原来的水平[8-9]。中风后2~6周成年大鼠约80%或更多的新生神经细胞灭亡[10]。说明如果没有好的环境,新生的神经元将被暴露在有害的环境中,神经组织的再生和修复就会受到限制。因此需给予外源性药物进一步增强内源性神经干细胞的增殖和分化,会有助于明显增强神经缺损功能的恢复。

表3 各组大鼠脑缺血SVZ和SGZ Brdu阳性细胞平均荧光强度值
表4 各组大鼠脑缺血SVZ和SGZ nestin阳性细胞平均荧光强度值(±s)

表4 各组大鼠脑缺血SVZ和SGZ nestin阳性细胞平均荧光强度值(±s)
1)与模型组比较P<0.01,2)与低剂量组比较P<0.01
组别SVZ模型组SVZ低剂量组SVZ高剂量组SGZ模型组SGZ低剂量组SGZ高剂量组n8 8 8 8 8 8 3 d 10.30±0.39 13.23±0.291)15.16±0.311)2)11.94±0.28 14.18±0.511)19.68±0.461)2)7 d 17.84±0.68 21.05±0.941)34.81±0.891)2)22.13±0.58 28.55±0.761)30.12±0.821)2)14 d 14.77±0.79 17.93±0.381)20.51±0.781)2)17.46±0.48 21.64±0.571)24.82±0.761)2)21 d 12.33±0.57 12.66±0.641)13.01±0.381)2)14.85±0.15 15.03±0.031)15.63±0.411)2)
本实验结果提示大鼠缺血再灌注后通过养血清脑颗粒干预后,其神经缺损评分均有不同程度改善。各组造模大鼠均出现包括皮质和外侧基底节的梗死灶,梗塞灶及缺血侧脑体积在7 d时达最高峰,这与以往文献报道的结果相似[11]。
BrdU可以竞争进入细胞增殖S期单链DNA核苷酸序列,而在细胞中永久存在,因此BrdU阳性细胞被认为是只有增殖活性的细胞[12]。故BrdU是反映细胞增殖状态的理想标志物,BrdU免疫阳性细胞的数目基本可代表脑内神经前体细胞的增殖水平[13]。本实验中治疗组和模型组大鼠BrdU阳性细胞SVZ区14 d达到峰值,21 d开始下降,与假手术组比较都有明显升高(P<0.05),SGZ区7 d达顶峰后逐渐下降,与假手术组比较都有明显升高(P<0.05),说明了脑缺血再灌注损伤促进了神经再生,这与大多数文献相符合。nestin特异性蛋白,现已被证实属于中间丝蛋白,在病理情况下,受损脑组织神经干细胞蛋白Nestin阳性表达水平,可作为监测神经干细胞发生水平的敏感性指标之一[14-15]。
本研究通过BrdU和nestin免疫双标荧光染色发现,nestin阳性细胞被BrdU标记,至再灌注7d时达到高峰,21 d时双标阳性细胞显著减少,结果提示处于静息状态的NSC在受到缺血刺激后开始出现增殖,于再灌注后7 d最为活跃,至21 d时,NSC增殖已明显减弱。说明脑组织存在可塑性,能进行自我修复。
当前大多数学者认为,脑损伤后各类细胞释放因子可通过细胞受体刺激其分裂增殖,同时又能使增殖的细胞产生和释放细胞因子,这些因子反过来通过邻近、自身或者胞内效应又提高它们的增殖的能力,主要表现在3~7 d,而7~21 d恢复趋势基本平稳,表明其自我修复能力是有限的。治疗组BrdU含量显著高于相对应时间点模型组( P<0.05),说明养血清脑颗粒在一定程度上能够促进神经前体细胞增殖,以高剂量组尤其明显。而由养血清脑颗粒组BrdU和nestin双标荧光染色阳性细胞计数显示,其相对于模型组在各时间点显著升高(P<0.05),说明在神经干细胞增殖期,养血清脑颗粒能够促进nestin的表达,从而促进神经再生。而nestin的表达呈现出的时间特性,可能与脑损伤后早期诱导正常海马齿状回脑细胞向胚胎期多潜能细胞转化,或者是各脑区本身就存在着“休眠状态”的干细胞亚群,在各种干预因素的作用下,细胞分裂分化的潜能被激活,从而出现nestin增殖表达的现象,而且这种增殖分化随着缺血的改善和时间的推移而增强。当促进增殖的各种因素随着时间的延长而消失时,nestin的表达也将会逐渐下降。
因此,通过养血清脑颗粒来调节脑组织相关基因与内源性神经营养因子的表达以促进NSC的增殖、分化等,就成为了养血清脑颗粒治疗缺血性脑卒中的重要研究思路,这为其可以早期给药治疗提供了实验依据,也为更深入研究脑梗死机制提供理论依据。
[1] 张玲,褚扬,马晓慧,等.养血清脑颗粒的药理作用研究进展[J].医学综述,2011,17(5):769-771.
[2] Xiong L,Zhang J J,Sun D,et al.Therapeutic benefit of Yangxue Qingnao granule on cognitive impairment induced by chronic cerebral hypoperfusion in rats[J].Chin J Integr Med,2011,17(2):134-140.
[3] 黄登鹏.养血清脑颗粒治疗急性脑梗死临床观察[J].中草药,2005,36(5):728.
[4] 李东.养血清脑颗粒联合尼莫地平治疗脑梗死临床观察[J].中国现代药物应用,2013,7(10):90-91.
[5] 陶涛,秦新月,徐广会.养血清脑颗粒对大鼠脑缺血再灌注损伤后轴突再生及RGMa表达的影响[J].第三军医大学学报,2013,35(7):635-638.
[6] 陶涛,秦新月,徐广会.养血清脑颗粒对缺血/再灌注大鼠脑炎性因子表达和轴突再生的影响[J].重庆医科大学学报,2013,38(6):592-594.
[7] longa EZ,Weinstein PR,Carlson s.et al.Revesrible middle cerebral artery occlusion without craniectomy in rats[J].Storke, 1989,20(1):84-91.
[8] Liu J,Solway K,Messing R O,et al.Increased neurogenesis in the dentate gyrus after transient global isehemia in gerbils[J].J Neurosci,1998,18(19):7768-7778.
[9] Sharp,FR,Liu J,Bernabeu R.Neurogenesis following brain ischemia[J].Brain Res.Dev.BrainRes,2002,134(1-2):23-30.
[10] ArVidsson A,Collin T,Kirik D,et al.Neuronal rep lacement fromendogenous precursors in zhe adult brain afrer srore[J]. Nat Med,2002,8(9):963-970.
[11] Persson I,Hardemark HG,Bolander HG.Et al Neurologic and neurologic and neuropathologyic outcome after middle cerebral artery occlusion in rats[J].Stroke,1989,20(5):641-645.
[12] Takagi Y,Nozaki K,Takahashi J,et al.Proliferation of neuronal pr ecursor cells in the dentate gyrus is accelerated after transient forebrain ischemia in mice[J].Brain Res,1999,831(1): 283-287.
[13] 张志军,万琪,江文,等.成年大鼠脑缺血在灌注后海马齿状回神经发生的试验研究[J].中华老年心脑血管病杂志,2002,4(5):345-348.
[14] Reynolds BA,Weiss S.Generation of neurons and astrocytes fromisolated cells of the adult mammalian central nervous system.Science.1992,255(5052):1707-1710.
[15] Bengzon J,Kokaia Z,Elmer E,et al.A poptosis and prolieration o f dentate gyrus neurons after single and intermittent iimbic seizures[J].PNAS,1997,94(19):10432-10437.
The effects of Yangxue Qingnao Granule on proliferation and differentiation of neural stem cells in MCAO modelrats.
LOU Xiaoliang,XI Qiujiang,HU Xueyong,LI Xiaoping,FAN Hua,TAN Jianping.The Fourth Affiliated Hospital of NanChang University 133 in South Square Road,Nanchang 330003,China.Tel:0791-87021427.
ObjectiveTo investigate the effects of Yangxueqingnao Granule on the proliferation and differentiation of endogenous neural stemcells and their neuroprotective mechanismafter brain ischemia.MethodsCerebral ischemia was induced in rats by temporary middle cerebral artery occlusion.Ischemic animals received Yangxue Qingnao Granule at high and lowdoses at days 3,7,14,and 21 after MCAO.Neurological score and TTC staining were used to assess the neurological deficits and the volume of cerebral infarction,respectively.Immunohistochemistry was used to detect Brdu and Nestin expression in the subventricular zone(SVZ)and hippocampal dentate gyrus subgranular zone(SGZ)region.ResultsThe rats in MCAO control group,lowdose group and high dose group showed varying degrees of neurological deficits and the volume of cerebral infarctions.The neurological defect scores and volume of cerebral infarction were significantly different at different time points in each group(P<0.01).2.The mean fluorescence intensity values of Brdu positive cells or the Nestin positive cells in SVZ and SGZ regions were significantly different(P<0.01)at different time points after treatment for 3,7,14 or 21 days.The mean fluorescence intensity values of Brdu positive cells or the Nestin positive cells in SVZ and SGZ regions were significant different among lowdose group,high dose group and MCAO control group.The mean fluorescence intensity values of Brdu positive cells or the Nestin positive cells in SVZ and SGZ regions were significantly different among lowdose group,High dose group and control group.High dose group significantlyincreased the mean fluorescence intensity values of Brdu positive cells or the Nestin positive cells in SVZ and SGZ regions.Concu lsionsYangxue Qingnao Granule is able to promote the functional recovery and reduce the volume of cerebral infarction in ischemic rats.Yangxue Qingnao Granule can enhance the proliferation and differentiation of endogenous neural stemcells in ischemic rats.
Yangxue Qingnao Granule MCAO rats Neural stemcell
R743
A
2013-12-31)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.07.003
☆江西省卫生厅中医药科研重点项目(编号:2008Z010)
*南昌大学第四附属医院神经内科(南昌330003)
