结肠腺瘤性息肉病基因蛋白在二甲肼诱导大鼠大肠癌过程中的表达*
2014-04-28马晓强王伟杰
马晓强,王伟杰,李 海
(宁夏医科大学总医院结直肠外科,宁夏 银川 750004)
结肠腺瘤性息肉病基因(APC)是一种抑癌基因,能调节细胞 生长和自身稳定[1]。目前,许多研究已经证实,Wnt信号转导途径失调是人类大肠癌的发生中的早期事件,其中APC蛋白在Wnt信号通路中起关键的抑制作用。可以说,APC蛋白是一个分子“守门人”,尤其在腺瘤发生发展进程中。由于基因产物的改变,往往始于APC的突变,且相应的突变在恶性肿瘤中稳定存在,从而造成肿瘤的发生和细胞的无序分裂[2]。因此,通过动态观察APC蛋白,了解其表达情况,能加深对APC蛋白及其与大肠癌演变过程之间相互关系的认识,从而实现大肠癌的早发现、早诊断和早治疗,具有重要的现实意义。
1 材料与方法
1.1 动物与试药
SD大鼠60只,雄性,6~8周龄,体重200~250 g,由宁夏医科大学实验动物中心提供,合格证编号为SCXK<宁>2005-0001。普通饲料(北京科澳饲料公司)。二甲肼(DMH,日本东京化成工业株式会社)。
1.2 方法
动物模型的建立和分组:将60只SD大鼠随机分为模型组40只,正常对照组(C组)20只。两组大鼠采用标准同型普通饲料喂养,自由饮水,光照时间为12 h,室温25℃,相对湿度50%环境下分笼饲养,每笼 4只。将二甲肼(DMH)溶于 0.001 mol/L的 EDTA溶液,配成 8 g/L的 DMH溶液,备用。模型组大鼠皮下注射 DMH溶液,每周1次(20 mg/kg);对照组皮下注射与模型组DMH等体积的生理盐水,每周1次,两组同时维持给药25周。分别于第 15周和25周[即大肠腺瘤组(A组)和大肠癌组(B组)]时处死大鼠,两组各20只,收集大肠组织标本。将其中的一部分大肠组织标本放入-80℃冰箱中,拟行免疫蛋白印迹检测;将剩下的大肠组织标本以甲醛固定,石蜡包埋,进行免疫组化染色。
1.2.1 免疫组织化学检测
将大鼠大肠癌组织石蜡切片、脱蜡和水化后,以磷酸盐缓冲液(PBS)冲洗 3次(每次 2~3 min),对组织抗原进行相应的修复。每张切片加3%过氧化氢50 μL阻断,溶液室温放置10 min,再用 PBS冲洗 3次(每次 2~3 min),移去 PBS液。滴加浓度为1∶100的兔抗鼠APC多克隆抗体,4℃条件下放置过夜。然后以 PBS冲洗 3次,每次3 min,移去 PBS液。在滴加聚合物辅助剂后室温下孵育 20 min,用 PBS冲洗 3次,每次 3 min。移去PBS液,滴加辣根酶标记山羊抗兔/大鼠IgG多聚体,室温下孵育 30 min,PBS冲洗 3次,每次 3 min。除去 PBS,每张切片加 2滴新鲜配制的 3,3-四盐酸二氨基联苯胺(DAB)液,显微镜下观察 3~10 min。自来水冲洗,苏木素复染,PBS冲洗返蓝。DAB显色,梯度酒精脱水,中性树胶封固。免疫组化染色结果判定标准见表 1。两项计分相乘之积在 0~5分之间记为“-”,5~12分记为“+”。
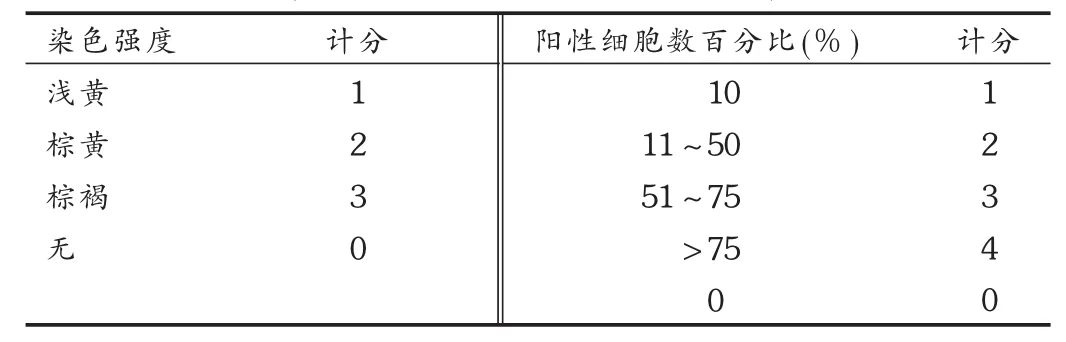
表1 APC免疫组化染色判定标准
免疫蛋白印迹技术检测:将去除脂肪组织和结缔组织等非目的组织的固体组织样本剪碎,匀浆,加入含有苯甲基磺酰氯(PMSF)的 RIPA裂解液500 μL裂解组织,提取总蛋白,使用BCA蛋白浓度测定试剂盒测定蛋白浓度。制备10%分离胶和5%浓缩胶,每孔上样50 μg进行 SDS-PAGE电泳。其中浓缩胶条件为80V 45 min,分离胶 110V 90 min;350 mA恒流电转 130 min至PVDF膜。用含5%脱脂奶粉的TBST缓冲液4℃封闭过夜。分别加入兔抗大鼠 APC抗体(浓度为1∶200)、兔抗大鼠 β-actin抗体(1∶1 000)室温孵育 2 h。TBST洗膜 3次,加入 HRP标记的山羊抗兔 IgG抗体(浓度1∶1 000)和HRP标记的山羊抗小鼠 IgG多抗(浓度 1∶1 000)室温孵育 1 h。TBST洗膜 3次,加入 ECL化学发光试剂自显影、曝光。用凝胶分析软件对图像进行分析。APC蛋白的相对表达量用APC蛋白灰度值/β-actin蛋白灰度值表示。
1.3 统计学处理
采用SPSS 11.5统计软件。经凝胶分析软件所得的相对强度以±s表示,组间均数比较采用 t检验。组间率的比较采用 χ2检验或四格表资料的Fisher确切概率法。假设检验的显著性水准取 α = 0.05。
2 结果
2.1 动物建模结果观察
大鼠大肠组织HE染色后镜下观察发现,C组大鼠大肠组织无异常变化,组织弹性好,与周围组织无黏连,肠腔少量正常粪粒。A组大鼠大肠组织可见数量不等的绒毛状成分,同时表现为程度不一的上皮异型性增生,一般轻至中度。B组大鼠大肠组织根据来源和分化程度的不同在组织学上表现较为多样,其中乳突状腺癌表现为粗细不等的乳突状结构,乳头细长,癌细胞呈柱状,可具有不同的分化程度;管状腺癌由腺管状结构组成;黏液腺癌则以大量黏液为特征或为囊腺癌结构,囊内充满黏液等。
2.2 免疫组织化学法检测APC蛋白的表达情况
结果见表2和图1。APC染色阳性位置主要在大肠细胞的细胞浆中,细胞浆内可见棕黄色或黄色颗粒沉积,A组和B组大鼠组织中均未见有阳性表达;C组大肠细胞组织中阴性10例(50.00%),阳性 10 例(50.00%)。组间比较,差异有统计学意义(P<0.05)。充分说明APC蛋白在正常大鼠大肠组织中的阳性表达率明显高于在大肠腺瘤、大肠癌组织的阳性表达率。

表2 APC蛋白在大肠腺瘤、大肠癌与正常组织中的表达

图1 3组大鼠APC蛋白的表达情况(免疫组化法)
2.3 免疫印迹法检测APC蛋白的表达情况
结果见表3和图2。正常大肠组织经Western-blot技术检测后,均表现为包含有1条特异性条带,其相对分子质量约为300×103,而该条带在大肠腺瘤及大肠癌组织却未曾发现。利用凝胶分析软件进行半定量分析,分别得出 IOD值,并跟β-actin比较,显示APC蛋白的表达在大肠腺瘤、大肠癌与正常组织中差异有统计学意义(P<0.05),而在大肠腺瘤与大肠癌组中差异无统计学意义(P >0.05)。
表3 APC在大肠腺瘤与正常组织中的相对表达强度(±s)
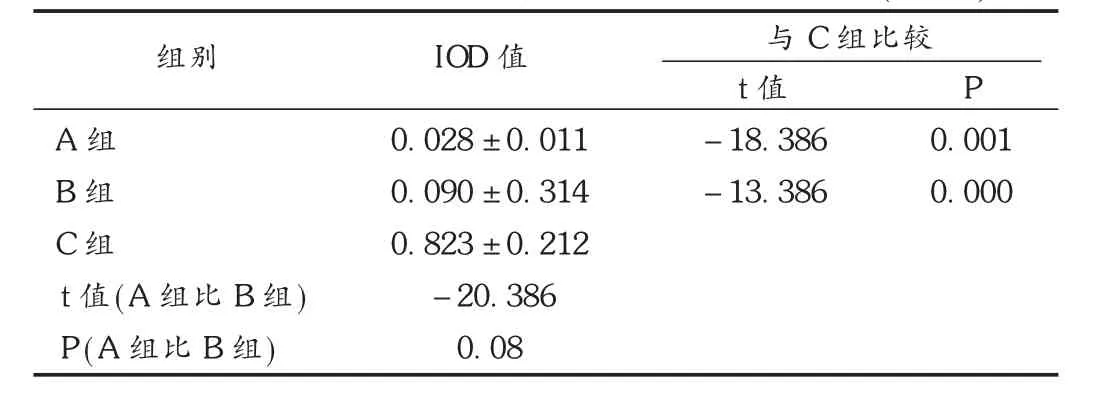
表3 APC在大肠腺瘤与正常组织中的相对表达强度(±s)
与C组比较组别 I O D值P A组B组C组t值(A组比B组)P(A组比B组)0.0 2 8 ± 0.0 1 1 0.0 9 0 ± 0.3 1 4 0.8 2 3 ± 0.2 1 2- 2 0.3 8 6 0.0 8 t值- 1 8.3 8 6- 1 3.3 8 6 0.0 0 1 0.0 0 0

图2 3组大鼠APC蛋白的表达情况(免疫印迹法)
3 讨论
大肠癌是常见的消化系统恶性肿瘤[3],世界范围的流行病学调查资料表明,在西方发达国家与癌症相关的死亡原因中排第2位,严重威胁着人类生命健康。在我国,大肠癌的发病率呈逐年增高的态势,发病率居第4位[4]。关于大肠癌的发生发展过程,有两种学说:一是腺瘤-癌序列相关学说,即所谓传统概念[5];一是近年来发现的新生癌学说,它不经过腺瘤性息肉阶段,直接由大肠黏膜发生癌变产生[6]。近年来,虽然在分子生物学水平和蛋白质组学方面对其机制的探讨取得了较大进展,但对于大肠癌的组织发生情况一直存在着不同的观点。鉴于实验性肿瘤模型在研究癌症原因、早期治疗、疾病预防的重要作用,因此通过建立实验性大肠癌动物模型,探讨大肠癌形态的动态变化和进展方式,显得尤为重要。本研究中对大鼠进行二甲肼皮下注射建立了大肠腺瘤-癌序列动物模型,并观察了APC蛋白在大肠癌发病过程中的变化情况,以期发现新的治疗靶点。
近年来的研究结果表明,多个抑癌基因的失活和癌基因的激活与大肠癌的发生、发展关系密切,牵涉到相关的组织形态学改变和进行性分子遗传学改变,其中APC被认为是热点基因[7],与大肠腺癌发生关系密切。APC蛋白是由Herrera进行细胞遗传学研究时发现的一个新的抑癌基因(1986年),在许多组织中几乎都有表达,它不仅调节机体自身稳定,还可促进细胞生长[8]。Wnt的信号传导通路离不开APC蛋白的参与,细胞特化、增殖、极性以及迁移的正常调节离不开Axin及Osk-3D与正常组织 APC蛋白的结合形成复合物[9]。截短的无活性的APC蛋白系APC基因突变所导致编码的APC蛋白的改变,野生型APC蛋白产物不能正常地发挥生理功能,关键是截短APC蛋白与其结合所产生的一种负显性作用,能导致细胞癌变的发生,大到细胞黏附和生长,小到细胞分化、增殖及凋亡调控和细胞内信号等全方位的改变[10]。通过不同组间大鼠大肠组织免疫组化分析发现,APC蛋白在正常对照组强阳性表达,而在大肠腺瘤组和大肠癌组中无表达。这表明在大肠癌发病过程中APC蛋白表达的抑制发挥了一定的作用。进一步分析发现,大肠腺瘤组和大肠癌组大鼠间APC蛋白的表达未见明显差异,提示在大肠组织不典型增生至肿瘤发生过程中APC蛋白所起的作用不明显。这也在一定程度上提示,在肿瘤发生和发展过程中,还有其他因素的参与,这一点在大鼠大肠组织免疫印迹分析中得到了证实。免疫印迹分析结果显示,APC蛋白在正常对照组大鼠大肠组织中高表达,而在大肠腺瘤组和大肠癌组大鼠组织中则未见明显表达。
综上所述,APC蛋白在大鼠大肠癌的发病过程中可能起到了启动作用,在后期疾病恶化过程中可能还有其他的因素参与。APC蛋白可望作为早期预防和检测的靶点,而更多的大肠癌发病机制还有待今后进一步深入的研究。
参考文献:
[1]孙 健,卢 健,邹冬芳,等.结肠腺瘤性息肉病基因异常甲基化在上皮性卵巢癌中的检测及临床意义[J].东南国防医药,2008(6):414-417.
[2]陈 玲,叶韵斌,陈燕坪,等.大肠癌组织中核转录因子-κBp65及磷酸酶和张力蛋白同源缺失基因的表达及意义[J].中国肿瘤临床与康复,2013(10):1 057 -1060.
[3]孔 易,郑纪宁.GST-π和 P-gp在大肠癌中的表达及意义[J].承德医学院学报,2013,30(6):453-455.
[4]王婷婷,陈森清,张晓梅,等.中国人家族性腺瘤性患肉病患者结肠腺瘤性息肉病基因的胚系突变[J].中华医学遗传学杂志,2008,25(2):199-202.
[5]王 成,郑 多.结肠腺瘤性息肉病蛋白通过与SMAP/KAP3相互作用与微管结合[J].生物化学与生物物理进展,2002,29(6):885-890.
[6]周留林,杨继实,陈友国,等.β-catenin和APC蛋白在子宫内膜腺癌中的表达及意义[J].实用临床医药杂志,2008(12):32-36.
[7]王震凯,刘 炯,汪芳裕,等.β-连环蛋白和APC蛋白在胃腺瘤和胃癌中的表达及意义[J].胃肠病学和肝病学杂志,2011,20(5):404-406.
[8]孙 政,曹 杰,梁立源,等.CCN2及APC蛋白在结直肠癌组织中的表达及意义[J].广东医学,2012,33(11):1 556 -1 559.
[9]王 伟,满晓华,湛先保,等.APC蛋白在胰腺癌及其癌前病变中的表达差异分析[J].胃肠病学,2012,17(5):266 -270.
[10]黄婵娟,农朝赞,顾国龙,等.苦丁茶熊果酸诱导鼻咽癌细胞凋亡及其对 Survivin和 APC蛋白表达的影响[J].广东医学,2011,32(7):830-832.
