高效液相色谱法测定人血清中伏立康唑的质量浓度
2014-04-28张燕青林雪玉朱金平
张燕青,林雪玉,朱金平,费 燕
(中国人民解放军第一七五医院·厦门大学附属东南医院药学科,福建 漳州 363000)
伏立康唑(voriconazole,VRC)是第2代三唑类抗真菌药物,具有抗真菌谱广、生物利用度高、安全且可通过血脑屏障等特点,在真菌感染防治中发挥着重要作用。临床研究发现,伏立康唑的有效性和安全性与其血清质量浓度密切相关[1-3],有效质量浓度范围为 2 ~5μg/mL[3],大于 6 μg/mL 时肝脏毒性的发生风险显著增加[4]。伏立康唑体内代谢呈非线性药物代谢动力学特征,血药浓度在不同患者间差异较大,临床可通过监测其血药浓度来提高临床疗效、减少不良反应的发生。笔者采用高效液相色谱(HPLC)法测定人血清中伏立康唑浓度,方法简单可靠、相关性好,可用于伏立康唑的血药浓度常规检测。
1 仪器与试药
高效液相色谱仪(美国 Waters公司),包括510泵,717自动进样器,996二极管阵列检测器;Milli-Q纯水器(美国Millipore公司);XW-80A型旋涡混合器(上海医科大学仪器厂);电子分析天平(日本岛津AEG-120型);TGL-16M型台式高速冷冻离心机(长沙英泰仪器有限公司)。伏立康唑对照品(中国药品生物制品检定所,批号为100862-200701);内标为硝西泮对照品(中国药品生物制品检定所,批号为 171217-200402);乙腈、甲醇(Tedia公司,色谱纯),其他试剂均为分析纯,水均为双蒸水(本实验室自制)。
2 方法与结果
2.1 血清来源
采集健康体检者的静脉血,低速离心后,取上层血清制备空白血清,备用。采集诊断为侵袭性真菌感染,并使用伏立康唑进行治疗且达到稳态浓度的患者下次滴注伏立康唑前的静脉血,低速离心后,取上层血清备用,作为患者血清样品。
2.2 血药浓度测定
2.2.1 色谱条件
色谱柱:Hypersil ODS 柱(200 mm ×4.6 mm,5 μm);流动相:25 mmol/L 磷酸二氢钾缓冲液 -乙腈(32 ∶68);流速:1.0 mL /min;柱温:35 ℃;检测波长:256 nm;进样量:50 μL。
2.2.2 溶液配制
精密称取伏立康唑对照品30 mg,置25 mL的容量瓶中,用甲醇溶解至刻度,配成质量浓度1 200 μg/mL的对照品贮备液,4℃冰箱中保存备用。精密称取25 mg硝西泮对照品,置25 mL的容量瓶中,用甲醇溶解至刻度,配成浓度1 000 μg/mL的对照品贮备液,将该贮备液用甲醇稀释成25 μg/mL工作液,作为内标液,4℃冰箱中保存备用。
2.2.3 血清样品处理
精密取血清样品 200 μL于 1.5 mL Eppendorf管中,加入10 μL内标溶液,混匀后,加入乙腈 400 μL漩涡振荡 2 min,13 000 r/min离心 10 min,取上清液 200 μL进样分析。
2.2.4 方法学考察
标准曲线制备与检测限确定:取空白血清200 μL,置1.5 mL Eppendorf管中,精密量取不同质量浓度、相同体积的伏立康唑对照品溶液 10 μL,配成 0.3,0.6,1.0,1.5,3.0,6.0,12.0 μg/mL标准血清样品,再分别加入 10 μL内标液,按2.2.3项下方法处理,经HPLC分析,记录色谱图,测得伏立康唑峰面积A1与内标峰面积 A2,计算峰面积比 A1/A2。以血清质量浓度 C(mg/L)与峰面积比经最小二乘法线性回归,得标准曲线方程 Y=0.377 X-0.063 5,r= 0.999 3(n =7)。结果表明,伏立康唑质量浓度线性范围为 0.3~12 μg/mL。当信噪比(S/N)=3 时,伏立康唑的最低检测限可达到 0.3 μg/mL。
分离度与专属性试验:按拟订色谱条件对空白血清、伏立康唑标准品血清以及患者血清样品进行色谱分析,色谱图见图1。可见,伏立康唑与内标峰无明显的内生杂质峰干扰,两者的保留时间分别为 10.5 min 和 13.3 min。
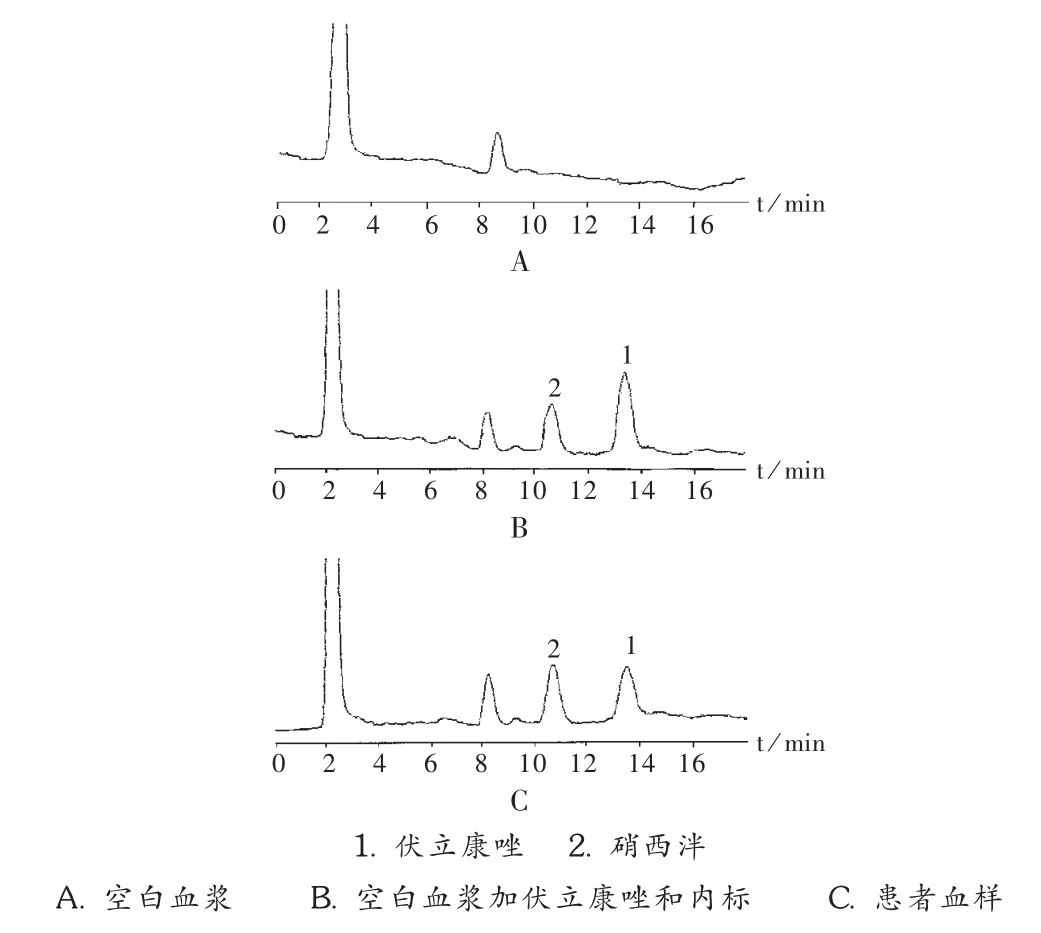
图1 伏立康唑高效液相色谱图
准确度试验:取空白血清 200 μL,置 1.5 mL Eppendorf管中,配制成质量浓度为 0.6,3.0,6.0 μg/mL 的血浆样品各5份,按2.2.3项下方法处理,进样,记录色谱图,考察方法回收率。结果见表1。

表1 伏立康唑的方法回收率试验结果(n=5)
精密度试验:取空白血清 200 μL,置 1.5 mL Eppendorf管中,配制成质量浓度为 0.6,3.0,6.0 μg/mL 的血浆样品各5份,按
2.2.3 项下方法处理,进样,记录色谱图,连续 4 d,测定日内和日间精密度。结果见表2。

表2 伏立康唑的日内、日间精密度试验结果(n=5)
稳定性试验:取空白血清 200 μL配制成质量浓度为 0.6,3.0,6.0 μg/mL 的血清样品各 3 份,室温放置,分别于第 0,6,12 h按 2.2.3项下方法处理,进样。结果的 RSD分别为 6.06%,4.21%,4.68%,说明血清样品在室温放置12 h内具有很好的稳定性。配制质量浓度为 0.6,3.0,6.0 μg/mL 的血清样品,置-20 ℃冰箱中,于第 1,3,5,7,10,14 d,按 2.2.3 项下方法处理,测定。结果表明,血清样品14 d内稳定性良好。配制质量浓度为0.6,3.0,6.0 μg/mL的血清样品各 3份,置 -20℃冰箱中,冻融 2次,冻融时间间隔 24 h,于冻融前、冻融后分别取样 200 μL,按 2.2.3项下方法处理。结果显示,冻融2次,质量浓度无显著性差异。
2.3 临床应用
采用本研究建立的方法为10例患者进行血药浓度监测,其中侵袭性肺部曲霉菌感染8例,骨髓炎(霉菌感染)2例;男7例,女 3 例;平均(42.8 ± 3.6)岁。测定的最大血药浓度达 5.5 μg/mL,最小为 0.98 μg/mL,平均值为 2.72 μg/mL;其中在治疗窗之内4例,占 40.00%;低于治疗窗5例,占50.00%;高于治疗窗 1例,占 10.00% 。
3 讨论
色谱条件的选择:采用二极管阵列检测器波长梯度方法,得到三维色谱光谱图。三维立体图显示,伏立康唑在256 nm波长处有最大吸收。以256 nm进行样本检测,出峰良好,出峰处无干扰,因而选择256 nm作为检测波长。试验过程中,试用文献[5-6]报道的氟康唑和酮康唑作为内标,发现在本实验室条件下,其保留时间在3 min内,不适宜作为内标。选用硝西泮作为内标,性质稳定,不干扰主峰,且保留时间合适;伏立康唑和硝西泮的保留时间分别为10.5 min和 13.3 min,且色谱峰不受内源性杂质干扰。由于伏立康唑的分子结构中含有三唑环、吡啶环等碱性基团,因此采用磷酸盐缓冲液作为流动相,保持流动相pH稳定,故选用磷酸盐缓冲液/乙腈为流动相。
样品处理方法的选择:血清样品的前处理一般采用固相萃取、液液萃取、高氯酸和三氟乙酸沉淀蛋白等方法,但考虑到固相萃取、液液萃取方法操作较复杂烦琐,高氯酸和三氟乙酸可能会对伏立康唑和内标造成氧化破坏,故采用2倍乙腈直接沉淀蛋白,蛋白沉淀较完全。
监测结果分析:临床伏立康唑常用于治疗和预防侵袭性真菌感染,常见的不良反应有神经功能障碍、视觉障碍、肝功能异常等[7-8]。文献报道,当伏立康唑血药浓度大于 6 μg/mL 时,肝功能损伤的发生率将明显增加,不良反应发生率升高,而低于2 μg/mL时,治疗效果不佳。伏立康唑主要通过肝脏细胞色素P450酶2C19代谢。CYP2C19基因是一个高度变异的多态基因,具有显著种族差异,在亚洲人群中造成慢代谢表型最主要的突变基因为CYP2C19*2和 CYP2C19*3。研究发现,CYP2C19慢代谢型组伏立康唑的稳态血药浓度是快代谢型组的5倍。本试验监测的10例患者伏立康唑谷浓度个体差异大,1例谷浓度高于治疗窗,5例谷浓度低于 2 μg/mL,4 例谷浓度在治疗窗 2 ~5μg/mL 之内。本试验中建立的检测人血清中伏立康唑质量浓度的高效液相色谱法灵敏、简单、专属性高,分离完全,峰形良好,可用于伏立康唑的药代动力学和血清药物浓度监测。
参考文献:
[1]Andes D,Pascual A,Marchetti O.Antifungal therapeutic drug monitoring:established and emerging indications[J].Antimicrob Agents Chemother,2009,53(1):24 -34.
[2]Neely M,Rushing T,Kovacs A,et al.Voriconazole pharmacokinetics and pharmacodynamics in children[J].Clin Infect Dis,2010,50(1):27-36.
[3]Troke PF,Hockey HP,Hope WW.Observational study of the clinical efficacy of voriconazole and its relationship to plasma concentrations in patients[J].Antimicrob Agents Chemother,2011,55(10):4 782-4 788.
[4]Denning DW,Ribaud P,Milpied N,et al.Efficacy and safety of voriconazole in the treatment of acute invasive aspergillosis[J].Clin Infect Dis,2002,34(5):563-571.
[5]辛 月.高效液相色谱法测定血浆中伏立康唑的浓度[J].中国医院药学杂志,2009,29(4):333 -334.
[6]史卉妍,彭 亮,谭志荣,等.高效液相色谱法测定人血浆中伏立康唑浓度[J].中南药学,2007,5(4):305-308.
[7]李明伟,余丽梅,张 维.伏立康唑治疗血液病合并侵袭性真菌感染42例[J].中国药业,2014,23(1):68-96.
[8]朱 萍,蒋正立 .伏立康唑的不良反应综述[J].中国药业,2011,20(23):95-96.
