小儿氨酚黄那敏颗粒制备工艺研究
2014-04-28郝晶晶李海亮
郝晶晶 李海亮
(北京卫生职业学院,北京 10053)
小儿氨酚黄那敏颗粒制备工艺研究
郝晶晶 李海亮
(北京卫生职业学院,北京 10053)
目的:研究湿法制粒法制备小儿氨酚黄那敏颗粒的影响因素及制备工艺。方法:采用正交试验设计,使用高效液相色谱法(HPLC)同时测定对乙酰氨基酚和马来酸氯苯那敏的含量均匀度,并通过综合评分优选制备工艺。结果:最佳制备工艺为:物料过100目筛,采用三维混合方式混合20 min,马来酸氯苯那敏以黏合剂方式加入,所制备的颗粒符合质量要求。结论:本研究所得最佳制备工艺操作简便,对乙酰氨基酚和马来酸氯苯那敏的含量均匀度较高,工艺稳定性较好。
小儿氨酚黄那敏颗粒;正交试验法;高效液相色谱法;对乙酰氨基酚;马来酸氯苯那敏;含量均匀度
小儿氨酚黄那敏颗粒是一种适用于缓解儿童普通感冒及流行性感冒常用的非处方药品,是一种复方制剂,由对乙酰氨基酚、马来酸氯苯那敏、人工牛黄以及适量的辅料组成。其中对乙酰氨基酚是最常用的一种非甾体抗炎解热镇痛药,马来酸氯苯那敏为H1受体拮抗剂,两者配伍,可增强其镇痛和缓解感冒所引起的鼻塞、流涕、打喷嚏等症状的作用。处方中马来酸氯苯那敏含量仅占万分之一,给生产工艺带来一定的困难。本品为小儿用药,在药品安全性和疗效方面值得高度重视,因此其制备方法和质量标准亟待提高。其中人工牛黄为多成分,且相关成分药典未作规定,本研究未对其进行成分测定。参考有关文献[1-3],采用正交试验设计,使用HPLC同时测定产品中对乙酰氨基酚和马来酸氯苯那敏的含量,优化该产品的生产工艺。
1 实验条件
1.1 主要仪器设备
HS型三维混合机(丹东市制药机械有限公司);CH型卧式混合机(天津市茂源制药机械有限公司);20型高效混合机(天津市茂源制药机械有限公司);YK60摇摆式颗粒机(上海天祥健台制药机械有限公司);Waters 1525高效液相色谱系统,Waters 2998PDA检测器,Empower色谱工作站,Waters科技(上海)有限公司;BP211D型sartorius电子天平,赛多利斯科学仪器北京有限公司。
1.2 材料
蔗糖(批号:20120301,云南富宁永鑫糖业有限公司),对乙酰氨基酚(98.0%,批号:20110907,天津市博发药业有限公司),马来酸氯苯那敏(99.0%,批号:20111127,上海沪源医药有限公司),牛黄(批号:20110902,重庆格瑞林药业有限公司)。
对乙酰氨基酚对照品(99.0%,批号:100018-200408,原中国药品生物制品检定所),马来酸氯苯那敏对照品(99.7%,批号:100047-200606,原中国药品生物制品检定所);甲醇(色谱纯)(Metl No. 10071753,Burdick&Jackson公司),水为重蒸馏水;磷酸二氢钾(批号:091129,天津石英钟厂霸州化工分厂),磷酸(批号:20100705,北京化工厂),三乙胺(批号:20100410,天津市福晨化学试剂厂),均为分析纯。
2 方法与结果
2.1 正交实验设计
根据预实验和文献报道,影响湿法制粒法制备小儿氨酚黄那敏颗粒生产工艺的主要因素为马来酸氯苯那敏的加入方式、物料的混合方式、混合时间、物料目数等。本试验以马来酸氯苯那敏和对乙酰氨基酚的含量均匀度为考察指标,进行了L9(34)正交试验。因素水平见表1。
2.2 颗粒的制备
具体制备处方见表2。
以制备5 000 g(1 000袋)小儿氨酚黄那敏颗粒的物料计算,先将药物和辅料采用万能粉碎机分别进行粉碎,将物料分别过60,80,100目筛。混合方式:①将马来酸氯苯那敏与其他药物直接加入糖粉中进行混合;②将马来酸氯苯那敏与牛黄、对乙酰氨基酚进行等量递加混合后再与糖粉进行混合;③药物直接加入糖粉混合后,再将马来酸氯苯那敏溶于黏合剂(蒸馏水)中以溶液形式加入到混合后的物料中。

表1 小儿氨酚黄那敏颗粒制备工艺的因素水平

表2 小儿氨酚黄那敏颗粒制备处方
将混合好的物料放入槽型搅拌设备中,并在搅拌同时加入300 mL蒸馏水作为黏合剂,搅拌5 min后制成软材。将制好的软材采用摇摆制粒机进行制粒,湿颗粒60℃干燥5 h后,再使用摇摆制粒机进行整粒,最后将香精和其他辅料等与干颗粒采用V型混合设备进行总混5 min后,分装小袋,即得小儿氨酚黄那敏颗粒。
2.3 颗粒中药物含量的测定
2.3.1 色谱条件Waters C18色谱柱(4.6 mm× 150 mm,5 μm),流动相为甲醇-磷酸二氢钾溶液-三乙胺(25∶75∶0.022,磷酸调pH=2.40),检测波长为262 nm,流速为1.0 mL/min,柱温为30℃,进样量为10 μL。以峰面积外标法定量,理论塔板数以对乙酰氨基酚计算不得低于3 000。
2.3.2 溶液的配制
2.3.2.1 对照品储备溶的配制精密称取马来酸加流动相适量,溶解,加流动相稀释至刻度,精密量取10.0 mL置于100 mL量瓶中,加流动相稀释至刻度,摇匀,即得;精密称取对乙酰氨基酚对照品250 mg于100 mL量瓶中,加流动相适量,溶解,加流动相稀释至刻度,摇匀,即得。
2.3.2.2 供试品溶液的配制精密称取装量的样品5 g(相当于含对乙酰氨基酚125 mg,马来酸氯苯那敏0.5 mg)置50 mL量瓶中,加流动相适量,溶解,加流动相稀释至刻度,过滤,取续滤液,得样品。
2.3.2.3 专属性试验溶液的配制按其工艺处方比例制备不含对乙酰氨基酚和马来酸氯苯那敏的阴性样品溶液,照上述样品溶液的制备制成专属性试验溶液。
2.3.3 专属性试验分别取对乙酰氨基酚、马来酸氯苯那敏对照品溶液、阴性样品溶液、供试品溶液注入高效液相色谱仪,记录色谱图,对乙酰氨基酚的保留时间约7.2 min,马来酸氯苯那敏的保留时间约2.8 min,阴性溶液无干扰,见图1。

图1 专属性试验HPLC图
2.3.4 重现性试验按照2.3.2.2方法制备6份供试品溶液,按样品含量测定方法测定马来酸氯苯那敏含量为100.7%,RSD=0.7%(n=6);对乙酰氨基酚含量为102.8%,RSD=1.9%(n=6),表明重现性良好。
2.3.5 线性关系考察
2.3.5.1 马来酸氯苯那敏精密吸取马来酸氯苯那敏对照品储备液15,20,25,30,35,40,45 mL分别定容至50 mL,摇匀。按上述色谱条件,分别精密吸取25 μL注入高效液相色谱仪中,进行测定,记录峰面积。以马来酸氯苯那敏的峰面积A对浓度C(mg/mL)进行线性回归,对照品溶液浓度范围0.006~0.018 mg/mL,得回归方程

2.3.5.2 对乙酰氨基酚精密吸取对乙酰氨基酚对照品储备液10,15,20,25,30,35,40 mL,分别定容至50 mL,摇匀。按上述色谱条件分别精密吸取25 μL注入高效液相色谱仪中,进行测定,记录峰面积。以马来酸氯苯那敏的峰面积A对浓度C(mg/mL)进行线性回归,对照品溶液浓度范围1~4 mg/mL,得回归方程

2.3.6 精密度试验分别取0.008,0.012,0.016 mg/mL马来酸氯苯那敏对照品溶液25 μL,分别连续进样5次,测得马来酸氯苯那敏峰面积的RSD分别为1.26%,1.62%,1.25%(n=5),表明精密度良好;分别取1.5,2.5,3.5 mg/mL对乙酰氨基酚对照品溶液25 μL,分别连续进样5次,测得对乙酰氨基酚峰面积的RSD分别为1.24%,1.39%,0.84%(n=5),表明仪器精密度良好。
2.3.7 稳定性试验取样品溶液1份,于0,1,2,3,4,5 h,分别进样,依法测得马来酸氯苯那敏和对乙酰氨基酚的峰面积,RSD分别为2.0%和2.2%(n=6)。
2.3.8 回收率试验按处方比例配制含对乙酰氨基酚与马来酸氯苯那敏对照品分别为标示量的80%,100%,120%的样品各3份置于量瓶中,按样品溶液制备及含量测定方法测定,计算平均回收率分别为101.7%,98.7%,RSD分别为1.8%,2.0%。
2.3.9 样品含量均匀度测定取每批样品各10袋,精密称定每袋药品的质量,定量溶解,摇匀,过滤,取续滤液,进样10 μL,记录峰面积,按外标法计算对乙酰氨基酚与马来酸氯苯那敏的含量,结果见表3。根据含量计算均匀度,
均匀度=A+1.80 S,
其中A=∣100-相对百分含量∣。
2.4 综合评价计算方法
小儿氨酚黄那敏颗粒现行质量标准收载于《国家药品标准》(化学药品地方标准上升国家标准第三册)[4],现行标准仅对对乙酰氨基酚含量进行了检测,未对微量成分马来酸氯苯那敏进行质量控制,从而导致产品质量良莠不齐。本实验颗粒制备后未进行分剂量等操作,主要进行相关成分的分析。
综合评分标准:Q为每组中药物含量在95%~105%的个数(满分为10),C为药物含量均匀度,a代表对乙酰氨基酚,b代表马来酸氯苯那敏,Qa即为对乙酰氨基酚含量在95%~105%的个数,Ca为对乙酰氨基酚的含量均匀度。

表3 样品含量均匀度测定结果
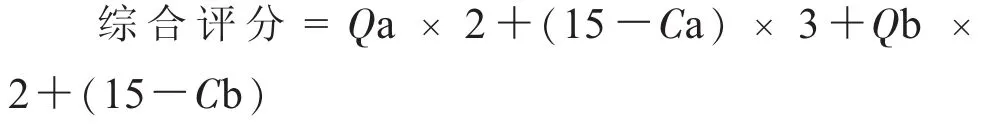
满分为100,该公式的制定主要是按照对乙酰氨基酚占65%和马来酸氯苯那敏占35%的影响程度,自行规定的综合评分指标。
2.5 正交试验结果及数据分析

表4 正交试验综合评分结果

表5 方差分析综合评分结果
经方差分析,结果表明四种因素中马来酸氯苯那敏的加入方式具有显著性影响,各因素作用主次为A>B>C>D,最佳工艺条件为A3B3C3D3,即马来酸氯苯那敏以黏合剂方式加入,物料采用三维混合20 min,物料目数均为100目。
2.6 最佳制备工艺验证试验
按上述的制备方法,对正交试验筛选出的最佳工艺条件A3B3C3D3进行验证,验证结果见表6。此次综合评分最大值依据上述正交实验结果。结果表明,正交试验所确定的湿法制粒法制备小儿氨酚黄那敏颗粒的最佳工艺稳定。

表6 验证试验结果
3 讨论
3.1 小儿氨酚黄那敏颗粒剂的质量标准规定有待提高
马来酸氯苯那敏是抗组胺H1受体药物,可改善鼻塞、流涕等感冒引发的过敏症状,但过量服用极易引发头晕、嗜睡等严重不良反应。小儿氨酚黄那敏颗粒国家标准中仅控制了对乙酰氨基酚的含量,而对制剂中马来酸氯苯那敏缺少含量控制指标,直接影响了临床用药的安全和疗效,因此对小儿氨酚黄那敏颗粒剂中马来酸氯苯那敏的质量规定十分必要。
3.2 小儿氨酚黄那敏颗粒存在的质量问题及原因分析
对现行市场上部分厂家的小儿氨酚黄那敏颗粒质量调研结果发现对乙酰氨基酚含量均匀度较好,而马来酸氯苯那敏的含量均匀度较差,且不同厂家之间差别较大。可能原因一是马来酸氯苯那敏的处方含量较小,仅有万分之一,生产过程中不易混匀,给生产工艺带来一定的困难;二是不同厂家的生产工艺和设备不同,也会给产品的质量和差异带来较大的影响;三是地方药监部门对该药品的质量监督管理力度不足[5]。
3.3 小儿氨酚黄那敏颗粒剂制备方法的选择
颗粒剂制备方法通常有湿法制粒、流化喷雾制粒、喷雾干燥制粒以及干法制粒等方法。颗粒剂制备方法的选择与药物的性质、辅料的选择、工艺条件以及生产成本等相关。小儿氨酚黄那敏颗粒剂制备方法常用湿法制粒,传统的湿法制粒难以使颗粒中微量成分马来酸氯苯那敏含量均匀度达到要求,只有不断改进生产工艺才能更好地满足各种药物成分含量均匀度的指标。
3.4 湿法制备小儿氨酚黄那敏颗粒剂中工艺因素的选择
湿法制备颗粒中影响质量的因素有药物的加入方式、物料的目数、混合的方式等多种因素。不同因素对颗粒剂质量的影响程度不同,在生产工艺中的体现形式也不同,因此,对小儿氨酚黄那敏颗粒剂的制备工艺需要进一步改进和筛选,才能达到更高的质量指标。从正交试验的结果分析可知马来酸氯苯那敏的加入方式对小儿氨酚黄那敏颗粒的质量具有显著性影响,马来酸氯苯那敏以黏合剂方式加入效果较好。
3.5 HPLC可作为小儿氨酚黄那敏颗粒的质量控制方法
现行标准含量测定方法中仅测定对乙酰氨基酚,目前有关采用HPLC测定单一组分对乙酰氨基酚含量的文献报道较多[6-8]。本实验在相同色谱系统条件下同时测定小儿氨酚黄那敏颗粒中的马来酸氯苯那敏和对乙酰氨基酚的含量,方法简便、快速、准确、灵敏,稳定性、重现性、回收率均符合要求,可作为该制剂的质量控制方法。
[1]宋宁宁.小儿氨酚黄那敏颗粒现行质量标准的改进建议[J].广西医科大学学报,2011,28(3):354-356.
[2]王丹彧,贾首时,张连成.小儿氨酚黄那敏颗粒质量标准鉴别方法的改进[J].中国医药导报,2011,8(7):57-59.
[3]欧阳吉德,王灿,胡雯婷,等.小儿氨酚黄那敏颗粒质量标准的研究[J].药物分析杂志,2009,12(8):45-46.
[4]国家药品监督管理局.国家药品标准(试行):WS-10001-(HD-0214)-2002[S].2002.
[5]郝晶晶,李海亮,李伟,等.现市场上部分小儿氨酚黄那敏颗粒的质量调研[J].中国医药导报,2013,(8):121-123.
[6]刘旺培,黄义.高效液相色谱法测定小儿氨酚黄那敏颗粒中对乙酰氨基酚的含量[J].首都医药,2008,15(6):53-54.
[7]闫海燕.高效液相色谱法测定小儿氨酚黄那敏颗粒中对乙酰氨基酚的含量[J].安徽医药,2011,15(10):1213-1214.
[8]陈琼,马稳,石国明,等.HPLC测定小儿氨酚黄那敏颗粒中马来酸氯苯那敏的含量[J].中国医药指南,2009,7(14):76-77.
Study on the Preparation Technology of Xiao’er Anfen Huang Namin Granules
Hao Jingjing,Li Hailiang(Health Vocational College of Beijing,Beijing 100053,China)
Objective:To study the preparation technology and the influencing factors of wet granulation method for the preparation of xiao’er anfen huang namin granules.Methods:Using orthogonal experiment design,the content uniformity of acetaminophen and chlorphenamine maleate was determined by HPLC,and the preparation process was optimized by means of comprehensive score.Results:The optimized preparation process was passing the materials through a 100 mesh sieve,using three-dimensional mixed mode blending for 20 min,adding chlorphenamine maleate as the adhesive.The prepared granules met the quality requirements.Conclusion:The optimized preparation process is convenient for operation,the high uniform of contents of paracetamol and chlorphenamine maleate is obtained and the production technology is stable.
Xiao’er Anfen Huang Namin Granules;Orthogonal Design;HPLC;Paracetamol;Chlorphenamine Maleate;Content Uniformity
10.3969/j.issn.1672-5433.2014.07.004
2013-11-11)
北京市优秀人才资助项目(2011G003034000002)
郝晶晶,男,硕士,高级讲师。研究方向:药学教育科研。E-mail:haojingjing@sina.com
