不同水平高血糖对大鼠局灶脑缺血损伤的影响☆
2014-04-27石见谭盛吴培华陈健
石见 谭盛 吴培华 陈健
不同水平高血糖对大鼠局灶脑缺血损伤的影响☆
石见*谭盛*吴培华*陈健*
目的 观察不同水平高血糖对大鼠局灶脑缺血的影响。方法将23只成年雄性大鼠随机分为正常血糖组(N)6只、高血糖1组(H1)6只、高血糖2组(H2)11只。采用线栓法建立90min局灶脑缺血模型(middle cerebralartery occlusion,MCAO),缺血开始后5m in、50min、95min三个时间点,通过腹腔注射不同剂量50%葡萄糖溶液使其血糖分别维持在10mmol/L(H 1)和20mmol/L(H2)。正常血糖组(N)在相同时间点注射生理盐水作为对照。脑缺血后24 h采用mNSS评分和rotarod评估神经损伤严重程度,TTC染色检测脑梗死面积。结果与N组相比,H2组mNSS和rotarod评分更差,脑梗死面积增加24.26%(P<0.01)。H1组与N组比较,mNSS、rotarod评分以及脑梗死面积无显著差异(P>0.05)。结论卒中后严重高血糖(20mmo/L)显著增大脑梗死面积,加重神经功能损伤,而轻度高血糖(10mmol/L)对脑梗死面积和神经功能损伤无显著影响。
脑缺血 高血糖 mNSS评分 rotarod TTC
流行病学及临床研究表明,约40%~70%急性缺血性脑卒中患者存在卒中后高血糖[包括潜在的糖耐量减低(underlying impaired glucose tolerance)、未诊断的糖尿病(unrecognized diabetesmellitus)和应激性高血糖(stresshyperglycemia)][1-2],且这部分患者较正常血糖者不良事件发生率、死亡率增加[3-4]。然而严格降糖治疗是否能改善急性缺血性脑卒中患者的预后仍缺乏循证医学证据[5]。正确理解卒中后高血糖病生机制对更大规模临床试验设计非常重要。但是在基础研究领域,动物局灶脑缺血后高血糖的研究结果不尽一致,部分研究表明高血糖增加脑梗死面积,另一部分研究提示轻度高血糖可能有益[6-7]。本实验通过线栓法建立大鼠大脑中动脉缺血模型,腹腔注射不同剂量50%葡萄糖溶液,维持卒中后血糖为轻度高血糖(10 mmol/L)、严重高血糖(20mmol/L),与血糖正常对照组(5~6mmol/L)对比观察24 h后脑梗死面积和神经功能缺损情况,为临床卒中急性期血糖管理提供一定依据。
1 材料与方法
1.1 研究对象 成年雄性Sprague-Dawley(SD)大鼠18只,SPF级,由南方医科大学实验动物中心提供,合格证号:SCXK(粤)2011-0015,体重240~260 g。饲养温度24℃,相对湿度40%~70%,明暗周期12 h,正常饮食,自由饮水。所有实验动物的饲养及操作均符合广东省及南方医科大学动物管理条例,遵循“3R”原则。随机分组:正常血糖组(5mmol/L,N)6只,高血糖1组(10 mmol/L,H1)6只,高血糖2组(20mmol/L,H2)11只(因前期预实验发现H2组造模后约死亡一半,故实验分组时,增加H2组实验动物数量)。
1.2 建立大鼠局灶脑缺血(MCAO)模型 采用改良Zea-Longer插线栓方法制作大鼠右侧大脑中动脉闭塞模型(MCAO)。具体方法:大鼠术前禁食15~17 h,不禁水,腹腔注射3%戊巴比妥钠(0.2 mL/kg)麻醉后,取大鼠颈部正中纵向切口,切开皮肤,游离右侧颈外动脉、颈总动脉及颈内动脉。离断颈外动脉2个小分支血管,在距离颈总动脉分叉5mm远心端用4-0丝线结扎离断颈外动脉,在颈外动脉靠近颈总动脉分叉处打一个活结备用。用血管夹暂时夹闭右侧颈总动脉及颈内动脉起始端。在颈外动脉距离分叉4mm处剪一破口,线栓(直径0.26mm的鱼线蘸蜡后灼烧头端使之膨大,用肝素浸泡)由破口插入颈外动脉,结扎紧预留的线结,松开血管夹,沿颈内动脉方向插入线栓,待线栓进入21~22 mm稍有阻力感,停止插线栓。线栓放置90 min后撤出线栓,结扎紧预留线结。缝皮、消毒。术中加热垫保温,待麻醉苏醒后自由进食饮水,单笼喂养。
1.3 诱导卒中后高血糖(poststroke hyperglycemia)H1组和H2组在缺血后5 min开始接受间隔45min共3次腹腔注射(intraperitoneal injection,IP)50%葡萄糖溶液(如图1A所示)。H1组和H2组首次注射50%葡萄糖溶液剂量分别为2.5 mL/ kg、8mL/kg,随后2次均按2mL/kg进行腹腔注射,维持缺血后10mmol/L及20mmol/L血糖水平;正常血糖组按2mL/kg共3次注射生理盐水。缺血开始时、每次腹腔注射后30min取尾尖血测定血糖水平。脑缺血后12 h内,H2组有5只死亡。
1.4 神经功能缺损程度评分 采用改良神经功能缺损程度评分方法(modified Neurological Severity Score,mNSS)在术后24 h分别对其进行评分,包括运动、感觉、反射等方面。得分越高提示神经功能损伤越重:总分14分,10~14分重度受损;5~9分中度受损;1~4分轻度受损。
1.5 转杆实验(Rotarod)本实验采用自动旋转杆监测仪(Harvard Apparatus,图3A)来评价大鼠运动协调能力。MCAO前3 d为训练实验,将大鼠置于转杆上,转速在5min内从4 rpm升至40 rpm,每天训练5次,每次间隔15min。大鼠在转杆上爬行开始计时,大鼠从转杆跌落至脚踏板上,自动停止计时,记录下大鼠在转杆上停留的时间(latency)。在MCAO前1 d,每只动物进行3次转杆测试实验,取3次试验平均值作为基线值。MCAO后24 h,进行3次转杆实验,rotarod运动测试数据表示为3次实验平均值与自身对照基线值的百分比。
1.6TTC染色 MCAO后24 h处死大鼠,断头取脑,放入0.1mmol/L PBS的冰水混合物中1min后取出。置入大鼠脑槽中,自额极起间隔2mm连续冠状切片,共切脑片6片。将脑片迅速浸泡于2% TTC溶液(Sigma公司,美国)中,常温孵育6min,翻转脑片继续孵育6min,显色(正常脑组织呈红色,梗死部分呈现白色)后4%多聚甲醛固定6 h,拍照记录,使用图像分析软件IPP(Image Pro Plus)进行脑梗死面积分析。为矫正缺血后脑水肿,结果记录为脑梗死面积百分比(%)=脑梗死面积/缺血对侧脑面积。
1.7 统计学方法 采用SPSS18.0进行统计学分析,所有实验数据均以(x±s)表示。行为学数据(rotarod实验,和mNSS)使用Shapiro-Wilk进行正态性分布检验。组间比较使用单因素方差分析,采用Tukey检验进行组间均值两两比较。检验水准α=0.05。
2 结果
MCAO后间隔45min,共3次腹腔注射50%葡萄糖溶液,使高血糖1组(H1)和高血糖2组(H2)卒中后血糖水平分别维持在10 mmol/L及20 mmol/L左右,正常血糖组(N)腹腔注射生理盐水,卒中后血糖水平在5~6mmol/L(图1B)。
2.1 神经功能缺损程度评分(mNSS)结果 正常血糖组(N)、高血糖1组(H1)和高血糖2组(H2)改良的神经功能缺损程度评分(x±s)分别为4.00± 0.89、5.17±1.17和8.83±1.17。高血糖2组(H2)神经功能中度受损,与正常血糖组(N)和高血糖1组(H1)相比,差异有统计学意义(F=32.406,P<0.01)。高血糖1组(H1)与正常血糖组神经功能轻中度受损,两者对比无统计学差异(P=0.184),见图2。
2.2 转杆实验结果 各组rotarod实验结果分别为:57.42%±5.35%(正常血糖组)、51.06%±6.71%(高血糖1组)、31.42%±5.65%(高血糖2组)。高血糖2组(H2)脑缺血后运动功能缺损程度更严重(F=31.31,P<0.01),高血糖1组(H1)与正常血糖组相比无统计学意义(P=0.185),见图3B。
2.3TTC染色结果 实验结果显示,正常血糖组(N)、高血糖1组(H1)和高血糖2组(H2)脑梗死面积百分比分别为24.93%±5.31%、,30.87%± 3.68%和49.19%±2.02%。统计结果证实,高血糖2组(20 mmol/L)脑梗死面积显著增大(F=52.40,P<0.01),而高血糖1组(10mmol/L)与正常血糖组比较无统计学意义(P=0.079),见图4。
3 讨论
大量临床观察性研究表明急性缺血性脑卒中伴血糖升高者,死亡率升高、卒中后90 d神经功能恢复差[2]。既往研究认为高血糖可能通过多种途径增大脑梗死面积,从而使患者预后变差[8-10]。但一项针对卒中后高血糖采取严格降糖治疗的随机对照试验表明,葡萄糖-钾-胰岛素(glucose potassium insulin,GKI)静脉输注降低血糖水平,但未能减少脑梗死面积[11]。该随机对照试验未能得出显著性结果,可能由于未达到预先设计的样本量,导致检验效能下降,但也可能由于纳入的非干预组平均血糖水平仅轻度升高(约7mmol/L)。流行病学研究指出临床卒中后高血糖水平主要集中在7~12mmol/L[1],提示轻度升高的血糖可能并不会加重缺血缺氧损伤及增大脑梗死面积。本研究轻度高血糖组(10mmol/L,H1)血糖水平很好的符合临床卒中后高血糖的波动范围,与正常血糖组(5~6mmol/L,N)相比,结果显示两组间脑梗死面积差异无统计学意义,同时神经功能缺损评分(mNSS)和运动协调性(rotarod)也无显著性差异。虽然既往文献报道认为MCAO模型中高血糖显著增大脑梗死面积,但多利用链脲霉素(streptozotocin,STZ)破坏胰腺β细胞,产生1型糖尿病,诱导形成高血糖。1型糖尿病患者存在下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal,HPA)过度激活伴循环血液中肾上腺皮质激素(adrenal glucocorticoids)水平显著升高,本身HPA轴的过度激活就会增大脑梗死面积,Martin等[12]也证实使用肾上腺皮质激素抑制剂美替拉酮(metyrapone)可减少皮层梗死面积。我们认为本研究的结果更具有说服力,因为我们选取的腹腔注射葡萄糖溶液诱导高血糖的方式不涉及复杂的病生机制,能更清楚的阐明高血糖与脑梗死面积的关系。我们综述文献后发现采用直接注射葡萄糖方式诱导高血糖的相关基础研究选取的血糖水平超过20mmol/L,并较一致认为该水平高血糖使脑梗死面积显著增大[6]。本实验同样发现严重高血糖(20mmol/L)与血糖正常对照组(5~6mmol/L)对比,脑梗死面积增加24.26%,同时局灶脑缺血后神经功能缺损程度加重(mNSS评分和rotarod实验结果)。因此,葡萄糖作为脑组织的最重要的功能物质,其水平轻度升高并不会影响神经功能,造成脑梗死面积增大,但当其超过一定限度,则加重缺血后脑损伤。然而本研究存在一定的局限性。众所周知,缺血性脑卒中急性期高血糖可能存在两种主要情形:①患者既往合并糖尿病或糖耐量异常,缺血性脑损伤致使原有的代谢紊乱恶化;②既往无糖代谢异常,缺血性脑损伤引起应激性血糖升高[13]。针对这两种不同情况,一项纳入375例缺血性脑卒中患者的临床研究仅在非糖尿病者中观察到高血糖与脑梗死面积增大以及神经功能恶化的关系[14]。可见,由于糖尿病涉及的病生机制更为复杂,卒中后高血糖对糖尿病患者的影响不同于非糖尿病者。而本研究采用脑缺血后腹腔注射葡萄糖动物模型,更符合卒中后应激性高血糖的临床特征,并不能模拟既往存在糖尿病或糖耐量异常的情况。
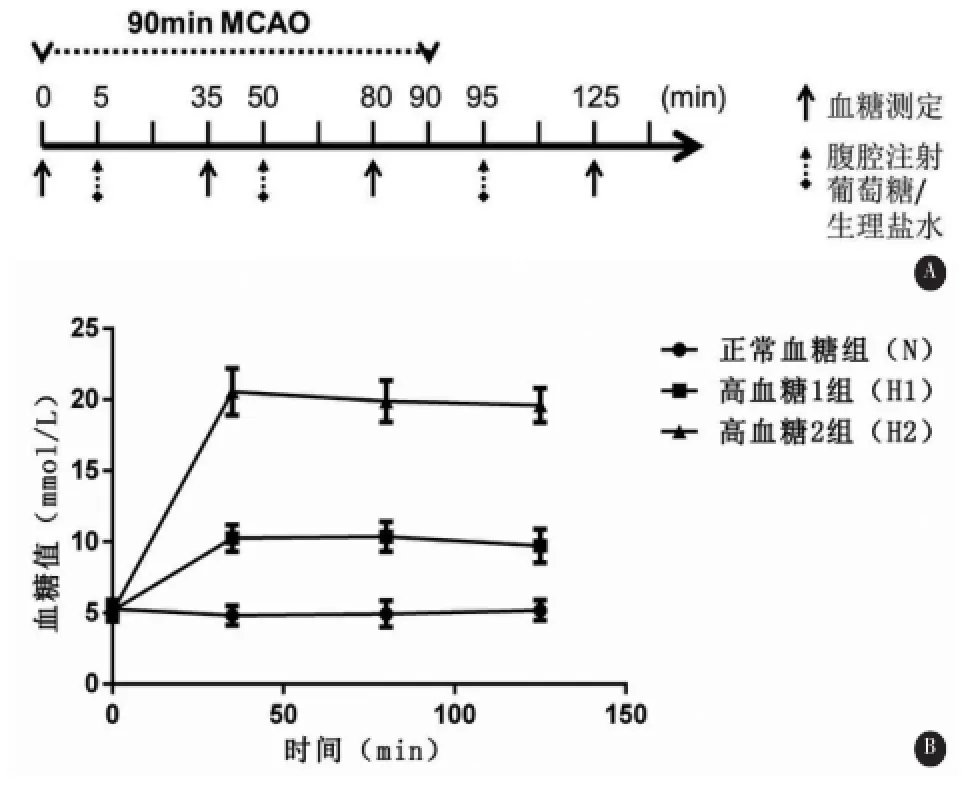
图1 实验设计图A.脑缺血开始后各个腹腔注射和血糖测定时间点B.三组动物血糖测定结果
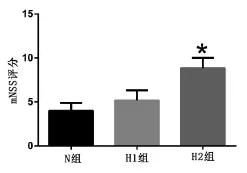
图2 改良神经功能缺损程度评分(*与正常血糖组对比P<0.01)
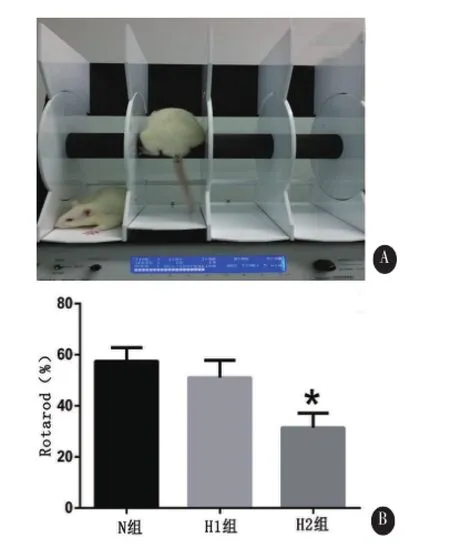
图3 转杆实验A.自动旋转杆监测仪B.不同水平高血糖对转杆实验结果影响(*与正常血糖组对比P<0.01)
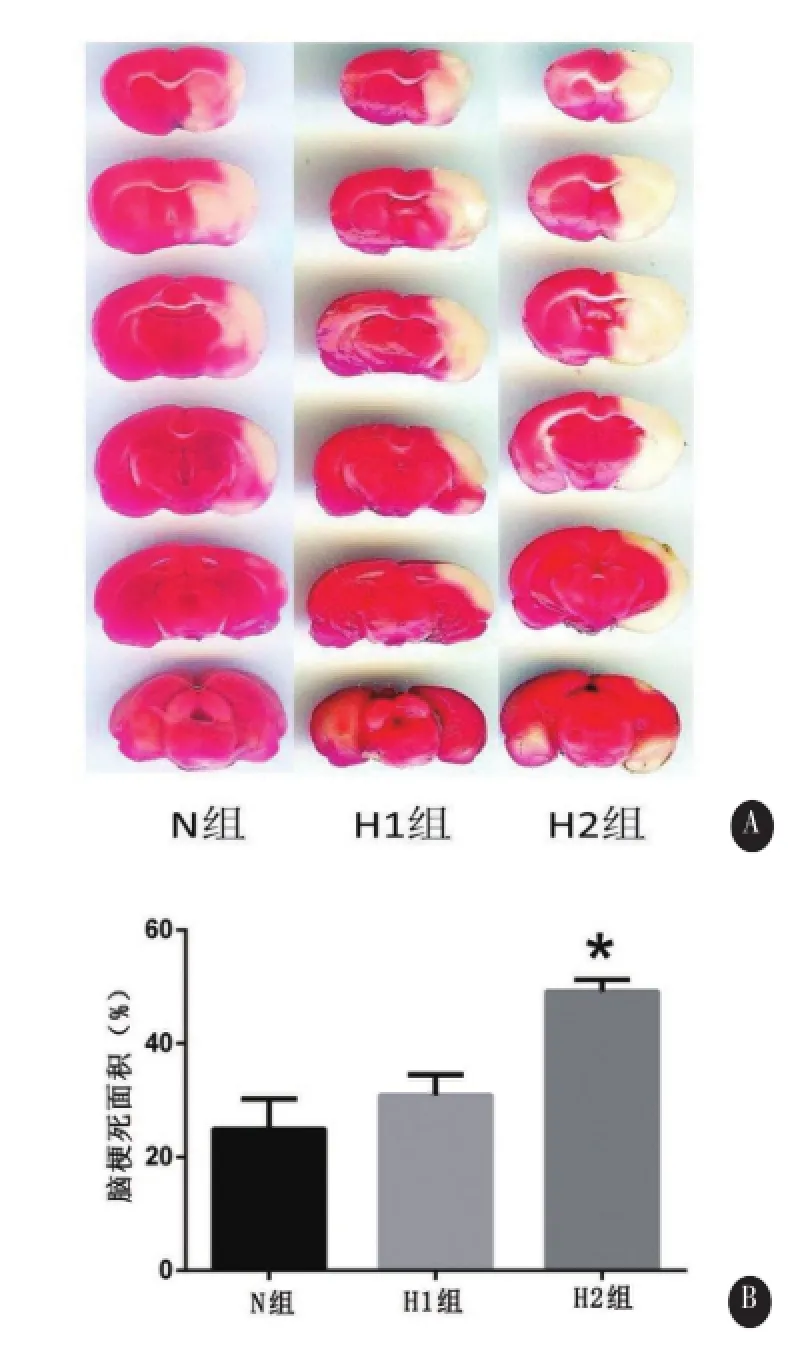
图4 不同水平高血糖对脑梗死面积影响A.TTC染色结果B.脑梗死面积定量统计分析结果(*与正常血糖组对比P<0.01)
综上所述,一定程度卒中后高血糖(10mmo/L左右)不会显著增大脑梗死面积,加重缺血性脑损伤,而严重高血糖(20mmol/L)显著增大脑梗死面积并加重神经功能缺损程度。本研究为进一步临床干预性实验制定卒中后高血糖降糖治疗目标值提供一定参考。
[1] Jia Q,Zheng H,Zhao X, et al. Abnormal glucose regulation in patients with acute stroke across China:prevalence and baseline patientcharacteristics[J].Stroke,2012,43(3):650-657.
[2] Desilles JP,Meseguer E,Labreuche J, et al. Diabetesmellitus, admission glucose,and outcomes after stroke thrombolysis:a registry and systematic review[J].Stroke,2013,44(7):1915-1923.
[3] Clark ME,Payton JEPittiglio LIAcute ischemic stroke and hyperglycemia[J].CritCare Nurs Q,2014,37(2):182-187.
[4] 黄银辉,李明媚,陈振杰,等.急性缺血性脑卒中静脉溶栓后出血性转化危险因素分析[J].中国神经精神疾病杂志, 2013,39(10):581-586.
[5] Ntaios G,Papavasileiou V,Bargiota A, et al. Intravenous insulin treatment in acute stroke:a systematic review and meta-analysis of randomized controlled trials[J].Int JStroke,2013,56(3): 56-61.
[6] Macdougall NJ,Muir KW.Hyperglycaemia and infarct size in animal models of middle cerebral artery occlusion:systematic review and meta-analysis[J].JCereb Blood Flow Metab,2011, 31(3):807-818.
[7] Tarr D,Graham D,Roy LA, et al. Hyperglycemia acceleratesapparent diffusion coefficient-defined lesion growth after focal cerebral ischemia in rats with and without features of metabolicsyndrome[J].J Cereb Blood Flow Metab,2013,33(10):1556-1563.
[8] 刘式威,尹岭,吕霞,等.动态观察糖尿病对大鼠内皮屏障抗原和血脑屏障通透性的影响[J].中国神经精神疾病杂志,2007,(05):298-300.
[9] Kruyt ND,Biessels GJ,Devries JH, et al. Hyperglycem ia in acute ischemic stroke:pathophysiology and clinicalmanagement [J].Nat Rev Neurol,2010,6(3):145-155.
[10] 章成国,李国德,黄淑云,等.急性缺血性脑卒中梗死灶面积与餐后血糖的关系[J].中国神经精神疾病杂志,2011,37 (4):234-236.
[11] Mccormick M,Hadley D,Mclean JR, et al. Randomized,controlled trial of insulin for acute poststroke hyperglycemia[J]. Ann Neurol,2010,67(5):570-578.
[12] Martin A,Rojas S,Chamorro A, et al. Why does acute hyperglycemia worsen the outcome of transient focal cerebral ischemia? Role of corticosteroids,inflammation,and protein O-glycosylation[J].Stroke,2006,37(5):1288-1295.
[13] 短暂性脑缺血发作血糖管理的中国专家共识组.缺血性卒中/短暂性脑缺血发作血糖管理的中国专家共识[J].中华内科杂志,2010,49(4):361-365.
[14] Shimoyama T,Kimura K,Uemura J, et al. Elevated glucose level adversely affects infarct volume growth and neurological deterioration in non-diabetic stroke patients,butnot diabetic stroke patients[J].Eur JNeurol,2014,21(3):402-410.
R743
A
2013-12-22)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.05.012
☆国家自然科学基金(编号:81301098);广州市海珠区科技计划项目(编号:2011-YL-06)
*南方医科大学珠江医院神经内科(广州510282)
