脑动静脉畸形患者外周血内皮祖细胞数量与SDF-1α变化☆
2014-04-27王凌雁郭少雷齐铁伟梁丰黄正松
王凌雁 郭少雷 齐铁伟 梁丰 黄正松
脑动静脉畸形患者外周血内皮祖细胞数量与SDF-1α变化☆
王凌雁*郭少雷**齐铁伟**梁丰**黄正松**
目的 观察脑动静脉畸形(arteriovenousmalformation,AVM)患者外周血内皮祖细胞(endothelial progenitor cells,EPCs)数量和基质细胞衍生因子-1α(stromal cell-derived factor-l,SDF-1α)的变化。方法15例首次接受治疗的脑AVM患者和15例健康对照者,应用密度梯度离心法分离外周血单个核细胞,以CD133+、CD34+、KDR+三阳性细胞为EPCs,应用流式细胞仪检测EPCs占外周血单个核细胞的百分比,ELISA法检测外周血SDF-1α浓度,比较两组差异;EPCs百分比、SDF-1α浓度与AVM大小,以及EPCs百分比与SDF-1α浓度分别进行相关性分析。结果AVM患者外周血EPCs占外周血单个核细胞百分比及SDF-1α浓度高于健康对照者(t= 4.051,P<0.05;t=3.606,P<0.05);EPCs百分比及SDF-1α与病灶大小不相关(r=0.092,P>0.05;r=0.027,P>0.05),EPCs百分比与SDF-1α正相关(r=0.461,P<0.05)。结论脑AVM患者存在外周血EPCs和SDF-1α水平升高的现象,可能与AVM患者骨髓EPCs动员增加,参与AVM血管重塑和血管新生有关。
脑动静脉畸形内 皮祖细胞SDF-1α
脑AVM是脑内的异常血管结构,由畸形动脉、扩张静脉和发育异常的毛细血管床组成,是引起青年人颅内出血的主要中枢神经系统疾病[1]。目前有关AVM的发病机制并未阐明,越来越多的研究认为AVM并非静止性的病灶,而是经历着活跃的血管重塑和血管新生过程[2-3]。EPCs是近年来发现的一类来源于骨髓、具有分化和增殖能力的内皮前体细胞,可以整合到血管新生部位并分化为成熟的内皮细胞,从而参与血管的修复和新生[4]。已有研究证实在脑和面部动静脉畸形病灶中存在内皮祖细胞[5-6],因此推测EPCs参与AVM的发生和发展。本研究对脑AVM患者外周血EPCs数量及SDF-1α浓度进行检测,以证实该疾病患者是否存在从骨髓动员EPCs增加的情况。
1 对象与方法
1.1 研究对象 本研究经本院医学伦理委员会批准,并与患者或家属签署知情同意书。选择首次发病,未经栓塞、手术切除或放射治疗的脑动静脉畸形患者15例,其中以出血为首发症状的患者需度过出血急性期且无颅内压增高表现,AVM诊断经数字减影血管造影(DSA)或脑血管CT成像(CTA)检查确诊。15例患者中男9例,女6例,平均年龄(24.9±14.3)岁;动静脉畸形位于小脑者2例,其余13例位于幕上,畸形团直径在1 cm~5.5 cm,Sptzer-Martin分级1级4例、2级5例、3级5例、4级1例;首发症状为出血者8例、癫痫发作3例、头痛2例,病灶对侧下肢无力1例和无症状1例。按照年龄和性别相匹配的原则选择同期在我院体检中心进行体检的健康人作为对照,其中男9例、女6例,平均年龄(25.4±13.8)岁。所有入选患者和健康对照者需同时符合无有服用他汀类药物史,无高血压、糖尿病、高脂血症和有感染存在。
1.2 方法
1.2.1 外周血的采集及单个核细胞分离 抽取患者安静状态下清晨空腹外周静脉血约10mL置于肝素抗凝管中,标本静止后吸取上层血浆,10000 r/ min离心10min,取上清置于-80℃冰箱保存,用于检测SDF-1α。剩余血标本采用密度梯度离心法获得外周血单个核细胞,具体操作步骤为PBS等倍稀释血液,将稀释后的血沿试管壁缓慢加入15 mL人淋巴细胞分离液(天津灏洋)液面上,以2000 r/min,室温离心20min,离心后用吸管将上层与中层之间的单个核细胞层吸出到另一个管中,用PBS洗2遍,每次均以1500 r/min离心10 min,弃上清即得到高纯度的单个核细胞。
1.2.2 流式细胞仪检测EPCs占外周血单个核细胞百分比 根据文献提供方法[7]以0.5%BSA 100ul稀释单个核细胞,加入10µL Fc受体阻断剂((Miltenyi Biotec)室温孵育10 min以阻断抗体的非特异性结合,然后分别加入PE标记的抗体CD133,FITC标记的抗体CD34和APC标记的抗体KDR(Miltenyi Biotec)各10µL至总体积140ul,4℃孵育30 min,0.5%BSA清洗2次去掉未结合抗体。0.5% BSA缓冲液重悬至200µL过滤到流式上样管中,应用Beckman-Coulter Epics Altra流式细胞仪检测每份标本中EPCs占外周血单个核细胞的百分比。
1.2.3 外周血SDF-1浓度测量 用酶联免疫吸附试剂盒(R&D公司)检测外周血SDF-1α含量。根据说明书操作进行检测,每份血清标本分成三份,取三次测量的平均值作为最终结果。
1.2.4 AVM测量 根据DSA检查结果,在计算机上调整图像三维视角测量畸形血管团最大直径作为判定AVM大小的指标。
1.3 统计学方法 全部资料用SPSS 17.0统计学软件包进行统计处理。计量资料以均数±标准差(±s)表示,组间比较采用t检验。相关性分析采用spearman相关分析方法,检验水准α=0.05。
2 结果
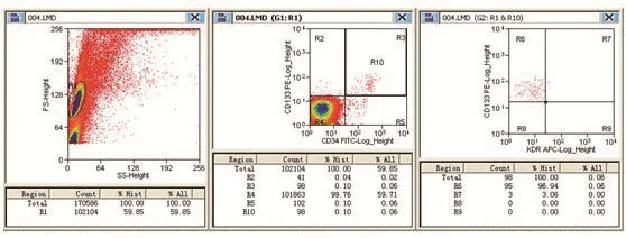
图1 流式细胞仪检测外周血EPCs A:实框中圈定区为单个核细胞;B:R10区为CD133、CD34双阳性细胞;C:R7区为CD133、CD34、KDR三阳性细胞
2.1AVM组外周血SDF-1α浓度与健康对照组比较 15例AVM患者和15例健康对照者外周静脉血SDF-1α浓度分别为(1241.4±514.8)pg/mL和(332.2±272.4)pg/mL。两组比较差异有统计学意义,(t=3.606,P<0.05)。
2.2AVM患者外周血EPCs占单个核细胞百分比与健康对照组比较 AVM组和健康对照组CD133+, CD34+,KDR+三阳性细胞占外周血单个核细胞百分比分别为(0.024%±0.021%)和(0.006%±0.006%),两组比较差异有统计学意义(t=4.051,P<0.05)。(图1,流式细胞仪检测EPCs结果)。
2.3 相关性分析 AVM患者外周血SDF-1α的水平及外周血EPC百分比均与AVM病灶直径无相关性(r=0.092,P=0.745和r=0.027,P=0.924);外周血SDF-1α与外周血EPC百分比正相关(r=0.461,P<0.05)。
3 讨论
脑AVM是脑内的异常血管结构,是导致青年人颅内出血的主要病因。越来越对的研究证实AVM并非静止的先天性疾病,而是经历着不断生长、甚至再发的过程[2-3]。针对AVM手术切除标本的病理研究发现AVM畸形血管团周围脑组织中毛细血管密度增加[8],此外模拟AVM动静脉短路的缺血动物模型也证实,造模后慢性低灌注脑组织中毛细血管密度增加[9],上述研究均支持无论AVM病灶还是病灶周围脑组织均存在血管新生的现象。
EPCs是近年来发现的一类由骨髓动员的血管内皮细胞前体细胞,具有高度增殖和定向分化等特点,EPCs不仅参与胚胎时期血管的形成,还参与出生后的血管新生和受损内皮的修复过程。针对组织损伤修复以及多种肿瘤血管新生的研究均证实有EPCs的参与,有关心肌梗死和脑梗死的研究也发现EPCs与梗塞面积、梗死灶周围血管密度及患者预后密切相关[7,10-12]。目前认为EPCs作为血管内皮细胞前体细胞,一方面可以通过自身转化为血管内皮细胞,另一方面可以通过旁分泌的方式合成和分泌多种细胞因子影响内皮细胞增殖、迁移和成管,进而参与病理和生理状态下内皮细胞的更新以及血管新生。
本研究应用流式细胞仪检测AVM患者外周血EPCs的变化,结果发现CD133+、CD34+、KDR+三阳性EPCs占外周血单个核细胞百分比较正常健康人群明显增高,说明AVM患者从骨髓动员EPCs增加,可能与EPCs参与AVM血管重塑和血管新生有关。Gao等[5-6],对手术切除的AVM标本进行EPCs标志物的检测也发现病灶中有EPCs存在,EPCs数量与AVM病理级别相关,支持上述观点。
引起EPCs动员和归巢的因素包括一系列生长因子以及炎症因子,其中SDF-1/CXCR4轴起重要作用[13]。SDF-1属于CXC细胞趋化因子亚家族,在体内起主要作用的是SDF-1α,当组织存在缺氧时可大量表达并释放入血,SDF-1与EPCs表面CXCR4受体相作用,促使EPCs极化、沿SDF-1浓度梯度向病灶趋化[14],并激活一系列细胞内信号传导通路,影响内皮细胞分化、迁移、成管和一系列细胞因子表达[15-16]。在我们的研究中发现AVM患者外周血中SDF-1α浓度较正常对照者增加,且与EPCs数量呈正相关,推测可能由于AVM病灶合成SDF-1增加,进而动员骨髓EPCs增加,并使其归巢到AVM病灶参与AVM的血管重塑和血管新生。
引起AVM病灶SDF-1表达增加的原因,可能与低氧及病灶中VEGF表达增加有关。研究证实低氧诱导因子(HIF-1)是促进SDF-1表达的强诱导因子[17],而SDF-1和VEGF在促进血管新生方面起协同作用,当其中一种因子表达上调时,另一种因子的表达也会上调[14]。脑AVM是一种先天性发育异常的血管性疾病,由一团杂乱、互相缠结的扩张血管构成,直接引流动脉血到静脉,导致高流速的血流经过供血动脉、畸形血管团到引流静脉,因动静脉短路促使病灶及病灶周围脑组织发生缺血是AVM的主要病理改变。已经证实无论在AVM病灶还是病灶周围脑组织中均存在HIF-1、VEGF高表达的现象[18-19]。此外AVM血流动力学的改变可能也参与SDF-1合成和分泌增加,研究发现在AVM病灶中SDF-1主要表达于畸形血管的内皮细胞[20],而内皮细胞是直接感受血流动力学改变的最直接受体。
在我们的研究中未发现外周血中EPCs和SDF-1α水平与AVM大小存在相关性。提示病灶的体积并不是影响外周血EPCs和SDF-1α的决定因素,体积大的AVM虽然占有合成SDF-1细胞数量上的优势,但因血流动力血改变不明显,以及因盗血而导致的局部低氧情况并不严重,因此SDF-1α合成和分泌并未高于体积小的AVM,相反体积小的AVM由于存在高流量的供血动脉和深部引流静脉可能引起局部缺血缺氧情况更加严重。有关此方面的研究还需扩大病例数,进行进一步的分层分析。此外,栓塞和手术切除治疗是否会影响AVM患者外周血EPCs数量及SDF-1水平也有待进一步研究。
总之,我们的研究证实脑AVM患者存在外周血EPCs和SDF-1α水平升高的现象,推测AVM病灶局部合成和分泌SDF-1α增加,导致EPCs从骨髓动员和归巢到AVM病灶可能参与AVM的发生和发展。
[1] Ruiz-Sandoval JL,Cantu C,Barinagarrementeria F.Intracerebral hemorrhage in young people:analysis of risk factors,location,causes,and prognosis[J].Stroke,1999,30(3):537-541.
[2] Moftakhar P,Hauptman JS,Malkasian D, et al. Cerebral arteriovenousmalformations.Part 1:cellular and molecular biology[J]. Neurosurg Focus,2009,26(5):E10.
[3] Moftakhar P,Hauptman JS,Malkasian D, et al. Cerebral arteriovenous malformations.Part 2:physiology[J].Neurosurg Focus, 2009,26(5):E11.
[4] Guo S,Cheng Y,Ma Y, et al. Endothelial progenitor cells derived from CD34+cells form cooperative vascular networks[J]. Cellular physiology and biochemistry:international journal of experimental cellular physiology,biochemistry,and pharmacology,2010,26(4-5):679-688.
[5] Gao P,Chen Y,Lawton MT, et al. Evidence of endothelial progenitor cells in the human brain and spinal cord arteriovenous malformations[J].Neurosurgery,2010,67(4):1029-1035.
[6] Lu L,Bischoff J,Mulliken JB, et al. Increased endothelial progenitor cells and vasculogenic factors in higher-staged arteriovenousmalformations[J].Plast Reconstr Surg,2011,128(4):260e-269e.
[7] Bogoslovsky T,Spatz M,Chaudhry A, et al. Stromal-derived factor-1[alpha]correlates with circulating endothelial progenitor cells and with acute lesion volume in stroke patients[J].Stroke, 2011,42(3):618-625.
[8] 刘子科,齐铁伟,李雪松,等.脑动静脉畸形栓塞治疗后周围脑组织中毛细血管病理研究[J].中国神经精神疾病杂志,2011,(3):178-180.
[9] Hai J,LiST,Lin Q, et al. Vascular endothelial growth factor expression and angiogenesis induced by chronic cerebral hypoperfusion in ratbrain[J].Neurosurgery,2003,53(4):963-970.
[10] Sobrino T,Hurtado O,Moro MA, et al. The increase of circulating endothelial progenitor cellsafter acute ischemic stroke is associatedwith good outcome[J].Stroke,2007,38(10):2759-2764.
[11] Iskander A,Knight RA,Zhang ZG, et al. Intravenous administration ofhuman umbilical cord blood-derived AC133+endothelial progenitor cells in rat strokemodel reduces infarct volume: magnetic resonance imaging and histological findings[J].Stem Cells TranslMed,2013,2(9):703-714.
[12] 孙可健,吕向洋,帅杰.急性缺血性卒中TOAST分型与外周血中内皮祖细胞含量的相关性[J].中国神经精神疾病杂志,2012,38(07):389-392.
[13] Jin DK,Shido K,Kopp HG, et al. Cytokine-mediated deployment of SDF-1 induces revascularization through recruitment of CXCR4+hemangiocytes[J].NatMed,2006,12(5):557-567.
[14] Salcedo R,Oppenheim JJ.Role of chemokines in angiogenesis: CXCL12/SDF-1 and CXCR4 interaction,a key regulator of endothelial cell responses[J].Microcirculation,2003,10(3-4):359-370.
[15] Petit I,Jin D,Rafii S.The SDF-1-CXCR4 signaling pathway:a molecular hub modulating neo-angiogenesis[J].Trends Immunol,2007,28(7):299-307.
[16] Zheng H,Fu G,Dai T, et al. Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1alpha/CXCR4 via PI3K/Akt/eNOS signal transduction pathway[J].JCardiovasc Pharmaco l,2007,50(3):274-280.
[17] CeradiniDJ,KulkarniAR,Cal laghanMJ, et al. Progenitorcel l trafficking is regulated by hypoxic gradients through HIF-1 induc t ionof SDF-1[J].NatMed,2004,10(8):858-864.
[18] SureU,Bat tenbergE,Dempf leA, et al. Hypoxia-induciblefactor and vascular endothelial growth factor are expressed more frequently in embolized than in nonembolized cerebral arteriovenous malformations[J].Neurosurgery,2004,55(3):663-669; 6 6 9-6 7 0.
[19] NgI,TanWL,NgPY, et al. Hypoxiainduciblefactor-1alpha and expression of vascular endothelial growth factor and its receptors in cerebral arteriovenous malformations[J].Journal of cl inicalneuroscience,2005,12(7):794-799.
[20] GaoP,ChenY,LawtonMT, et al. Evidenceofendothel ialprogenitor cells in the human brain and spinal cord arteriovenous malformations[J].Neurosurgery,2010,67(4):1029-1035.
Circulating endothelial progenitor cells and SDF-1αare increased in cerebral arteriovenous malformation patients.
WANG Lingyan,GUO Shaolei,QITiewei,LIANG Feng,HUANG Zhengsong.
Department of Neurosurgery,The First Affiliated HospitalofSun Yat-Sen University,Guangzhou 510080,China.Tel:020-87755766-8223.
ObjectiveThe purpose of this study was to investigate if circulating endothelial progenitor cells(EPCs) and stromal cell-derived factor-1α(SDF-1α)are increased in patients of cerebral arteriovenousmalformation(AVM).MethodsFifteen AVM patients not receiving any treatmentand 15 healthy people were included in this study.Peripheral bloodmononuclear cellswere isolated by density gradient centrifugation and EPCswas characterized by triple staining using antibodies against CD133,CD34,and vascular endothelial growth factor receptor-2(KDR).The percentage of circulating endothelial progenitor cellswere analysised by flow cytometry.Serum concentrations of SDF-1αwas determined by using enzyme-linked immunosorbentassay(ELISA).ResultsThe percentage of circulating EPCs and concentrations of SDF-1αwere significantly higher in AVM group than in control group(t=4.051,P<0.05 and t=3.606,P<0.05,respectively).Therewas a positive correlation between the percentage of circulating EPCs and concentrations of SDF-1α in AVM patients(r=0.461,P<0.05).However,there were no correlation either between the percentage of circulating EPCs and the size of AVM or between concentrations of SDF-1αand the size of AVM in AVM patients(r=0.092,P>0.05 and r=0.027,P>0.05 respectively).ConclusionsThe percentage of circulating EPCs and concentrations of SDF-1α are increased in AVM patients and the increase in themobilization of EPCs from bonemarrow may play a role in blood vessel remodelingand neovasculization in AVM patients.
Cerebral arteriovenous malformation Endothelial progenitor Cells SDF-1α
R743.4
A
2014-01-14)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.05.005
☆国家自然基金面上项目(编号:81171102)
*中山大学附属第一医院神经外科ICU(广州510080)
**中山大学附属第一医院神经外科
