黄芩苷对海人酸致痫小鼠海马神经细胞凋亡的影响
2014-04-27欧阳龙强杨少春邹连生梁日生刘德华高志强程伟
欧阳龙强 杨少春 邹连生 梁日生 刘德华 高志强 程伟
黄芩苷对海人酸致痫小鼠海马神经细胞凋亡的影响
欧阳龙强*杨少春*邹连生*梁日生△刘德华*高志强*程伟*
目的 探讨黄芩苷对海人酸诱导的小鼠癫痫持续状态后海马神经细胞凋亡的影响。方法54只ICR雄性小鼠随机分为对照组、癫痫持续状态(SE)组、黄芩苷治疗组(100mg/kg)。采用腹腔内注入海人酸(12mg/kg)建立小鼠癫痫持续状态模型。通过TUNEL染色观察小鼠海马CA1、CA3区神经细胞的凋亡程度;免疫组化观察海马组织中caspase-3细胞的阳性表达情况;RT-PCR检测海马组织中Bax、Bcl-2mRNA的含量;Western blot检测Bax、Bcl-2和caspase-3蛋白的表达量。结果与癫痫持续状态组相比,黄芩苷可显著减轻癫痫持续状态后海马神经细胞的凋亡(CA1区:0.3984±0.0586 vs.0.7258±0.0235,P<0.05;CA3区:0.3593±0.0391 vs. 0.6191±0.0686,P<0.05),降低海马中BaxmRNA的合成和Bax、caspase-3蛋白的表达(P<0.05),增加Bcl-2mRNA及蛋白的表达(P<0.05)。结论黄芩苷能够减轻小鼠癫痫持续状态后海马神经细胞的凋亡,其作用机制可能通过上调Bcl-2的表达和下调Bax、caspase-3的表达来发挥抗凋亡作用。
癫痫 黄芩苷 海人酸 凋亡
癫痫(epilepsy,EP)是一组由大脑神经元异常放电引起短暂性中枢神经系统功能失常为特征的慢性脑部疾病。海马是中枢神经系统内对癫痫最敏感的脑区之一,癫痫发作可引起海马特定区域(CA1区、CA3区、齿状回、梨状皮质区等,尤以CA1区、CA3区最甚)神经细胞凋亡或坏死[1]。有研究[2]显示,癫痫发作所引起的脑损伤主要由神经元凋亡主导,有效控制神经元的凋亡能减少癫痫发作所引起的神经元损伤。黄芩苷(Baicalin)是中药黄芩中提取的单体化合物,具有抗氧化、抗炎、抗凋亡、抗肿瘤等功能[3],我们前期研究发现,黄芩苷对小鼠癫痫后海马神经细胞具有抗凋亡作用[4],但其具体机制尚不清楚。本研究采用海人酸(kainic acid,KA)建立癫痫模型,进一步探讨黄芩苷对小鼠癫痫持续状态后海马神经细胞凋亡的影响及其作用机理。
1 材料与方法
1.1 研究对象 由上海斯莱克实验动物中心提供的ICR健康雄性小鼠54只[许可证号:SCXK(沪) 2007-0005],体质量23~28g。随机分对照组、癫痫持续状态(SE)组和黄芩苷治疗组,每组18只。主要药品、试剂与仪器:黄芩苷购自美国sigma公司;海人酸购自美国BIOMOL公司;RT-PCR试剂盒购自美国Promega公司;兔抗鼠Bax、Bcl-2多克隆抗体购自santa Cruz公司;兔抗鼠caspase-3多克隆抗体购自santa Cruz公司;兔超敏二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司);蛋白浓度测定试剂盒购自碧云天生物技术研究所。
1.2 制模与给药 采用腹腔内注入KA(12mg/kg)建立小鼠癫痫持续状态模型。按Racines[5]分级标准评价癫痫行为:0级,正常行为;I级,面部肌肉痉挛表现为咀嚼运动、眨眼、动须等,湿狗样颤动;Ⅱ级,颈部肌肉痉挛表现为点头运动;Ⅲ级,一侧前肢阵挛;Ⅳ级,站立伴双前肢阵挛;V级,在Ⅳ级的基础上身体向后倒下失去平衡,四肢抽动。达到Ⅲ级改变以上者定为癫痫发作,连续的痫性发作超过30 min以上者为SE。制模过程中因癫痫持续状态死亡3只,制模成功率约75%,制模不成功者予以剔除,不足预定数额者按照随机抽样原则补齐动物并重新制备模型。制模成功后,黄芩苷治疗组以100mg/kg的剂量腹腔注射黄芩苷1次,12h后重复注射1次(黄芩苷生物半衰期较短,本实验采取2次给药法,结合既往的研究结果,黄芩苷100mg/kg为最适药物浓度[6])。SE组和对照组注入等量的生理盐水。ICR小鼠每组6只,10%水合氯醛腹腔麻醉后,用生理盐水与4%多聚甲醛心脏灌注取脑,4%多聚甲醛浸泡过夜,前囟后1.8~3.0mm处脑冠状切面行石蜡切片,用于TUNEL染色和免疫组化;每组另取12只ICR小鼠,麻醉后断头取双侧海马,提取总蛋白与RNA,分别用于Western blot与RT-PCR。
1.3 TUNEL法检测神经元凋亡 按TUNEL试剂盒说明书进行染色与检测。光镜下观察海马CA1、CA3区棕褐色TUNEL阳性细胞,并计数连续3张切片整个CA1、CA3区TUNEL阳性细胞数,在400倍视野计算平均阳性细胞百分数。
1.4 免疫组化检测caspase-3的分布 石蜡切片常规脱蜡脱水。按照说明书采用SP法进行染色。以PBS代替一抗作阴性对照。caspase-3一抗浓度为1:100。DAB显色,苏木素复染,盐酸分化,氨水返蓝。光学显微镜观察、拍片。
1.5RT-PCR检测Bcl-2和BaxmRNABcl-2引物序列(240bp):5'-CTC GTC GCT ACC GTC GTG ACT TCG-3'(上游),5'-CAG ATG CCC GTT CAG GTA CTCAGTC-3'(下游)。Bax引物序列(360bp):5′-AAG CTG AGCGAG TGTCTCCGGCG′(上游),5′-GCC ACA AAG ATG GTC ACT GTC TGCC-3′(下游)。内参β-actin引物序列(198bp):5′ATC GTG CGT GAC ATC AAA GAGA3′(上游),5′TGC CAC AGG ATTCCA TACCCAA3′(下游)。用Trizol提取海马组织总RNA。逆转录合成cDNA第一链,操作步骤根据RT-PCR试剂盒说明进行。PCR反应条件设置如下:94℃预变性4min,94℃变性40 s,退火(Bcl-2:58℃40 s;Bax:60℃40s),72℃延伸1min,32个循环。PCR结果采用凝胶扫描分析仪扫描凝胶,并分析Bcl-2、Bax与β-actin基因谱带的积分光密度,以两者比值(即相对系数)表示Bcl-2、BaxmRNA的相对表达水平。
1.6Western blot检测Bcl-2和Bax蛋白取各组小鼠双侧海马组织,匀浆后分别提取总蛋白以牛血清白蛋白作标准曲线,BCA法测定蛋白浓度。常规电泳,转膜,封闭后分别加入Bcl-2、Bax一抗抗体(1:800用TBST稀释),4°C静置过夜,洗膜,加入辣根过氧化物酶标记二抗(1:2500用TBST稀释),TBST洗膜3次,吸取等量SuperSignal-WestPico超灵敏型检测试剂盒A液、B液,均匀滴于NC膜上进行化学发光胶片显影,图像由Bio-Rad公司Gel Doc XR凝胶成像系统扫描,图像分析用Quantity One(version 4.6)分析软件完成,计算Bcl-2和Bax蛋白的表达水平。
1.7 统计学方法 数据统计采用SPSS 17.0,实验结果以(±s)表示,采用单因素方差分析进行组间差异的显著性检验,再用Bonferroni法进行两两比较,检测水准α=0.05。
2 结果
2.1 行为学观察 KA注射后0.2~3h,小鼠逐渐出现凝视、翘尾、转圈、阵发性头面部肌肉抽搐、节律性点头,前肢阵挛、后肢站立、全面强直-阵挛发作,直至出现癫痫持续状态。4h后发作逐渐减少,至6~24 h,SE组小鼠仍可出现或Ⅳ级癫痫发作,而黄芩苷治疗组小鼠随治疗次数增加,癫痫发作级别多为Ⅲ级以下,且发作次数有所减少。对照组小鼠未观察到癫痫发作。
2.2 黄芩苷对癫痫鼠海马TUNEL阳性细胞的影响 TUNEL染色结果显示,对照组基本未见棕褐色的阳性颗粒细胞,而癫痫持续状态后海马CA1、CA3区棕褐色阳性细胞显著增加,黄芩苷治疗组海马CA1、CA3区TUNEL阳性细胞较SE组明显减少,两者差异有统计学意义(CA1区:F=255.8,P= 0.016;CA3区:F=135.6,P=0.008),见图1、表1。
2.3 免疫组化观察小鼠海马中caspase-3的活化及分布情况 对照组可见海马CA1、CA3区有少量散在caspase-3阳性细胞,着色不深。SE组海马CA1、CA3区可见数目较多的阳性细胞,且分布密集。表现为胞浆及核膜着色,呈棕黄色,着色较深,胞浆内可见棕黄色颗粒沉淀物。与SE组相比,黄芩苷治疗组海马CA1、CA3区的棕黄色颗粒状阳性细胞数明显减少,着色较前者浅,二者差异明显(见图2)。
表1 海马CA1、CA3区TUNEL染色细胞凋亡率(±s)

表1 海马CA1、CA3区TUNEL染色细胞凋亡率(±s)
1)经Bonferroni检验,与对照组比较,P<0.01;2)经Bonferroni检验,与SE组比较,P<0.05
组别SE组黄芩苷治疗组对照组n 6 6 6 CA1区细胞凋亡率0.7258±0.02351)0.3984±0.05861)2)0.0128±0.0222 CA3区细胞凋亡率0.6191±0.06861)0.3593±0.03911)2)0.0063±0.0066
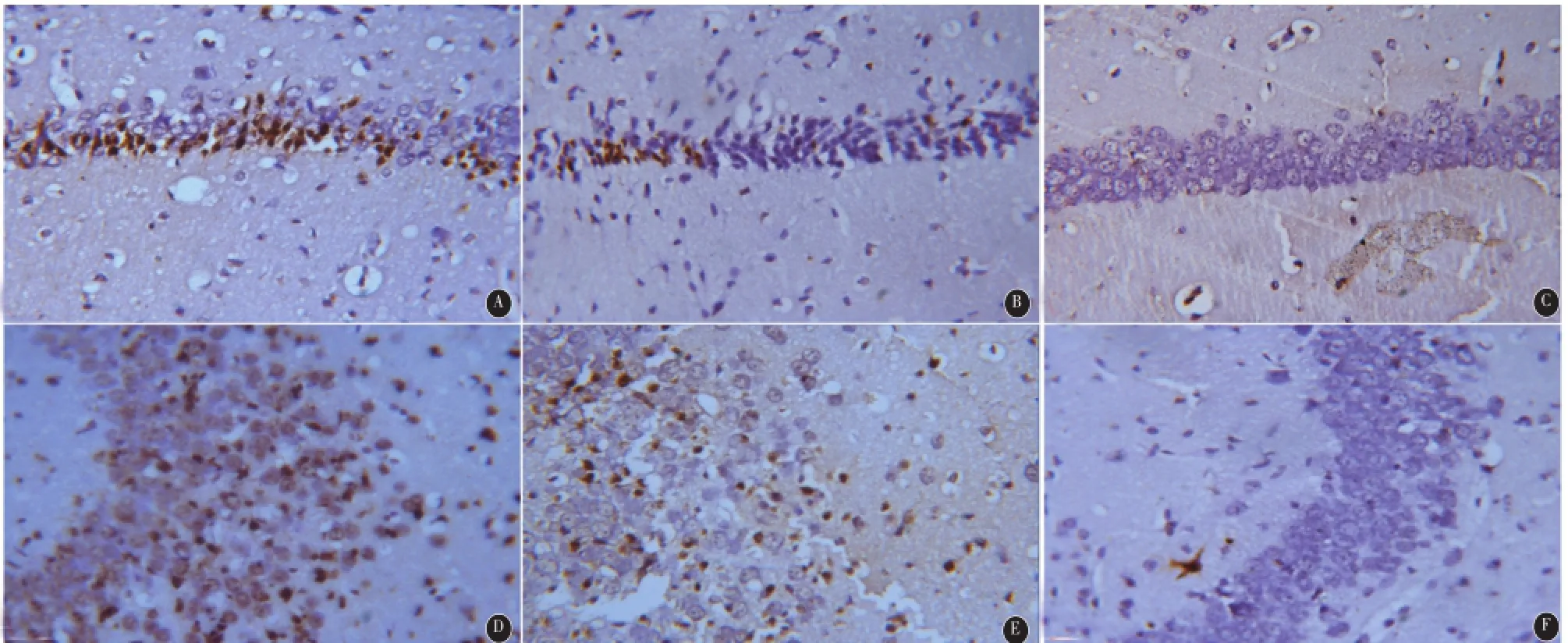
图1 TUNEL染色检测小鼠海马CA1、CA3区的细胞凋亡(400×,图中棕褐色颗粒为阳性表达)(A-C为CA 1区;D-F为CA3区。A、D为SE组;B、E为黄芩苷治疗组;C、F为对照组;)
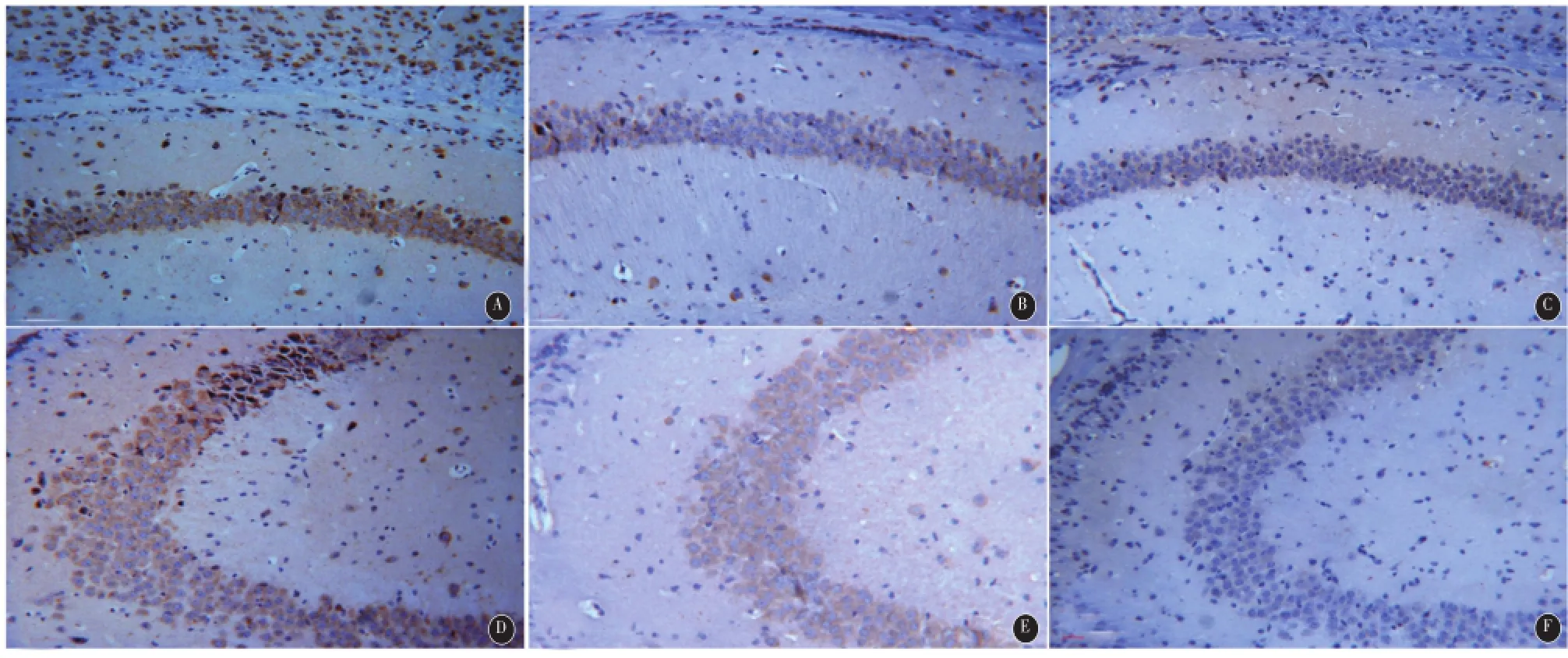
图2 免疫组化观察小鼠海马CA1、CA3区caspase-3的活化及分布情况(200×)。A-C为CA1区;D-F为CA3区。A、D为SE组;B、E为黄芩苷治疗组;C、F为对照组
2.4 黄芩苷对癫痫小鼠海马Bcl-2和BaxmRNA表达的影响 自小鼠海马组织提取的总RNA经逆转录及PCR扩增后,均出现了背景清晰但亮度不同的条带,表示各组均有Bcl-2和BaxmRNA的表达(图3),对各组条带进行光密度分析,可见对照组仅有少量的Bcl-2和BaxmRNA表达。与对照组相比,SE组Bcl-2 mRNA无明显差异(F=17.3,P=0.527),而BaxmRNA表达则明显增多(F=53.8,P=0.006)。与SE组相比,黄芩苷治疗组则明显增加Bcl-2 mRNA的表达(F=17.3,P=0.018),降低BaxmRNA的表达(F=53.8,P=0.022),见表2。
2.5 黄芩苷对癫痫小鼠海马内Bcl-2、Bax及caspase-3蛋白表达的影响 Western blot结果显示,对照组Bcl-2、Bax及caspase-3蛋白的表达量均较少。与对照组相比,SE组Bcl-2蛋白表达无明显差异(F=105.8,P=0.065),而Bax和caspase-3蛋白的表达则明显增多(Bax:F=13.2,P=0.008;caspase-3:F=59.2,P=0.002)。与SE组相比,黄芩苷治疗组则明显增加Bcl-2蛋白的表达(F=105.8,P= 0.005),降低Bax和caspase-3蛋白的表达(Bax:F= 13.2,P=0.027;caspase-3:F=59.2,P=0.004)(图4、表3)。
3 讨论
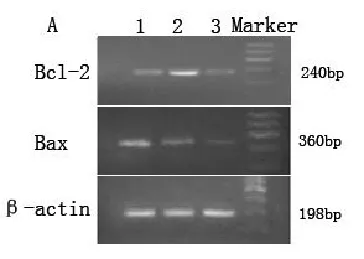
图3 各组mRNA表达情况,1:SE组;2:黄芩苷治疗组;3:对照组
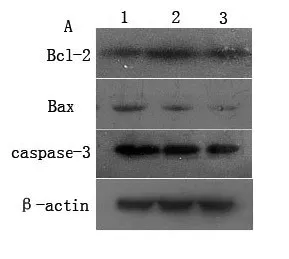
图4 小鼠海马组织中Bcl-2、Bax及caspase-3蛋白的表达水平。1:SE组;2:黄芩苷治疗组;3:对照组
癫痫持续状态(status epilepticus,SE)是神经科常见的急症之一,也是最严重的癫痫发作形式,具有很高的发病率和致残率,给患者的生活和工作造成极大影响[7]。即往认为,坏死是癫痫后神经细胞死亡的唯一方式,但近几年研究发现,癫痫发作后神经元死亡存在另一种死亡形式,即凋亡[8]。较多的研究显示颞叶癫痫中海马神经细胞丢失以细胞凋亡为主,癫痫发作后脑神经元有大量凋亡现象出现,因此凋亡被普遍认为是癫痫后脑神经元死亡的一种形式[3,8]。细胞凋亡是由多种基因控制的,有促进凋亡的基因如Bax;也有抗凋亡的基因如Bcl-2。Bax是一种重要的促进细胞凋亡基因,它可以使细胞色素C得以穿过线粒体膜,使caspase-9激活,并进一步激活caspase-3,最终导致细胞凋亡。Tuunanen等[9]发现癫痫发作后海马神经细胞内早期即可检测出明显增多的Bax凋亡蛋白。Bcl-2是凋亡的中心调节蛋白之一,参与许多疾病的发生,对凋亡具有负调控作用,其抑制细胞凋亡的作用机制可能有以下几种:①Bcl-2通过改变细胞器的Ca2+外流抑制细胞凋亡;②通过抗氧化作用和抑制自由基来抑制细胞凋亡;③Bcl-2还可以和Bax等促凋亡基因结合形成Bcl-2/Bax异二聚体来抑制细胞凋亡;④Bcl-2阻断P53进入核内,从而阻断P53诱导的细胞凋亡[10]。Jurgensmei等[11]发现,Bcl-2可抑制线粒体膜电位的降低、细胞色素和凋亡诱导因子的释放及caspase的激活从而抑制凋亡。本研究通过TUNEL染色观察小鼠海马CA1、CA3区神经细胞的凋亡程度;以及检测检测Bax、Bcl-2和caspase-3的表达量发现,小鼠癫痫发作后细胞凋亡数目增多,Bax、caspase-3的表达也明显增多,与文献报道一致。
表2 RT-PCR检测Bcl-2和Baxm RNA在不同组别的相对表达量±s)

表2 RT-PCR检测Bcl-2和Baxm RNA在不同组别的相对表达量±s)
1)经Bonferroni检验,与对照组比较,P<0.05;2)经Bonferroni检验,与SE组比较,P<0.05
组别SE组黄芩苷治疗组对照组n 6 6 6 Bcl-2/β-actin mRNA 1.1935±0.3503 2.0915±0.24561)2)0.8610±0.1677 Bax/β-actinmRNA 2.2397±0.20811)1.6775±0.11571)2)0.7803±0.1845
黄芩苷是中药黄芩中提取的单体化合物,属葡萄糖醛酸苷类,易通过血-脑屏障,目前临床主要用于抗菌、消炎、抗感染治疗。有研究显示,黄芩苷还具有抗氧化、抗凋亡等功能[3],并已广泛运用于脊髓缺血损伤、脑缺血再灌注损伤等方面的研究。Cao[12]等在脊髓缺血模型中报道,黄芩苷能显著抑制大鼠脊髓缺血诱导的促凋亡基因Bax的表达,而增加抗凋亡基因Bcl-2的表达,并能显著抑制caspase-3的产生,从而大大降低大鼠脊髓缺血诱导的神经细胞凋亡。Tu[13]等在脑缺血的模型中发现,黄芩苷能减少大鼠脑缺血诱导的caspase-3的产生,并能抑制IL-1β、TNF-α、iNOS、COX-2等炎症因子的产生。本研究采用KA诱导小鼠癫痫持续状态模型,探讨黄芩苷对小鼠癫痫持续状态后海马神经细胞凋亡的影响发现,与SE组相比,黄芩苷治疗组能显著减少小鼠癫痫持续状态后海马组织中促凋亡基因Bax的表达,增加抗凋亡基因Bcl-2的表达。为了进一步证实黄芩苷的抗凋亡作用,我们检测了凋亡因子caspase-3——是检测凋亡的一个重要指标,在细胞凋亡的蛋白酶级联切割途径中处于核心位置,发现癫痫发作后caspase-3含量较对照组明显增多,经黄芩苷治疗后caspase-3含量显著减少,二者之间的差异具有统计学意义。综上所述,黄芩苷能够抑制小鼠癫痫持续状态后海马神经细胞的凋亡,其作用机制可能通过上调Bcl-2的表达和下调Bax、caspase-3的表达有关。其具体作用途径有待进一步研究。
表3 Western blot检测Bcl-2、Bax及caspase-3蛋白在不同组别的相对表达量(±s)

表3 Western blot检测Bcl-2、Bax及caspase-3蛋白在不同组别的相对表达量(±s)
1)经Bonferroni检验,与对照组比较,P<0.05;2)经Bonferroni检验,与SE组比较,P<0.05
组别SE组黄芩苷治疗组对照组n6 6 6 Bcl-2/β-actin 0.6993±0.0078 1.2423±0.04691)2)0.8200±0.0682 Bax/β-actin 1.2099±0.27851)0.6216±0.16501)2)0.4483±0.0636 Caspase-3/β-actin 1.4149±0.11971)1.0138±0.05281)2)0.6292±0.0795
[1] Zhang YF,Xiong TQ,Tan BH, et al. Pilocarpine-induced epilepsy is associated with actin cytoskeleton reorganization in the mossy fiber-CA3 synapses[J].Epilepsy Res,2014,108(3):379-389.
[2] Grieb P,Stelmasiak Z,Rejdak K,et a1.The mechanisms of neronal death and advances in the neural protection In epilepsy [J].Neurol Neurochir Pol,2000,34(suppl 18):85-93.
[3] Xue X,Qu XJ,Yang Y, et al. Baicalin attenuates focal cerebral ischemic reperfusion injury through inhibition of nuclear factor kappaB p65 activation[J].Biochem Biophys Res Commun,2010, 403(3-4):398-404.
[4] 欧阳龙强,梁日生,杨卫忠,等.黄芩苷对小鼠癫痫持续状态后海马神经细胞的保护作用[J].中华实验外科杂志,2012,29(9):118-121.
[5] Racine RJ,Steingart M,Mcintyre DC.Development of kindlingprone and kindling resistant rats:selective breeding and electrophysiologicalstudies[J].Epilepsy Res,1999,35(3):183-195.
[6] Liu YF,Gao F,LiXW, et al. The Anticonvulsantand Neuropro tective Effects of Baicalin on Pilocarpine Induced Epileptic Model in Rats[J].Neurosci Res,2012,37(8):1670-1680.
[7] 李维,周东.癫痫撤药相关问题[J].中国神经精神疾病杂志,2013,39(6):382-384.
[8] FialaM,Avagyan H,Merino JJ,etal.Chemotactic and mitogenic stimuli of neuronal apoptosis in patients with medically intractable temporal lobe epilepsy[J].Pathophysiology,2013,20 (1):59-69.
[9] Tuunanen J,Lukasiuk K,Halonen T, et al. Status epilepticusinduced neuronal damage in the rat amygdaloid complex:distribution,time-course and mechanisms[J].Neuroscience.1999,94 (2):473-495.
[10] Kluck RM,Bossy-Wetzel E,Green DR, et al. The release of cytochromec from mitochondria:a primary site bcl-2 regulation of apoptosis[J].Science,1997,275(5303):1132-1136.
[11] Jurgensmei JM,Xie ZH,Deveraux Q, et al. Bax directly induces release of cytochrome c from isolated mitochondria.Proc Natl Acad SciUSA,1998,95(9):4997-5002.
[12] Cao Y,Li G,Wang YF, et al. Neuroprotective effect of baicalin on compression spinal cord injury in rats[J].Brain Res,2010,21(1357):115-123.
[13] Tu XK,Yang WZ,Shi SS, et al. Neuroprotective effect of baicalin in a rat model of permanent focal cerebral ischemia[J]. Neurochem Res,2009,34(9):1626-1634.
Effects of baicalin on the apop tosis of hippocampal neurons in epilepticm ice induced by kainic acid.
OUYANG Longqiang, YANG Shaochun, ZOU Lliansheng,LIANG Risheng, LIU Dehua, GAO Ziqiang, CHENG Wei.,
Department of Neurosurgery,The firstAf filiated Hospital ofGannan Medical College,Ganzhou 341000,China.Tel:0797-8269514.
ObjectiveMethodsResultsConclusions
Epilepsy Baicalin Kainic acid Apoptosis
R742.1
A
2013-11-07)
(责任编辑:甘章平)
10.3936/j.issn.1002-0152.2014.05.003
*赣南医学院第一附属医院神经外科(赣州341000)
△福建医科大学附属协和医院神经外科
