玻璃化冻存对鲫鱼卵细胞活性的影响
2014-04-25沈蔷章海敏施旆旆胡军祥
沈蔷,章海敏,施旆旆,胡军祥
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江农林大学 动物科技学院,浙江 临安 311300)
玻璃化冻存对鲫鱼卵细胞活性的影响
沈蔷1,章海敏2,施旆旆1,胡军祥2
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江农林大学 动物科技学院,浙江 临安 311300)
以鲫鱼Carassius cuvieri未成熟的卵细胞为材料,研究了玻璃化冻存对鲫鱼卵细胞的存活率及琥珀酸脱氢酶(SDH)活性的影响。结果表明:鲫鱼卵细胞存活率在1~6 d下降明显,6~8 d下降趋势减弱,保持相对稳定;琥珀酸脱氢酶活性呈显著下降(P<0.05)。玻璃化冻存液VSd组的冻存效果最好,其组分为180.0 g·L-11,2-丙二醇,110.0 g·L-1甲醇,0.1 mol·L-1海藻糖和40.0 g·L-1聚乙二醇。该玻璃化冻存液配方及方法在一定时间内保存鲫鱼未成熟卵细胞具有一定的应用价值。图4表2参22
动物学;卵细胞;玻璃化冻存;玻璃化冻存液;存活率;琥珀酸脱氢酶(SDH)
玻璃化冷冻保存技术对鱼类卵细胞的冷冻保存仍少见报道[1]。鱼类的卵与一般细胞相比由于其体积大,相对比表面积小,含水率高,卵黄多等特点,限制了水分的渗出和抗冻剂渗入的速率。同时由于卵细胞具有高度的冷冻敏感性,容易造成冷冻损伤[2]。因此,探索适合于鱼类卵细胞玻璃化冷冻保存技术,可为建立鱼卵细胞库提供技术与方法。本研究以鲫鱼Carassius cuvieri未成熟的卵细胞为材料,对几种毒性相对较低的渗透性抗冻剂的混合比例、玻璃化冻存对卵细胞存活率和琥珀酸脱氢酶(SDH)活性的影响进行研究,以期为鱼类卵细胞冷冻保存及损伤机制的研究提供实验依据。
1 材料与方法
1.1 鲫鱼卵细胞的分离
选取性发育成熟的雌性鲫鱼,用体积分数为75%乙醇消毒,剪开腹部,取出两侧卵巢,置于D-hank’s液中。去除卵巢周围的脂肪、结缔组织及血块等,撕开卵巢外膜并轻轻抖动,用移液管轻轻吹打卵细胞5~10次至卵细胞单个分离。用D-hank’s溶液洗涤分离好的卵细胞2~3次[6]。
1.2 鲫鱼卵细胞玻璃化溶液的配方设计
实验根据本课题组已成功冻存胚脑[4]、软骨[5]等细胞的玻璃化溶液为基础进行改良。根据Plachinta等[6]、Zhang等[7]的研究结果,选用了对鱼卵细胞毒性较低的1,2-丙二醇(PG)为主因子,辅以二甲基亚砜、甲醇、乙酰胺、蔗糖、海藻糖和聚乙二醇(平均分子量为4 000)等保护剂成分,再根据章龙珍等[8]和Zhang等[9]研究的耐受极限浓度,通过预实验确定各组分的浓度范围,然后进行均匀设计,以是否含有海藻糖分成2组,共11种玻璃化溶液(表1~2),并根据Guan等[1]、章龙珍等[10]和田永胜等[11]的方法进行玻璃化形成能力检测,各组均能形成玻璃化。

表1 不含海藻糖的玻璃化溶液Table 1 Vitrification solutions without trehalose

表2 含海藻糖的玻璃化溶液Table 2 Vitrification solutions with trehalose
1.3 鲫鱼卵细胞的玻璃化冻存程序
1.3.1 冷冻前的预平衡 将鲫鱼卵细胞在0℃下进行预平衡,采用三步平衡法:取100粒卵在1∶2稀释的玻璃化液中平衡10 min,再在1∶1稀释的玻璃化液中,平衡10 min后,取出转入玻璃化液中平衡10 min,分装入2.0 mL冷冻保存管中。
1.3.2 冻存 将上述冷冻管进行标记,直接投入到液氮(-196℃)中保存,冻存时间为:1,2,3,4,6和8 d。
1.3.3 复温 从液氮中取出的冷冻管直接投入37℃的水浴中,充分振荡使其快速复温融化。
1.3.4 冻存液的洗脱 复温融化后样品迅速转移到无菌离心管中。然后加入2倍体积的1.5 mol·L-1的蔗糖溶液,摇匀、静置10 min,去上清液,再加入2倍体积的0.5 mol·L-1的蔗糖溶液重悬浮,然后静置10 min,去上清液,加2倍体积的D-hank’s液重悬浮3次,去上清,加D-hank’s液摇匀备用。
1.4 指标检测
1.4.1 卵细胞存活率检测 以台盼蓝拒染法检测细胞存活率。计算公式为:细胞的存活率=(洗脱后的活细胞数/洗脱后的细胞数)×100%。
1.4.2 MTT[3-(4,5)-dimethylthiahiazo(-z-y1)-2,5-diphenytetrazoliumromide]法检测卵细胞琥珀酸脱氢酶(SDH)活性根据Mosmann的方法[12]稍加改进,取冻存后洗脱的卵细胞于16孔无菌培养板中,加入1.0 mL培养液,再加入5.0 g·L-1的MTT溶液100 μL,放入37℃的50.0 mL·L-1二氧化碳培养箱中孵育240 min,使MTT充分被还原,然后加入1.0 mL二甲基亚砜,摇匀30 min,使结晶物充分溶解后,在酶标仪上测定570 nm处的吸光值。
1.5 统计学方法
以上方法均随机选取多个样本,每个样本多次重复。采用Excel和SPSS软件对数据进行处理,利用单因素方差分析(one-way ANOVA)进行分析,比较结果用字母a,b,c,d,e,f在图中标记,图中在表示标准误差的误差线上方的字母相同表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05)。
2 实验结果
2.1 玻璃化冻存对鲫鱼卵细胞存活率的影响
图1所示为不含海藻糖组(VS1~VS6)玻璃化冻存液对鲫鱼卵细胞存活率的影响。经1~8 d的冻存后,各组卵细胞的存活率都随冻存天数的延长而呈下降趋势,6 d后下降趋势减弱。VS1组和VS3组在1~2及3~6 d的存活率下降幅度较大(P<0.05),在2~3 d和6~8 d之间变化不明显(P>0.05);VS2组的存活率在1,3,4和6 d之间存在显著性差异(P<0.05);VS4组的存活率在1,2,4和6 d之间存在显著性差异(P<0.05);VS5组的存活率除在2~3 d之间变化不明显外,在其他各天数之间都有显著变化(P<0.05);VS6组各天数之间均存在显著性差异(P<0.05)。比较各组存活率,VS4组的卵细胞存活率最高,经过1,2,3,4,6和8 d冻存后,卵细胞的存活率分别为65.49%±0.49%,57.97%±1.68%,56.79%±0.40%,54.89%±1.26%,41.82%±1.87%,39.96%±0.82%。
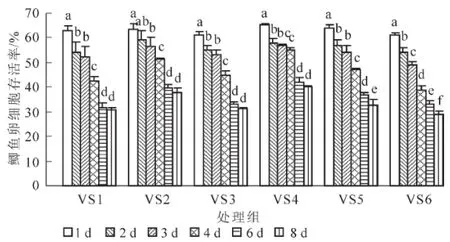
图1 不同玻璃化溶液(VS1~VS6组)对鲫鱼卵细胞存活率的影响(n=6)Figure 1 Changes of survival rate of VS1-VS6(n=6)
图2所示为海藻糖组(VSa~VSe)玻璃化冻存液在经过1~8 d的冻存后,对卵细胞存活率的影响。各组卵细胞的存活率都随冻存天数的延长而呈下降趋势,6 d后下降趋势减弱。VSa组和VSc组的存活率在1,2,4和6 d之间存在显著性差异(P<0.05);VSb组的存活率除在3~4 d之间下降不明显(P>0.05)外,在其他各天数之间都有显著性下降(P<0.05);VSd组的存活率在1,3,4和6 d之间存在显著性差异(P<0.05);VSe组的存活率在前6 d下降较快(P<0.05),在6~8 d之间变化不明显(P>0.05)。在各组玻璃化液中,VSd组的卵细胞存活率要高于其他组,经过1,2,3,4,6和8 d冻存后,卵细胞的存活率分别为64.40%±2.12%,60.24%±3.36%,57.20%±3.55%,51.90%±1.14%,40.29%±3.14%,37.98%±1.13%。
2.2 玻璃化冻存对鲫鱼卵细胞中琥珀酸脱氢酶(SDH)活性的影响
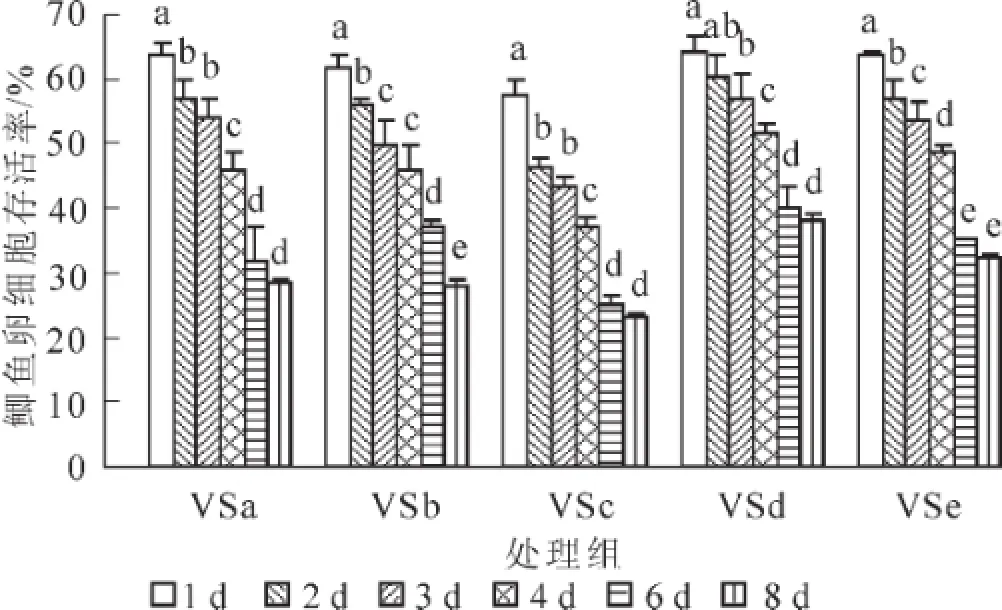
图2 不同玻璃化溶液(VSa~VSe组)对鲫鱼卵细胞存活率的影响(n=5)Figure 2 Changes of survival rate of VSa-VSe(n=5)
图3所示为不含海藻糖组(VS1~VS6)玻璃化冻存液在经过不同时间的冻存后,对鲫鱼卵细胞内琥珀酸脱氢酶(SDH)活性的影响。随着冻存天数的延长,冻存后的细胞内SDH活性逐渐降低。VS1组的SDH活性在前6 d下降幅度较大(P<0.05),在6~8 d变化不明显(P>0.05);VS2组的SDH活性在1,2,4和6 d之间存在显著性差异(P<0.05);VS3,VS4和VS5的细胞经检测后发现,其吸光值在2~3 d之间无显著性变化(P>0.05)。VS6组各天数之间均存在显著下降(P<0.05)。从整体上来看,在各组玻璃化液中,VS4组冻存后卵细胞内的SDH活性要明显高于其他组,在经过1,2,3,4,6和8 d冻存后,MTT实验检测到的吸光值分别为0.581±0.010,0.469±0.006,0.462±0.007,0.373±0.006,0.291± 0.008,0.272±0.011。
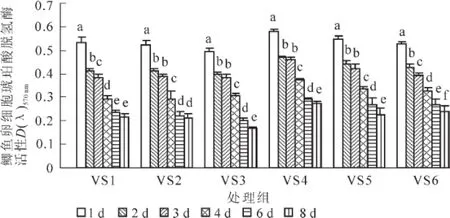
图3 不同玻璃化溶液(VS1~VS6组)对鲫鱼卵细胞SDH活性的影响(n=6)Figure 3 SDH activity of eggs in VS1-VS6(n=6)
图4为海藻糖组(VSa~VSe)玻璃化冻存液对卵细胞内琥珀酸脱氢酶(SDH)活性的影响。在冻存过程中,卵细胞内SDH活性逐渐降低。VSa组的SDH活性在前6 d下降幅度较大(P<0.05),在6~8 d变化不明显(P>0.05);VSb和VSc组各天数之间均存在显著性下降(P<0.05);VSd组的SDH活性在1,2,4和6 d之间存在显著性差异(P<0.05);VSe的细胞经检测后发现,其吸光值在2~4 d之间无显著性差别(P>0.05)。比较各组玻璃化冻存液,VSd组冻存后鲫鱼卵细胞内的SDH活性要明显高于其他组,在经过1,2,3,4,6和8 d冻存后,MTT实验检测到的吸光值分别为0.585±0.007,0.490± 0.009,0.473±0.008,0.423±0.014,0.305±0.016,0.290±0.016。
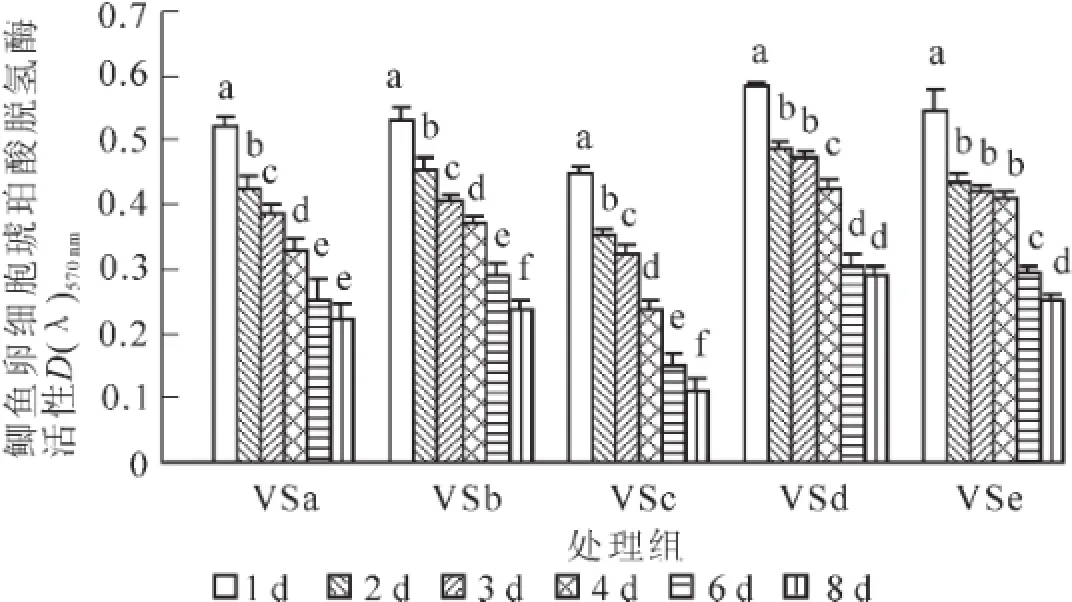
图4 不同玻璃化溶液(VSa~VSe组)对鲫鱼卵细胞SDH活性的影响(n=5)Figure 4 SDH activity of eggs in VSa-VSe(n=5)
3 讨论
玻璃化溶液的组分和冷冻保护剂的配比是冻存获得成功的关键,玻璃化冻存液应具备低毒、高渗和高玻璃化形成能力等特征。大多数玻璃化冻存液在高浓度使用时,对卵细胞有较大毒性,容易造成细胞渗透损伤[13]。冷冻保护剂的混合使用可能使单独使用时的毒性得到部分中和。本研究根据Guan等[1]、Plachinta等[6]、Zhang等[7]和Zhang等[14]的研究结果,结合本课题组已有的研究成果[4-5],选用1,2-丙二醇、二甲基亚砜、甲醇和乙酰胺等为渗透性保护剂,海藻糖、蔗糖和聚乙二醇等为非渗透性保护剂,配制成玻璃化溶液。1,2-丙二醇具有较低毒性和较强玻璃化形成能力。二甲基亚砜在大量实验中被证明具有易玻璃化和高渗透性等特点。乙酰胺是一种具有较高渗透性及毒性中和能力的保护剂。甲醇已被证明在斑马鱼Danio rerio的胚胎以及几种鱼类精子的冷冻保存具有明显效果[6]。海藻糖对生物体或生物大分子具有抗脱水、抗冷冻、抗高渗等非特异性保护作用。结果表明:不含海藻糖组的玻璃化溶液VS4和海藻糖组的VSd冻存鲫鱼卵细胞后的存活率较高,其组分分别为160.0 g·L-11,2-丙二醇,100.0 g·L-1二甲基亚砜,150.0 g·L-1甲醇,120.0 g·L-1乙酰胺,0.6 mol·L-1蔗糖,30.0 g·L-1聚乙二醇以及180.0 g·L-11,2-丙二醇,110.0 g·L-1甲醇,0.1 mol·L-1海藻糖,40.0 g·L-1聚乙二醇。且发现在海藻糖的浓度明显低于蔗糖时,2组的存活率并没有显著差异。海藻糖可能比蔗糖更适合作为玻璃化冷冻保护剂。
卵细胞膜对冷冻非常敏感,容易在冷冻过程中损伤[15],影响卵细胞的进一步发育[16]及受精时精卵质膜的融合。当细胞处于过冷状态时,细胞膜上从液态转变为凝胶态,同时,细胞膜的不等收缩会导致机械性的膜破裂及膜表面结构的改变,从而导致细胞死亡[17-18]。本研究以台盼蓝拒染法来检测玻璃化冻存后鲫鱼卵细胞的存活率,发现随着冻存天数的延长,细胞存活率成下降趋势,在6 d后基本达到稳定。我们认为玻璃化冷冻保存过程中冻存液浓度变化以及冰晶形成等都会对膜造成损伤,加入混合冷冻保护剂可以减轻这种损伤。
线粒体是卵细胞中最丰富的细胞器之一,数量巨大[19],其主要功能是为卵细胞的成熟、受精及卵裂提供能量。线粒体对环境因素的作用非常敏感,许多环境因素的影响都能迅速引起线粒体发生变化[20]。琥珀酸脱氢酶(SDH)位于线粒体内膜上,它参与线粒体内多种与细胞生命活动相关的反应,如呼吸链的电子传递、三磷酸腺苷(ATP)的合成等[21]。因此,SDH活性检测对评价冷冻前后线粒体功能具有重要意义[22]。卵细胞经玻璃化冻存后,SDH活性显著下降。可能是细胞在冷冻与解冻后,线粒体部分损伤,使线粒体内的酶分布发生改变,甚至引起酶的释放。这些酶游离出来进入基质,影响了酶的稳定性和活性;也有可能是冷冻保护剂的高毒性引起酶复合蛋白体解聚,造成酶系结构和功能的变化。
4 结论
从本研究结果分析,随着冻存天数的延长,鲫鱼卵细胞的存活率下降较为明显,但6 d后,存活率基本趋于稳定;而鲫鱼卵细胞的琥珀酸脱氢酶(SDH)活性则持续降低。玻璃化冻存液VSd组的配方及玻璃化冻存方法对保存鱼鲫鱼卵细胞有一定效果,但有待进一步研究和改进。
[1]GUAN Mo,RAWSON D M,ZHANG Tiantian.Cryopreservation of zebrafish(Danio rerio)oocytes by vitrification[J].Cryoletters,2010,31(3):230-238.
[2]WALLACE R A,SELMAN K.Ultrastructural aspects of oogenesis and oocyte growth in fish and amphibians[J].J Electron Microsc Technol,1990,16(3):175-201.
[3]吕众,张毅,魏华.2种分离斑马鱼卵母细胞方法的比较[J].生物技术通报,2008(增刊):342-346.
LÜ Zhong,ZHANG Yi,WEI Hua.Comparison of two separating methods of zebrafish oocytes culture in vitro[J].Biotechnol Bull,2008(supp):342-346.
[4]杨琼霞.玻璃化冻存小鼠脑细胞的研究[D].临安:浙江农林大学,2008.
YANG Qiongxia.Study on Mice Brain Cells Cryopreserved by Vitrification[D].Lin’an:Zhejiang A&F University,2008.
[5]黄佩龙,张绍志,虞效益,等.玻璃化冻存对羊软骨细胞的影响[J].浙江农林大学学报,2011,28(2):269 -274.
HUANG Peilong,ZHANG Shaozhi,YU Xiaoyi,et al.Vitrification of chondrocyte fromOvis aries[J].J Zhejiang A &F Univ,2011,28(2):269-274.
[6]PLACHINTA M,ZHANG T,RAWSON D M.Studies on cryoprotectant toxicity to zebrafish(Danio rerio)oocytes[J].Cryoletters,2004,25(6):415-424.
[7]ZHANG Qingjing,ZHOU Guangbin,WANG Yanping,et al.Cryoprotectants protect medak a(Oryzias latipes)embryos from chilling injury[J].Cryoletters,2012,33(2):107-116.
[8]章龙珍,刘宪亭,鲁大椿,等.鱼类胚胎冷冻保存前几个因子对其成活率影响的研究[J].淡水渔业,1992,22(1):20-24.
ZHANG Longzhen,LIU Xianting,LU Dachun,et al.Effects of several factors on the survival rate of fish embryo before it cryopreserved[J].Freshwater Fish,1992,22(1):20-24.
[9]ZHANG Tiantian,RAWSON D M.Feasibility studies on vitrification of intact zebrafish(Brachydanio rerio)embryos[J].Cryobiology,1996,33(1):1-13.
[10]章龙珍,刘宪亭,鲁大椿,等.玻璃化液对鲢鱼胚胎成活的影响[J].淡水渔业,1996,26(5):7-10.
ZHANG Longzhen,LIU Xianting,LU Dachun,et al.Effects of vitrification on the survival of silver carp embryo[J].Freshwater Fish,1996,26(5):7-10.
[11]田永胜,陈松林,严安生,等.鲈鱼胚胎的玻璃化冷冻保存[J].动物学报,2003,49(6):843-850.
TIAN Yongsheng,CHEN Songlin,YAN Ansheng,et al.Cryopreservation of the sea perch(Lateolabrax japonicus)embryos by vitrification[J].Acta Zool Sin,2003,49(6):843-850.
[12]陈宝安,王俊,薛萌,等.MTT比色法的改良及其在LAK细胞活性检测中的应用[J].东南大学学报:医学版,2001,20(3):150-152.
CHEN Bao’an,WANG Jun,XUE Meng,et al.Improvements of MTT assay and its application to the detection of lymphokine activated killer cells’activity[J].J Southeast Univ Med Sci Ed,2001,20(3):150-152.
[13]MAZUR P.Freezing of living cells:mechanisms and implications[J].Am J Physiol Cell Physiol,1984,247:c125 -c142.
[14]ZHANG Tiantian,RAWSON D M,TOSTI L,et al.Cathepsin activities and membrane integrity of zebrafish(Danio rerio)oocytes after freezing to-196°C using controlled slow cooling[J].Cryobiology,2008,56(2):138-143.
[15]ZERON Y,TOMCZA M,CROWE J,et al.The effect of liposomes on thermotropic membrane phase transitions of bovine spermatozoa and oocytes:implications for reducing chilling sensitivity[J].Cryobiology,2002,45(2):143-152.
[16]FUKU E,LIU Jianmin,DOWNEY B R.In vitro viability and ultrastructural changes in bovine oocytes treated with a vitrification solution[J].Mol Reprod Dev,1995,40(2):177-185.
[17]VALOJERDI M R,SALEHNIA M.Developmental potential and ultrastructural injuries of metaphaseⅡ(MⅡ)mouse oocytes after slow freezing or vitrification[J].J Assist Reprod Cenet,2005,22(3):119-127.
[18]GHETLER Y A,YAVIN S,SHALGI R,et al.The effect of chilling on membrane lipidphase transition in human oocytes and zygotes[J].Hum Reprod,2005,120:3385-3389.
[19]CUMMINS J M.The role of mitochondria in the establishment of oocytes:functional competence[J].Eur J Obstet& Gynecol Repord Bil,2004,115:s23-s29.
[20]汪亚平,王祖熊.几种鱼类线粒体ATP酶活性的比较研究[J].水生生物学报,1993,17(3):216-221.
WANG Yaping,WANG Zuxiong.A comparative study of activities of the mitochondria ATPase of the liver cells in several fishes[J].Acta Hydrobiol Sin,1993,17(3):216-221.
[21]BARRETO M C,PINTO R E,ARRABACA J D,et al.Inhibition of mouse liver respiration byChelidonium majusisoquinoline alkaloids[J].Toxi Lett,2003,146(1):37-47.
[22]PIASECKA M,WENDA-ROZEWICKA L,OGONSKI T.Computerized aic studies as methods to evaluate the function of the mitochondrial sheath in rat spermatozoa[J].Andrologia,2001,33(1):1-12.
Effects of vitrification in crucian carp(Carassius cuvieri)oocytes
SHEN Qiang1,ZHANG Haimin2,SHI Peipei1,HU Junxiang2
(1.School of Forestry and Biotechnology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.School of Animal Science and Technology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
The objectives were to analyze the effects of vitrification on the survival rate and succinate dehydrogenase(SDH)activity with immature oocytes in crucian carp(Carassius cuvieri).Results showed that the survival rate decreased significantly within 6 d after vitrification(P>0.05),and SDH activity continued to decrease(P<0.05).Glycol-based vitrification solutions(180.0 g·L-1propylene glycol,110.0 g·L-1methanol, 0.1 mol·L-1trehalose and 40.0 g·L-1polyethylene glycol)were selected for vitrification due to survival rates and SDH activity.This indicated that with this vitrification solution and method,cryopreservation for immature oocytes of crucian carp was practical.[Ch,4 fig.2 tab.22 ref.]
zoology;oocytes;vitrification solution;survival rate;succinate dehydrogenase(SDH)
S965.117;Q959.46+8
A
2095-0756(2014)01-0083-06
10.11833/j.issn.2095-0756.2014.01.013
2013-03-04;
2013-04-27
浙江省自然科学基金资助项目(LY13C110001)
沈蔷,从事动物生理和低温生物学等研究。E-mail:shen.qiang.105@163.com。通信作者:胡军祥,教授,博士,从事动物生理和低温生物学等研究。E-mail:hjxy060222@163.com
