半蒴苣苔的叶片组织培养及植株再生
2014-04-25阮慧泽李珍任燕燕邬枭楠邵于豪潘飞翔夏国华
阮慧泽,李珍,任燕燕,邬枭楠,邵于豪,潘飞翔,夏国华
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江省临安市森林资源保护管理总站,浙江 临安 311300)
半蒴苣苔的叶片组织培养及植株再生
阮慧泽1,李珍2,任燕燕1,邬枭楠1,邵于豪1,潘飞翔1,夏国华1
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江省临安市森林资源保护管理总站,浙江 临安 311300)
为了建立半蒴苣苔Hemiboea subcapitata的组培快繁技术体系,保护和开发利用半蒴苣苔这一民间植物药资源,以MS(Murashige and Skoog)为基本培养基,研究植物生长调节物质6-苄基腺嘌呤(6-BA)和萘乙酸(NAA)组合对叶片愈合组织诱导、不定芽分化,增殖和壮苗生根的影响,筛选出适合半蒴苣苔快繁的最适培养基。结果表明:叶片诱导愈合组织困难,但在叶片基部或切口处可直接诱导分化出不定芽,且随着6-BA和NAA质量浓度的升高,芽的分化率先上升后降低,以MS+0.5 mg·L-16-BA+1.0 mg·L-1NAA+1.5 g·L-1活性炭(AC)分化率最高,达到67.8%;但平均每外植体诱导芽数以MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA+1.5 g·L-1AC最多,达到6.69个;不定芽增殖以MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA处理增殖倍数最高,达到23.43;在添加不同质量浓度吲哚丁酸(IBA)的培养基中生根率均超过90%。图1表3参15
植物学;半蒴苣苔;叶片;快繁体系;组织培养;植株再生
半蒴苣苔Hemiboea subcapitata是苦苣苔科Gesneriaceae半蒴苣苔属Hemiboea多年生宿根草本[1],全草入药,味甘,性寒。具有清暑利湿、止咳、生津、解毒的功效,主治咽喉肿痛、外感暑湿、痈肿疮疖、蛇咬伤等症[2],对烧烫伤有一定的疗效[3]。环境的破坏和对野生药材资源的大量采集,造成了资源的日益匮乏,亟待进行半蒴苣苔的人工栽培以满足市场的需求,但半蒴苣苔人工繁育和栽培的研究尚处于初始阶段,成果不多。在自然状态下,半蒴苣苔通常生长在石灰岩岩缝中,籍匍匐枝行营养繁殖,增殖速度较慢。组织培养技术是苦苣苔科植物引种驯化及繁殖工作中的一种重要手段,以克服植物在迁地保育、繁衍、传播、杂交育种及工厂化生产中的障碍,达到种质资源保护和利用的目的[4]。本研究拟通过组织培养的方法,建立其组培快繁技术体系,为半蒴苣苔种苗规模化繁育提供技术支撑。
1 材料与方法
1.1 材料
半蒴苣苔植株采自浙江天目山国家级自然保护区,经浙江农林大学李根有教授鉴定为半蒴苣苔。用消过毒的剪刀剪下半蒴苣苔叶片,放入滴有洗洁精的水中浸泡15 min,并用柔软的牙刷轻轻刷去表面污垢,接着用自来水冲洗1 h。而后放置在超净工作台上,用体积分数为75%的乙醇浸泡15 s,用镊子取出叶片后用无菌水冲洗3次,接着放入体积分数为0.1%升汞中消毒6 min,用无菌水冲洗3次,再用无菌滤纸吸干其表面水分。叶片切割成约1 cm×1 cm,接入Murashige and Skoog(MS)+1.0 mg·L-16-苄基腺嘌呤(6-BA)+0.5 mg·L-1萘乙酸(NAA)初代培养基中。培养15 d后叶片切口基部直接分化出芽,待芽长至4~5 cm,具有5~6对叶片时用于后续试验。本研究中,所用的培养基均添加30.0 g·L-1的蔗糖和7.0 g·L-1的琼脂,pH 5.8。培养室光照强度为30~40 μmol·m-2·s-1,光照时间14 h·d-1,温度(25±1)℃。
1.2 方法
1.2.1 叶片愈合组织诱导及不定芽的分化 以MS为基本培养基,采用2因素4水平随机实验设计研究植物生长调节物质6-BA和NAA对叶片愈合组织诱导和不定芽分化的影响。6-BA设置4个水平(0.1,0.5,1.0,2.0 mg·L-1),NAA设置4个水平(0.1,0.5,1.0,1.5 mg·L-1),以上培养基均添加活性炭1.5 g·L-1。将半蒴苣苔无菌苗叶片切成约1.0 cm×1.0 cm大小接入愈伤组织诱导培养基中进行暗培养,接种5瓶·处理-1,接种叶片6片·瓶-1,培养50 d后观测愈合组织诱导和芽分化情况,统计愈合组织诱导率[愈合组织诱导率=(出愈苗数/接种数)×100%]和不定芽分化率[不定芽分化率=(分化苗数/接种数)×100%],平均每个外植体不定芽分化数(平均每个外植体不定芽分化数=不定芽总数/产生不定芽外植体数),重复3次·处理-1。
1.2.2 不定芽增殖培养 以MS为基本培养基,采用2因素3水平随机实验设计研究植物生长调节物质6-BA和NAA对不定芽增殖的影响。6-BA设置3个水平(0.1,0.5,1.0 mg·L-1),NAA设置3个水平(0,0.5,1.0 mg·L-1)。将生长良好,长1.5~2.0 cm,具有2~3对叶的不定芽接入增殖培养基中进行培养,接种6瓶·处理-1,接种不定芽5个·瓶-1,培养40 d后统计不定芽增殖倍数(增殖倍数=增殖后不定芽数量/增殖前接入不定芽数量),重复3次·处理-1。
1.2.3 生根培养与移栽 以MS为基本培养基,采用单因素试验设计研究生长素吲哚丁酸IBA对不定芽生根的影响,IBA设置5个水平(0.1,0.5,1.0,1.5,2.0 mg·L-1)。将长约3 cm的不定芽接入生根培养基,接种6瓶·处理-1,接种不定芽5个·瓶-1,培养30 d后统计生根率[生根率=(生根植株/接入植株×)100%],随机抽取10株测量平均生根数和平均根长,重复3次·处理-1。
取生长健壮、根系良好的组培苗进行开瓶练苗,放到全天自然光照,温度25℃的通风条件下练苗7~10 d。练苗结束后,取出组培苗用水清洗干净根部的培养基,移栽于泥炭和蛭石按1∶1均匀混合的栽培基质中,浇透水后在遮光度为70%的大棚中驯化,定期浇水保持苗床湿度,40 d后统计成活率。
1.3 统计分析
数据采用均值±标准误差表示,采用PASW Statistics 18进行Duncan多重比较,百分率经反正弦平方根转换DEGREES[ASIN(SQRT(NO.))]后进行多重比较和相关分析。
2 结果与分析
2.1 不定芽的分化
叶片培养8~10 d开始略微出现卷曲现象,之后均未见明显的愈合组织形成,但在基部切口处可直接分化出白色的芽(图1-a),在培养约30 d后,芽大量发生。研究发现,半蒴苣苔愈合组织诱导困难,6-BA和NAA不同质量浓度处理均未诱导出愈合组织。在半蒴苣苔叶片基部切口处可以直接分化出不定芽,不定芽分化率随着6-BA和NAA质量浓度上升呈现先升高后下降的现象。同时,在高质量浓度(2.0 mg·L-1)的6-BA处理中,叶片外植体大量褐化。在不同植物生长调节物质组合下不定芽分化率存在显著性差异(P<0.05),以MS+0.5 mg·L-16-BA+1.0 mg·L-1NAA不定芽分化率最高,达到67.78%,平均每个外植体分化出不定芽3.90个。而MS+0.5 mg·L-16-BA+1.0 mg·L-1NAA不定芽的诱导率虽仅为14.45%,但平均每个外植体分化出不定芽数量最多,达到6.69个(表1)。

表1 不同植物生长调节物质配比对半蒴苣苔叶片愈合组织和不定芽分化的影响Table 1 Effect of plant growth regulators on callus induction and adventitious buds differentiation of Hemiboea subcapitata
2.2 半蒴苣苔不定芽增殖培养
不定芽接入增殖培养基,10 d左右腋芽开始萌发,15~20 d不定芽大量发生(图1-b)。不定芽接入增殖培养基培养40 d后,统计不定芽增殖倍数及生长情况(表2)。研究表明,半蒴苣苔在应试的9个处理中均有较好的增殖率,附加6-BA和NAA的处理平均增殖倍数较高,处理间不定芽增殖倍数存在显著性差异(P<0.05)。不定芽增殖率随着6-BA和NAA质量浓度上升呈现先升高后下降的现象。不定芽增殖以MS+0.5 mg·L-16-BA+0.5 mg·L-1NAA增殖倍数最高,达到23.43。
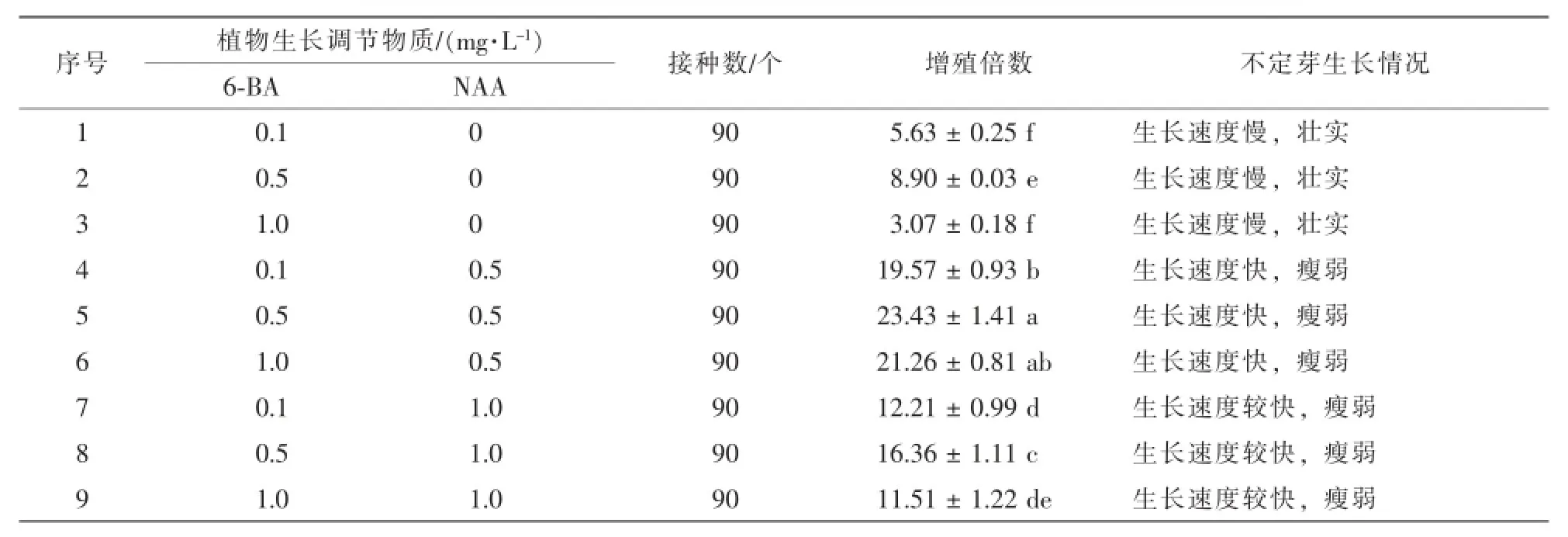
表2 植物生长调节物质配比对半蒴苣苔不定芽增殖的影响Table 2 Effect of plant growth regulators on adventitious buds proliferation of Hemiboea subcapitata
2.3 不定芽生根与移栽
不定芽接入生根培养基,5~8 d不定芽基本开始生根,10~15 d不定根大量发生(图1-d)。培养30 d后统计不定芽生根情况(表3)。结果表明:半蒴苣苔生根容易,所有处理的生根率均超过90%,其中IBA质量浓度为1.0 mg·L-1和1.5 mg·L-1的培养基中,生根率均达到100%。30 d后观察统计,MS+1.5 mg·L-1IBA培养基为最适培养基,再生植株平均每株具根9.23条,平均根长2.78 cm(图1-e)。
生根植株经炼苗后移栽于温室大棚中,以泥炭和蛭石1∶1均匀混合为移栽基质,移栽30 d后,以抽生新芽生长为移栽成活的标准统计成活率,发现移栽成活率达到90%以上(图1-f)。
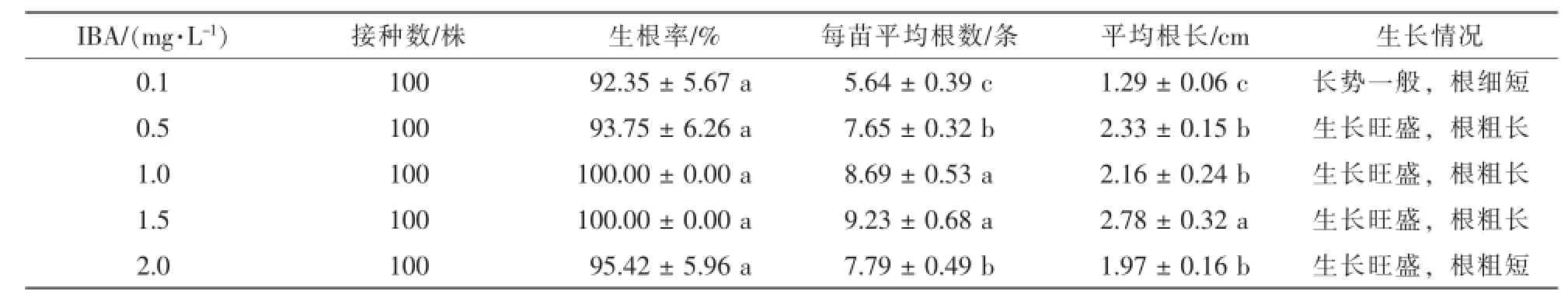
表3 不同质量浓度的IBA对半蒴苣苔生根的影响Table 3 Effects of different concentration of IBA on rooting of Hemiboea subcapitata

图1 半蒴苣苔组培再生体系Figure 1 Regeneraton of Hemiboea subcapitata
3 讨论
苦苣苔科植物组织培养已有大量的报道[5-10]。汤正辉等[11]以半蒴苣苔叶片为外植体,在诱导芽分化的培养基MS+0.1 mg·L-16-BA+0.1 mg·L-1NAA培养15 d后,叶片切口处开始肿胀,并出现较为致密的翠绿色愈合组织,约30 d后,部分切口处出现不定芽。本研究以叶片为外植体,均未诱导出愈合组织,且外植体容易褐化,在未褐化叶片切口基部能直接分化出不定芽。较低浓质量度的6-BA(0.5~1.0 mg·L-1)和NAA(0.5~1.0 mg·L-1)对不定芽分化有利,以MS+0.5 mg·L-16-BA+1.0 mg·L-1NAA不定芽分化率最高,达到67.78%,平均每个外植体分化出不定芽3.90个。以半蒴苣苔叶片为外植体进行愈合组织的诱导仍有待进一步研究。
植物组织培养中,一定质量浓度的生长素利于诱导外植体脱分化和促进愈合组织生长,生长素质量浓度过低或过高,均不利于外植体的脱分化和再分化[12]。较低的生长素/细胞分裂素比率有利于不定芽增殖,但过高水平的细胞分裂素促进不定芽的诱导和增殖,往往形成大量细密的无效的不定芽;而较高的生长素/细胞分裂素比率有利于不定芽壮苗和生根[13-14],细胞分裂素可以促进丛生芽的增殖[15]。半蒴苣苔不定芽增殖过程中单一使用细胞分裂素,不定芽增殖倍数普遍较低,在与低质量浓度的NAA(0.5 mg· L-1)配合使用时,随着6-BA质量浓度的增加,增殖倍数也随之增加,而与较高质量浓度的NAA(1.0 mg·L-1),不定芽增殖倍数随6-BA的质量浓度的升高而降低。因此,在半蒴苣苔不定芽增殖中,6-BA与NAA存在交互作用。
现阶段,半蒴苣苔野生资源日益枯竭,必须依靠人工栽培种植,而人工栽培主要靠异地引种。本研究成功地建立了半蒴苣苔组织培养与植株再生技术体系,为半蒴苣苔种苗生产提供了技术保障,对半蒴苣苔种质资源的保护和离体保存具有重要意义。
[1]王文采,潘开玉,张志耕,等.中国植物志:第69卷[M].北京:科学出版社,1990.
[2]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999.
[3]李振宇.半蒴苣苔属的研究[J].植物分类学报,1987,25(2):81-92.
LI Zhenyu.A study of the genusHemiboea[J].Acta Phytotaxon Sin,1987,25(2):81-92.
[4]李振宇,王印政.中国苦苣苔科植物[M].郑州:河南科学技术出版社,2004.
[5]JIA Li,QUAN Xing,CHEN Weilun,et al.Tissue culture and rapid propagation ofChirita medicaD.Fang ex W.T. Wang[J].Propag Ornament Plants,2009,9(2):97-101.
[6]MA Guohua,JAIME A.TEIXEIRA D S,et al.Shoot organogenesis and plant regeneration inMetabriggsia ovalifolia[J].Plant Cell,Tissue Organ Cult,2011,105(3):355-361.
[7]XU Quanle,HU Zhe,LI Chunyuan,et al.Tissue culture ofSinningia speciosaand analysis of the in vitro-generated tricussate whorled phyllotaxis(twp)variant[J].In Vitro Cell Dev Biol Plant,2009,45:583-590.
[8]CUI Jin,CHEN Jianjun,HENNY R J.Regeneration ofAeschynanthus radicansvia direct somatic embryogenesis and analysis of regenerants with flow cytometry[J].In Vitro Cell Dev Biol Plant,2009,45:34-43.
[9]TANG Zhenghui,LIN Honghui,SHI Lei,et al.Rapid in vitro multiplication ofChirita longgangensisW.T.Wang:an endemic and endangeredGesneriaceae speciesin China[J].HortScience,2007,42(3):638-641.
[10]TANG Zhenghui,SHI Lei,CHEN Weilun,et al.In vitro propagation ofChirita heterotrichaMerr.[J].Prop Orn Plants,2007,7(1):43-48.
[11]汤正辉,石雷,陈维伦,等.半蒴苣苔的组织培养和快速繁殖[J].植物生理学通讯,2005,41(3):333.
TANG Zhenghui,SHI Lei,CHEN Weilun,et al.Tissue culture and rapid propagation ofHemiboea subcapitata[J].Plant Physiol J,2005,41(3):333.
[12]陈桂信,谢文龙,潘东明,等.木奈幼胚胚性愈伤组织诱导的研究[J].江西农业大学学报,2006,28(1):44 -49.
CHEN Guixin,XIE Wenlong,PAN Dongming,et al.Induction of embryonic calli from the young embryos of Nai[J].Acta Agric Univ Jiangxi,2006,28(1):44-49.
[13]曹昆,李霞.木本植物组织培养不定芽诱导研究进展[J].江苏林业科技,2008,35(5):43-48.
CAO Kun,LI Xia.Progress on induction of adventitious bud in tissue culture of woody plants[J].J Jiangsu For Sci Technol,2008,35(5):43-48.
[14]田国栋,张荷芃,康卓慧,等.桃叶片再生不定芽的研究[J].西北农林科技大学学报:自然科学版,2011,39(2):125-132.
TIAN Guodong,ZHANG Hepeng,KANG Zhuohui,et al.Study on shoot regeneration from leaf explants in peach[J].J Northwest A&F Univ Nat Sci Ed,2011,39(2):125-132.
[15]陈丽静,齐欣,王玉坤,等.北五味子快繁体系的建立[J].中草药,2011,42(3):575-577.
CHEN Lijing,QI Xin,WANG Yukun,et al.Rapid propagation ofSchisandra chinensis[J].Chin Tradit Herb Drug,2011,42(3):575-577.
Plantlet regeneration of Hemiboea subcapitata with subculturing
RUAN Huize1,LI Zhen2,REN Yanyan1,WU Xiaonan1,SHAO Yuhao1,PAN Feixiang1,XIA Guohua1
(1.School of Forestry and Biotechnology,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.Forest Resource Administration Station of Lin’an City,Lin’an 311300,Zhejiang,China)
For protection and exploitation of the medicinal plantHemiboea subcapitata,a rapid propagation system was established through tissue culture for large-scale seedling.Murashige and Skoog(MS)media with different combinations of plant growth regulator[6-benzylaminopurine(6-BA),α-naphthalene acetic acid(NAA)and indole-3-butyric acid(IBA)]ratios was used to optimize the tissue culture ofH.subcapitata,including callus induction,shoot proliferation,and rooting.Results showed that callus induction was difficult,but adventitious shoots could be differentiated directly from leaf explants subcultured in different combinations of growth regulators.The best medium for adventitious bud differentiation was MS+0.5 mg·L-16-BA+1.0 mg·L-1NAA+1.5 g·L-1AC with the bud induction frequency of 67.78%,the average number for each leaf explant was 3.90 buds,and the highest was 6.69 buds.The best medium for subculture proliferation was MS+ 0.5 mg·L-16-BA+0.5 mg·L-1NAA with a proliferation of 23.43 times.For all treatments and with different concentrations of IBA,the rooting ratio was more than 90%.This tissue culture technique and rapid propagation system ofH.subcapitatacould be used for large-scale seedling propagation in a short time and for technical guidance in large-scale production.[Ch,1 fig.3 tab.15 ref.]
botany;Hemiboea subcapitata;leaf explants;rapid propagation;tissue culture;plantlet regeneration
Q945.5;S718.3
A
2095-0756(2014)01-0162-05
10.11833/j.issn.2095-0756.2014.01.025
2013-03-22;
2013-06-21
国家级大学生创新创业训练计划项目(201210341023);浙江省大学生科技创新活动计划项目(2011R412005);浙江农林大学高等教育研究基金资助项目(GJYB201329)
阮慧泽,从事中药植物资源开发利用研究。E-mail:ruanhuize@sina.com。通信作者:夏国华,实验师,从事植物资源开发利用研究。E-mail:zjfc_ghxia@126.com
