春兰与大花蕙兰杂交后代根状茎增殖与分化条件
2014-04-25孙玉芬宁惠娟张韶伊褚怡范义荣
孙玉芬,宁惠娟,张韶伊,褚怡,范义荣
(浙江农林大学 风景园林与建筑学院,浙江 临安 311300)
春兰与大花蕙兰杂交后代根状茎增殖与分化条件
孙玉芬,宁惠娟,张韶伊,褚怡,范义荣
(浙江农林大学 风景园林与建筑学院,浙江 临安 311300)
为了筛选适合根状茎增殖分化的条件,以春兰Cymbidium goeringii与大花蕙兰Cymbidium hybridum杂交后代的根状茎为材料进行培养,比较了不同基本培养基、植物生长调节物质和有机添加物等对根状茎增殖与分化的影响。结果表明:1/2MS(Murashige and Skoog)培养基对杂交根状茎增殖与分化效果最适宜;2,4-二氯苯氧乙酸(2,4-D)和激动素(KT)对杂交组合春兰与大花蕙兰‘梦境’‘Wanderland’的根状茎分化作用不显著,1/2MS培养基添加1.0 mg·L-16-苄基腺嘌呤(6-BA)+1.0 mg·L-1萘乙酸(NAA)对春兰与大花蕙兰‘梦境’的杂交后代增殖分化效果最佳;使用有机添加物对根状茎增殖有显著影响,其中以椰汁增殖效果最好,其次为香蕉泥、土豆汁;添加100 g·L-1香蕉泥+ 50 mL·L-1椰汁最利于根状茎的增殖与分化。图1表4参16
园艺学;兰花;杂交后代;根状茎;增殖;分化
大花蕙兰Cymbidium hybridum属兰科Orchidaceae兰属Cymbidium多年生草本植物,是兰属内一些附生兰杂交种的统称,其大部分品种叶片长且披散,花无香味[1],花大、多而色艳,花期2-4月。国兰通常指兰属中的部分地生种,如春兰C.goeringii,墨兰C.sinense,寒兰C.kanran,春剑C.goeringiivar.longibracteatu和莲瓣兰C.lianpan等,花小、色淡,但芳香、叶态优美。利用兰属小花型地生兰与大花蕙兰杂交选育出的一类兰花品种,结合了国兰和大花蕙兰的优良性状,具有较高的观赏价值和市场前景。目前,兰科植物的育种仍以常规的育种手段为主,根据育种目标选择适宜的亲本进行杂交,然后进行播种,从杂交后代中选择符合目标性状的植株进行扩繁或继续进行杂交。国外对兰属附生兰种间杂交的研究已有上百年历史,培育出了数千个新品种,但对国兰与附生兰种间杂交的研究甚少,近年来国内研究也多集中在杂交育种和胚培养方面[2-7],增殖分化方面杂交兰仅有原球茎的报道[8-9],未见根状茎的报道。本研究的目的是对春兰与大花蕙兰杂交后代种子萌发所获得的根状茎在不同培养基上的增殖与分化条件进行研究,筛选出最适培养条件,为培育具香味、花大、株型好,能在春节前后开花的新品种提供技术基础。
1 材料和方法
1.1 试验材料
供试材料为2010年2月利用春兰‘黄水仙’C.goeringii‘Huangshuixian’与大花蕙兰2个品种‘梦境’C.hybridum‘Wanderland’和‘皇后’C.hybridum‘Princess Nobuko’进行杂交获杂交种子(分别标记为A1和A2组合),当年10月种子成熟后无菌播种,培养基为1/2MS(Murashige and Skoog)+30 g·L-1蔗糖+5 g·L-1琼脂+1 g·L-1活性炭,诱导形成的原球茎经继代培养4~5次,从中选取稳定生长且较一致的根状茎。
1.2 试验方法
1.2.1 不同基本培养基对根状茎增殖与分化的影响 A1和A2根状茎分别接在MS,1/2MS,Knudson C(KC),VW(Vacin and Went)和B5等5种培养基上(表1),培养基中附加有60.0 g·L-1香蕉泥、1.5 mg·L-16-苄基腺嘌呤(6-BA)和0.5 mg·L-1萘乙酸(NAA)。根状茎切成约7 mm,经称量后接种于培养基中,每个处理20条,重复3次。30 d后统计增殖结果,60 d后观察生长特征,统计出苗数。
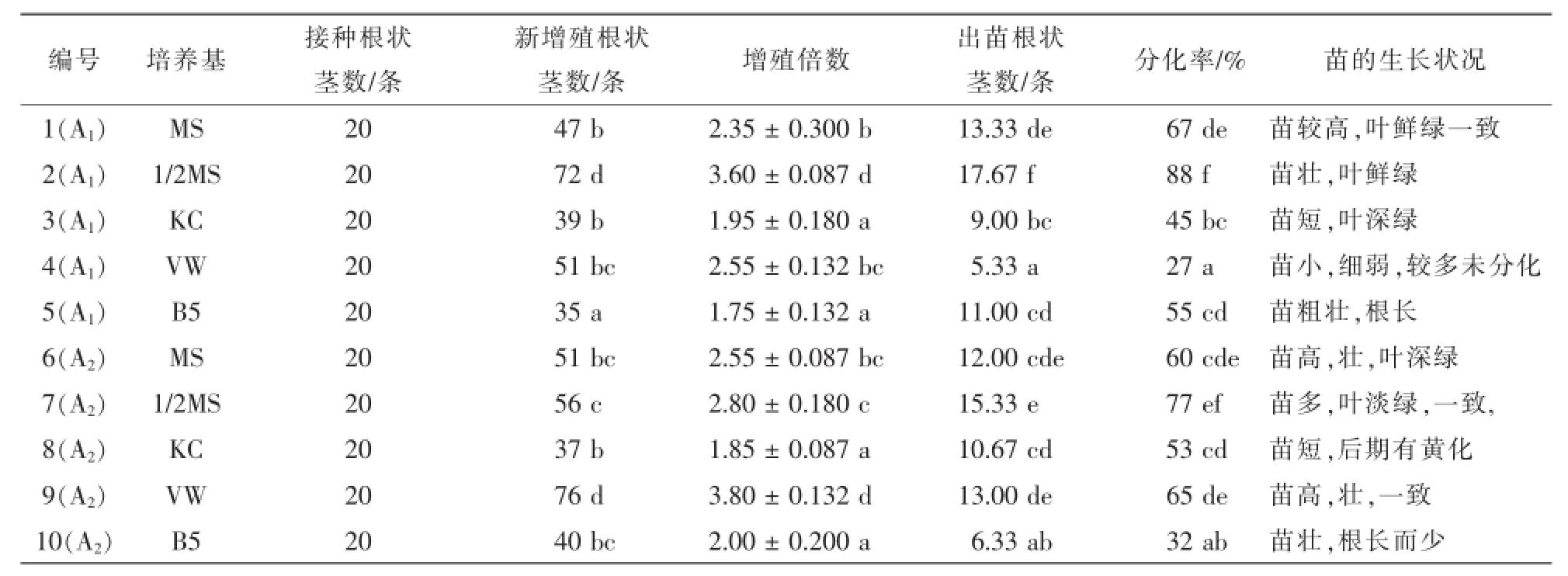
表1 不同基本培养基对根状茎增殖和分化的影响Table 1 Different culture medium on the influence of the proliferation and differentiation of rhizomes
1.2.2 不同生长素和细胞分裂素对根状茎增殖与分化的影响 以1/2MS为基本培养基,生长素选则萘乙酸(NAA),2,4-二氯苯氧乙酸(2,4-D),并与1.0 mg·L-16-BA进行组合;细胞分裂素选择激动素(KT)和6-BA,并与0.2 mg·L-1NAA进行组合,设置对照组,质量浓度设置见表2和表3,将A1根状茎接在培养基上,20条·处理-1,重复3次。30 d后统计增殖结果,60 d后观察生长特征,统计出苗数,计算分化率。
1.2.3 不同有机添加物对根状茎增殖与分化的影响 以1/2MS为基本培养基,附加有0.5 mg·L-1NAA,分别添加椰汁、香蕉泥和土豆汁作为不同处理,质量浓度设置见表4。其中香蕉、土豆均去皮后用榨汁机榨成匀浆备用。设置对照组,将A1根状茎接在培养基上,20条·处理-1,重复3次。40 d后统计增殖结果,60 d后统计出苗数,计算分化率。
1.2.4 生根壮苗 将根状茎诱导出的大于1 cm的不定芽小心地分开,接到生根培养基中。
1.3 培养条件
培养基中添加20.0 g·L-1蔗糖,6.0 g·L-1琼脂,1.0 g·L-1活性炭,pH 5.6~5.8,培养室温度(25±2)℃,光照14 h·d-1,光照强度2 000 lx。
1.4 数据分析
培养一段时间后统计新长出根状茎数,计算增殖倍数,增殖倍数=新长出根状茎数/接种根状茎数。60 d后统计根状茎的出苗数(苗以超过1.0 cm以上为标准),计算分化率,分化率=出芽根状茎数/接种根状茎总数×100%。结果采用SPSS 19.0统计软件分析,用邓肯氏新复极差测验法(Duncan)进行差异显著性分析。
2 结果与分析
2.1 不同杂交组合后代根状茎在不同基本培养基上增殖与分化的情况
在不同的基本培养基上分别接种A1和A2根状茎,根状茎在10 d后开始萌动,15 d左右外植体基部切口处出现许多白色颗粒状愈合组织,之后这些组织进一步发育生长,25 d开始出现小芽。培养30 d后根状茎的增殖结果见表1。由表1可知,基本培养基种类对杂交兰根状茎增殖分化影响较明显。总体看来,1/2MS对于根状茎增殖分化效果较好,1/2MS与MS相比较可知,过多的无机盐也不利于杂交根状茎的增殖和分化,KC和B5效果则较差。但是,A2根状茎在VW培养基上的增殖效果要好于1/ 2MS,且其在VW培养基上增殖分化效果要好于A1根状茎,这可能是由于杂交A1组合遗传了亲本大花蕙兰更多的特性。综合来看,1/2MS较适合杂交根状茎的增殖和分化生长。
2.2 不同生长素和细胞分裂素对根状茎增殖与分化的影响
在其他条件一致时,生长素NAA和2,4-D对根状茎增殖和分化均有影响,结果见表2。随着NAA质量浓度的升高,根状茎的增殖倍数也显著提高,并以1.0 mg·L-1最佳,培养30 d后达到4.00。NAA为0.1~2.0 mg·L-1时,对分化率进行方差分析。结果表明:各处理的出苗根状茎数和分化率差异显著,说明NAA及其不同质量浓度梯度对根状茎增殖分化的影响不同。观察到NAA为1.0和2.0 mg·L-1时形成较多丛生芽(图1)。在0.1~2.0 mg·L-1范围内,2,4-D对于根状茎增殖分化的影响差异不显著,培养60 d后观察到分化的小苗较NAA处理的短而粗壮。综合考虑,NAA促进增殖分化的效果优于2,4-D。以1.0 mg·L-16-BA+1.0 mg·L-1NAA增殖分化效果最佳。
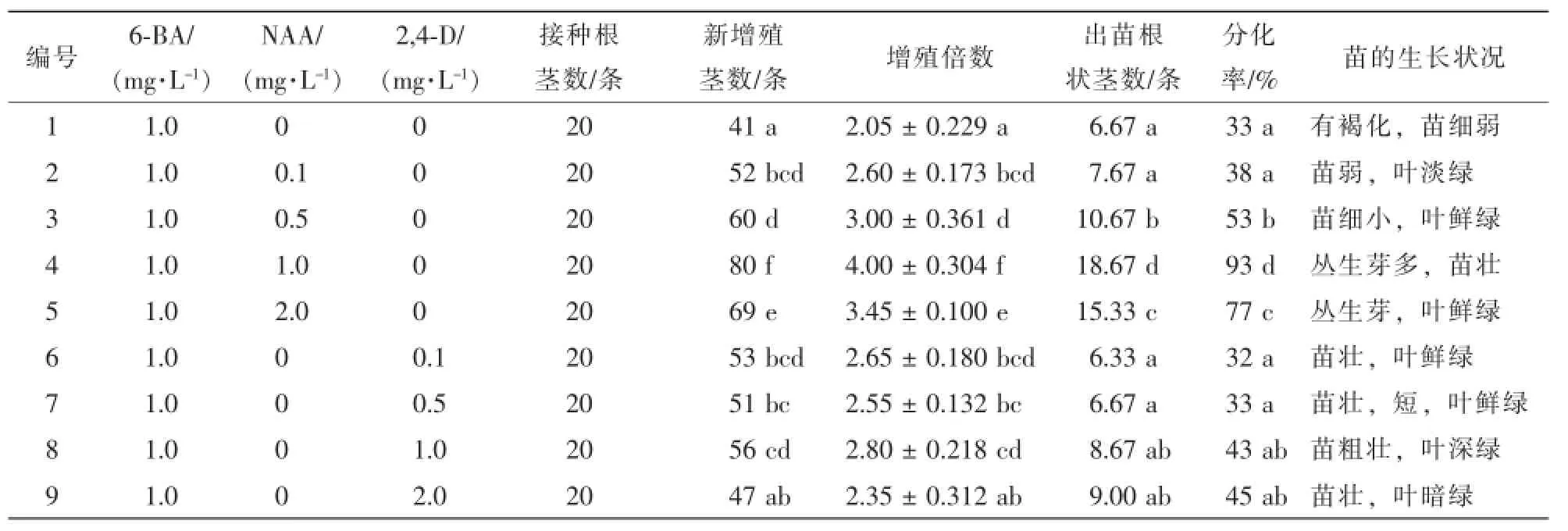
表2 NAA和2,4-D对根状茎增殖和分化的影响Table 2 Effect of NAA,2,4-D on the proliferation and differentiation of rhizomes
在其他条件一致时,比较细胞分裂素6-BA和KT对根状茎增殖分化的影响结果见表3。6-BA对根状茎增殖分化具有极显著的促进作用,6-BA质量浓度为2.0 mg·L-1时增殖倍数达3.90,根状茎为嫩绿色,生长快,质量浓度为0.5~4.0 mg·L-1时,分化率随着质量浓度升高而降低。当KT质量浓度为0.5~1.0 mg·L-1时,根状茎增殖较多,但多为嫩黄色,丛生芽状,生长较慢,质量浓度超过1.0 mg·L-1易导致根状茎玻璃化。由方差分析可见:KT对根状茎分化结果差异性不显著。综合考虑,0.2 mg·L-1NAA+ 2.0 mg·L-16-BA对根状茎的增殖分化效果最佳。比较表2和表3中的处理4,前者1.0 mg·L-16-BA+1.0 mg·L-1NAA增殖分化效果更好。

表3 6-BA和KT对根状茎增殖和分化的影响Table 3 Effect of 6-BA,KT on the proliferation and differentiation of rhizomes
2.3 不同有机添加物及其用量对根状茎增殖与分化的影响
在其他条件一致时,比较不同添加物处理对根状茎增殖和分化的影响,结果见表4。培养40 d后,单独添加3种有机物对杂交兰根状茎增殖均有促进作用,效果由大到小为椰汁>香蕉泥>土豆汁,随添加物用量的增加,根状茎增殖倍数下降。100.0 g·L-1香蕉泥和50.0 mL·L-1椰汁混合添加增殖效果最佳,优于所有有机物单独添加的效果。在幼苗分化方面,土豆汁处理中,分化率显著高于椰汁和香蕉泥处理,并在处理间存在显著性差异。椰汁和香蕉泥处理间在分化率方面无显著性差异。综合考虑,100.0 g·L-1香蕉泥+50.0 mL·L-1椰汁对根状茎的增殖分化效果最佳。
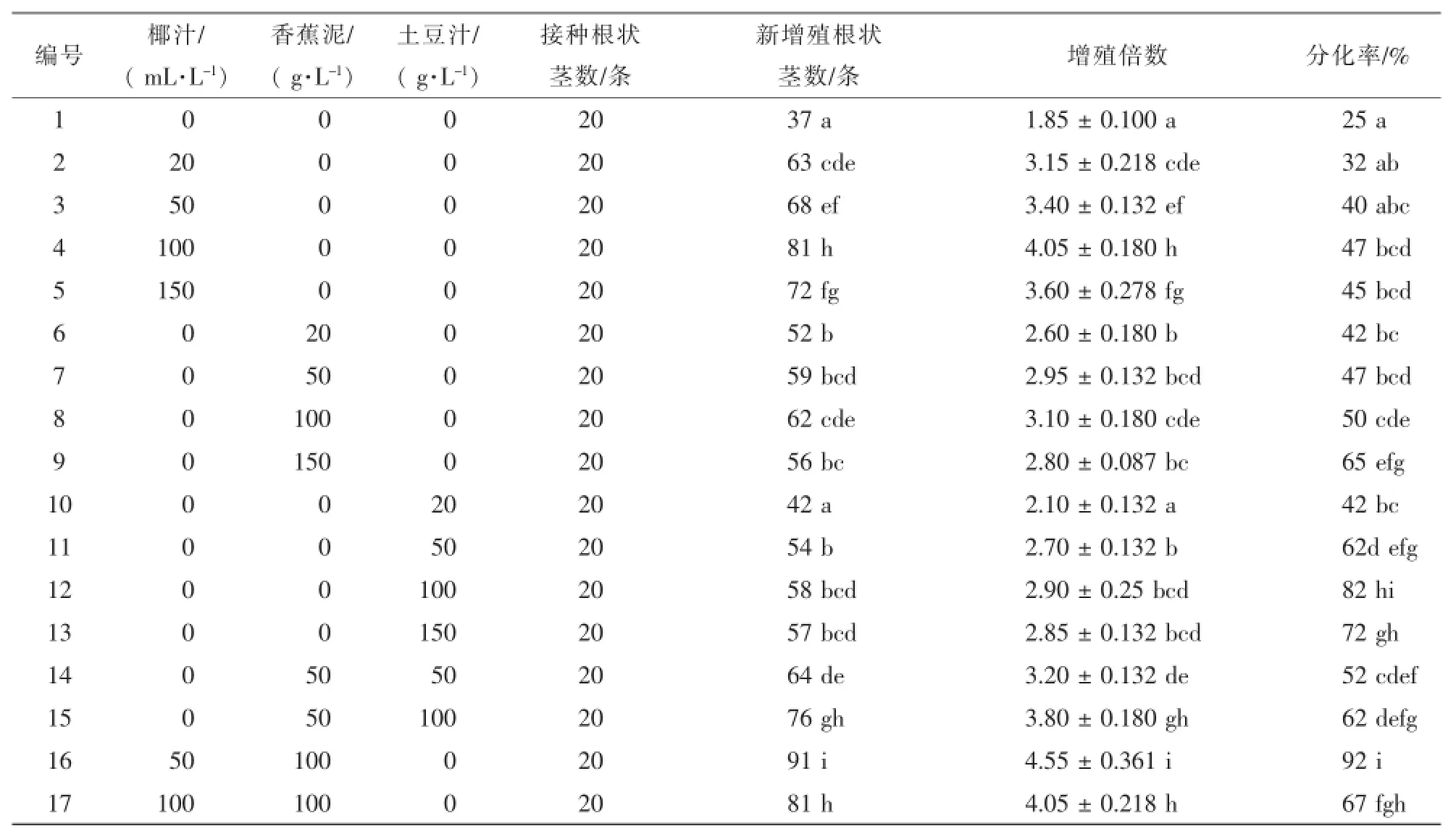
表4 有机添加物用量对根状茎增殖和分化的影响Table 4 Effect of organic additive concentration on the proliferation and differentiation of rhizomes

图1 根状茎增殖并出芽(A),根状茎分化成苗(B),形成的丛生芽(C)Figure 1 Rhizomes proliferation and budding(A),rhizomes differentiate into seedlings(B),clustered shoots(C)
2.4 壮苗生根
将分化出大于1 cm的不定芽接入生根培养基1/2MS+0.2 mg·L-1赤霉素(GA3)+1.0 mg·L-1NAA+25.0 g·L-1蔗糖+2.0 g·L-1活性炭中,培养至15 d时,无菌苗开始生根,生根率达95%以上,长出肉质根,待形成完整且较健壮植株时(约3个月)即可移栽。
3 结论
不同基本培养基对兰花杂交根状茎增殖分化效果不同,以1/2MS效果较适宜,这与王利民等[10]、孙芳等[11]报道的结果一致。生长素NAA增殖分化效果优于2,4-D,但是2,4-D有利于分化出较壮的小苗。这与朱根发等[1]报道的NAA对原球茎的增殖影响不大不同。6-BA对根状茎增殖分化具有极显著的促进作用,这与相关研究[1,12-13]结果相同,说明杂交兰在原球茎(根状茎)分化方面具有相似的特征。1.0 mg· L-16-BA+1.0 mg·L-1NAA对根状茎增殖和分化最适。KT对根状茎分化结果差异性不显著,与相关报道低质量浓度KT对原球茎增殖有明显促进作用[14-16]不同,可能是试验设计的质量浓度过高或者是由于所试品种和外植体的生长阶段不同。100 g·L-1香蕉泥+50 mL·L-1椰汁对根状茎的增殖分化效果优于分别单独使用香蕉泥、椰汁和土豆汁。组织培养中常用的有机添加物如椰乳、番茄汁、苹果汁和马铃薯等一些含有氨基酸、植物生长调节物质和酶等有机物且成分较为复杂的天然复合物,它们对细胞和组织的增殖和分化有明显的促进作用。王丰妍等[9]研究发现培养基中添加15 mL·L-1香蕉汁最有利于杂交兰原球茎的增殖。由于有机添加物的不同品种、不同产地和有效成分含量存在较大差异。
[1]朱根发,陈明莉,罗智伟,等.墨兰与大花蕙兰种间杂种原球茎的诱导及增殖研究[J].园艺学报,2004,31(5):688-690.
ZHU Genfa,CHEN Mingli,LUO Zhiwei,et al.Induction and propagation of hybrid protocorm like-body of crosses betweenCymbidium sinenseandCymbidium hybridium[J].Acta Hortic Sin,2004,31(5):688-690.
[2]郑立明.春兰与大花蕙兰种间杂交育种的试验[J].浙江教育学院学报,2010(3):61-65.
ZHENG Liming.Crossbreeding experiments betweenCymbidium goeringiiandCymbidium hybridium[J].J Zhejiang Educ Inst,2010(3):61-65.
[3]朱根发,王碧青,陈明莉,等.大花蕙兰与兰属植物种间杂交研究[J].植物学通报,2005,22(4):445-448.
ZHU Genfa,WANG Biqing,CHEN Mingli,et al.Study on hybridization amongCymbidiumspecies andCymbidium hybrid[J].Chin Bull Bot,2005,22(4):445-448.
[4]陈瑶瑶,张燕,张琛,等.杂交兰‘韩国桃花’×蕙兰种间杂交种子无菌萌发特征研究[J].园艺学报,2009,36(3):441-446.
CHEN Yaoyao,ZHANG Yan,ZHANG Chen,et al.A study on aseptic seed germination of interspecific hybrid betweenCymbidium hybrida×C.sinenseandC.faberi[J].Acta Hortic Sin,2009,36(3):441-446.
[5]周丽,胡春根.送春与多花兰杂种的非共生萌发与快速繁殖[J].北方园艺,2009(3):181-183.
ZHOU Li,HU Chungen.Asymbiotic germination and rapid propagation of hybrid ofCymbidium cyperifolimvar.szechuanicumandC.floribundum[J].Northern Hortic,2009(3):181-183.
[6]丁长春,夏念和.莲瓣兰与大花蕙兰‘黄金薄荷’种间杂种胚培养研究[J].西南农业学报,2011,24(4):1609 -1611.
DING Changchun,XIA Nianhe.Embryo culture of interspecific hybrid betweenCymbidium tortisepalumandC.‘Skymint Patty’[J].Southwest China J Agric Sci,2011,24(4):1609-1611.
[7]褚怡,范义荣,张韶伊,等.大花蕙兰与国兰花粉活力及柱头可授性分析[J].浙江农林大学学报,2013,30(6):950-954.
CHU Yi,FAN Yirong,ZHANG Shaoyi,et al.Pollen vitality and stigma receptivity ofCymbdium hybridumandChinese orchid[J].J Zhejiang A&F Univ,2013,30(6):950-954.
[8]梁芳,崔波,马杰,等.杂交兰原球茎增殖及分化研究[J].安徽农业科学,2008,36(13):5309-5310,5353.
LIANG Fang,CUI Bo,MA Jie,et al.Study on propagation and differentiation of PLB ofCymbidium hybridum×faberi[J].J Anhui Agri Sci,2008,36(13):5309-5310,5353.
[9]王丰妍,李承秀,王长宪,等.大花蕙兰与春剑杂交原球茎增殖及分化研究[J].中国农学通报,2009,25(23):327-330.
WANG Fengyan,LI Chengxiu,WANG Changxian,et al.Study on propagation and differentiation of PLB ofCymbidium hybridum×Cymbidium longibracteatum[J].Chin Agric Sci Bull,2009,25(23):327-330.
[10]王利民,王四清.大花蕙兰种子萌发的原球茎在不同培养基上的生长效应研究[J].种子,2006,25(12):8-11.
WANG Limin,WANG Siqing.The growth effect of protocorm-like body(PLB)germinated from seeds ofCymbidium hybridumon different medium[J].Seed,2006,25(12):8-11.
[11]孙芳,李承秀,张林,等.春兰名品杂交后代快繁与分化研究[J].中国农学通报,2012,28(10):189-193.
SUN Fang,LI Chengxiu,ZHANG Lin,Study on rapid propagation and differentiation of filial generation ofCymbidiumgoeringii[J].Chin Agric Sci Bull,2012,28(10):189-193.
[12]陈瑶瑶.杂交兰‘韩国桃花’蕙兰种间杂交种子无菌萌发特征及相关生理生化研究[D].南京:南京农业大学,2008.
CHEN Yaoyao.Aseptic Germination of Interspecific Hybridization Seeds and Its Physiological and Biochemical Characteristics of Cymbidium hybrida×C.sinense and C.faberi[D].Nanjing:Nanjing Agricultural University,2008.
[13]郑君爽,范义荣,宁惠娟,等.细胞分裂素对杂交兰原球茎生长的影响[J].江苏农业科学,2011,39(5):234-235.
ZHENG Junshuang,FAN Yirong,NING Huijuan,et al.The effects of cytokinin on the growth of protocorm-like body ofCymbidium hybridum×faberi[J].Jiangsu Agric Sci,2011,39(5):234-235.
[14]杨玉珍,孙天洲,孙廷,等.大花蕙兰组织培养和快速繁殖技术研究[J].北京林业大学学报,2002,24(2):86-88.
YANG Yuzhen,SUN Tianzhou,SUN Ting,et al.Tissue culture and rapid propagation techniques forCymbidium hybridum[J].J Beijing For Univ,2002,24(2):86-88.
[15]鲁迪.春剑和大花蕙兰种间杂交种子无菌萌发及杂交后代的RAPD分析[D].雅安:四川农业大学,2010.
LU Di.In vitro Germination Using Hybrid Seeds and RAPD Analysis from Cymbidium longibracteatum and C.hybridium[D].Ya’an:Sichuan Agricultural University,2010.
[16]徐大成,刘晓砚,曹伟,等.几种植物生长调节物质对大花蕙兰组培原球茎增殖的影响[J].植物研究,2004,24(1):76-79.
XU Dacheng,LIU Xiaoyan,CAO Wei,et al.Influence of several plant growth substance on propagation of GGB ofCymbidium grandiflorum[J].Bull Bot Res,2004,24(1):76-79.
Proliferation and differentiation of rhizomes from a filial generation of Cymbidium goeringii×Cymbidium hybridum
SUN Yufen,NING Huijuan,ZHANG Shaoyi,CHU Yi,FAN Yirong
(School of Landscape Architecture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
In order to sift out the optimum condition of proliferation and differentiation of rhizomes,using rhizomes from a filial generation ofCymbidium goeringii×C.hybridum,the effects of different basal medium[Murashige and Skoog(MS),1/2MS,Knudson C(KC),Vacin&Went(VW),B5],plant growth regulators[2,4-D,kinetin(KT),6-Benzylaminopurine(BA),and 1-Naphthalene acetic acid(NAA)]and organic additives(coconut milk,banana mud,and potato juice)on the proliferation and differentiation of rhizomes were compared.Results showed that 1/2MS was the optimal medium for proliferation of rhizomes.For differentiation ofC.goeringii×C.hybridum‘Wanderland’,2,4-D and KT had little effect;whereas 1/2MS supplemented with 1.0 mg·L-16-BA and 1.0 mg·L-1NAA was the best combination for proliferation and differentiation.The organic additive coconut milk had the strongest influence on proliferation of rhizomes,followed by favorable proliferation and differentiation with 100 g·L-1banana mud and 50 mL·L-1potato juice.[Ch,1 fig,4 tab.16 ref.]
horticulture;orchid;filial generation;rhizomes;proliferation;differentiation
S682.31
A
2095-0756(2014)01-0156-06
10.11833/j.issn.2095-0756.2014.01.024
2013-01-15;
2013-04-18
浙江省花卉新品种选育重大科技专项重点资助项目(2012C12909-11);浙江省重大科技专项(2009C12087);浙江省重点科技创新团队子项目(2009R50034-10)
孙玉芬,从事园林植物良种繁育研究。E-mail:sunnay1122@126.com。通信作者:宁惠娟,讲师,博士研究生,从事园林植物良种选育等研究。E-mail:ninghuijuan@21cn.com
