两种生产用米曲霉的形状及蛋白酶性质研究
2014-04-24曾小波朱新贵
曾小波,刘 滢,朱新贵,李 理*
(1.李锦记(新会)食品有限公司,广东 江门 529156;2.华南理工大学轻工与食品学院,广东 广州 510640)
酱油酿造过程中,菌种的作用至关重要。目前国内大多数酱油生产厂家所用的菌种为沪酿3.042及从该菌种诱变筛选而来的菌种。沪酿3.042具有生长快、蛋白酶活力较高、产孢子量大、抗杂菌等优点,但其蛋白酶活力仍然不够高,且以中性和碱性蛋白酶为主,酸性蛋白性较弱,导致蛋白质利用率保持在75%左右的水平。而日式酱油,由于其菌种技术的发展,其蛋白质利用率已达到92%的水平[1]。因此菌种的选育和研究对酱油生产企业有极其重要的作用。
本企业在长期的生产实践过程中,从最初的米曲霉3.042中不断地诱变筛选,获得了两个各具优点、性状不同的菌株。为了对这两株菌种有系统的认识,从而为生产控制提供数据支持,并为进一步筛选优良菌种提供理论依据,研究比较了2株米曲霉的基本性状,同时分析了成曲粗酶液中蛋白酶的酶学性质,研究结果可用于企业生产。
1 材料与方法
1.1 主要材料
米曲霉1号、米曲霉2号:生产用种,从沪酿3.042米曲霉中筛选获得。
种曲、成曲:李锦记(新会)食品有限公司车间提供。
察氏培养基:购于广东环凯微生物科技有限公司。
双层酪蛋白培养基:底层:琼脂粉15g,加蒸馏水1 000mL,煮沸溶解后于121℃灭菌20min,每个平皿加约8mL;上层:Na2HPO4·12H2O 1.07g,KH2PO40.36g,BaCl25.0g,酪蛋白4.0g,琼脂15g,蒸馏水1 000mL。配制时,酪蛋白先用20mL溶解,再与900mL水及除BaCl2外的其他药品混合。BaCl2则用100mL水单独溶解,各自在121℃灭菌20min,使用前混合。上层培养基每个平皿定量8mL。
豆汁培养基:5°Bé豆汁1 000mL,硫酸镁0.5g,可溶性淀粉20g,磷酸二氢钾1g,硫酸铵0.5g,琼脂20g,pH6.0,121℃灭菌20min。
1.2 仪器与设备
XSP-8C光学显微镜:上海绘统光学仪器厂;UV-1100可见分光光度仪:北京莱博泰科仪器有限公司;SL1545恒温培养箱:东南化学仪器有限公司;0~200mm游标卡尺:中国机械进出口公司。
1.3 试验方法
1.3.1 菌落形态观察
察氏培养基和豆汁培养基倒平板后,将孢子稀释涂布于平板,倒置于培养箱中31℃培养,每隔一段时间观察菌落形态,并测定菌落的直径。
1.3.2 显微镜观察
载玻片培养观察法:将察氏培养基灭菌后冷却至45℃左右,接入适量米曲霉孢子,摇匀后,迅速取培养基于无菌载玻片上,盖上盖玻片,将载玻片放入无菌平皿中,然后置于30℃恒温培养箱中培养,每隔一段时间将载玻片取出,在显微镜下观察菌丝生长情况[2]。
1.3.3 产酶能力
将双层酪蛋白培养基倒入平皿后,将稀释后的孢子涂布于平皿,倒置于培养箱中培养,每隔一段时间测定菌落直径d1和透明圈直径d2,计算K值(K=d2/d1)。
1.3.4 酶学性质研究
最适酶促反应温度:在pH7.2,不同温度条件下(温度分别为35℃、40℃、45℃、50℃、55℃、60℃)测定蛋白酶活力。
最适酶促反应pH:配制不同pH值的磷酸盐缓冲液和乳酸盐缓冲液。在40℃,不同pH条件下(pH值为3、4、5、6、7、8、9、10)测定蛋白酶活力。
不同盐含量条件下的粗酶蛋白酶活力:在40℃,pH7.2的条件下,测定粗酶酶液在不同盐含量条件下(盐含量分别为0、5%、10%、15%、20%、25%)的蛋白酶活力。
1.3.5 测定方法
样品处理:将待测样品混合均匀,称取10g样品于研钵内,先加入蒸馏水20mL,静止浸泡10min,然后小心将每颗成曲表皮磨下,倒入250mL三角瓶内,加入蒸馏水使三角瓶内样品加水的质量共100g,摇匀,置于40℃水浴间断振摇1h,取出摇匀后过滤,此滤液用缓冲液稀释5倍,即制得稀释50倍的提取液,备用。
采用福林法蛋白酶活力测定,按SB/T 10317—1999《蛋白酶活力测定法》进行测定,在40℃、pH7.2条件下每分钟水解酪蛋白产生1μg酪氨酸,定义为一个蛋白酶活力单位。淀粉酶活力测定参考3,5-二硝基水杨酸法[3]测定,在40℃条件下每分钟水解淀粉产生1mg麦芽糖,定义为一个淀粉酶活力单位。果胶酶活力测定采用3,5-二硝基水杨酸法[4]测定,1mL酶液在50℃、pH3.5的条件下,1h分解果胶产生1mg半乳糖醛酸为一个酶活力单位。
2 试验结果与分析
2.1 形态特征
2.1.1 菌落形态
将两株米曲霉分别稀释一定倍数涂布在察氏平板和豆汁平板上,置于31℃培养3~5d。米曲霉的菌落形态描述见表1。

表1 两株米曲霉的菌落形态比较Table 1 Colony morphology of two strains of A.oryzae
由表1可知,两株米曲霉的菌落在颜色以及形态上均有差异。
将两株米曲霉孢子稀释到一定倍数后分别涂布在豆汁平板培养基上,置于不同的温度条件下培养,每天观察米曲霉生长情况,并测定菌落直径,结果见表2。
由表2可知,在同一时间,米曲霉1号的菌落都比米曲霉2号的菌落大,由此可以推出米曲霉1号比米曲霉2号生长得快。由表2还可以得知,两株米曲霉均在31℃、36℃时生长速度较快,温度过高(41℃)时,米曲霉不生长,而温度较低时(26℃),米曲霉生长缓慢。
2.1.2 细胞形态
利用载玻片培养法观察米曲霉不同生长阶段的显微形态,结果见表3。
由表3可知,米曲霉的生长大致可分3个阶段:孢子发芽期、菌丝生长期和产孢子期。两株米曲霉的孢子均近似圆形,顶囊呈烧瓶形,小梗单层,孢子穂呈扫帚形或半球形。两者的区别是:米曲霉1号发芽较米曲霉2号快,产孢子也较早,这与2.1.1得到的结果相符。此外,米曲霉1号的孢子呈线状排列,延伸较长,表现为成曲时孢子较多,而米曲霉2号的孢子囊成簇拥状,孢子较少。

表2 不同温度下两株米曲霉的生长情况比较Table 2 Growth states of two strains of A.oryzae under different temperature conditions

表3 米曲霉不同生长阶段的细胞形态Table 3 Cell morphology in different growth stages of two strains of A.oryzae
2.1.3 种曲形态
两株米曲霉制成的种曲见图1。
观察种曲形态(图1)可知,米曲霉1号种曲呈黄绿色(偏黄),菌丝较短,结块较少,孢子多;米曲霉2号种曲呈黄绿色(偏绿),菌丝较长,易结块,孢子多。
2.1.4 成曲形态
两株米曲霉制成的黄豆成曲见图2。
观察成曲形态(图2)可知,米曲霉1号成曲黄绿色,孢子较多,菌丝较短;而米曲霉2号菌丝较长,孢子较1号少,颜色比1号白。

图1 两株米曲霉的种曲形态Fig.1 Koji morphology of two strains of A.oryzae

图2 两株米曲霉的成曲形态Fig.2 Mature koji morphology of two strains of A.oryzae
2.2 平皿产酶能力的对比
两株米曲霉在双层酪蛋白培养基中培养48h、60h、72h、84h时,分别测定菌落直径d1及透明圈直径d2,并计算菌种的K值(K=d2/d1),结果见表4。
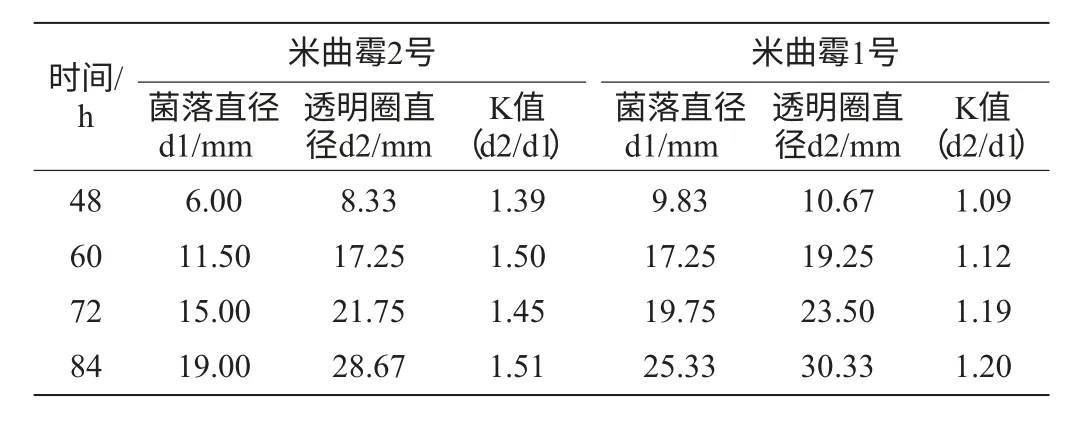
表4 两株米曲霉在酪蛋白平板上K值的比较Table 4 K values of two strains of A.oryzae in casein plate
由表4可知,米曲霉2号的菌落直径远小于米曲霉1号,但其K值明显大于米曲霉1号。根据文献[5-6],K值和菌落直径的大小共同决定了米曲霉蛋白酶活力的高低,当菌落直径相近时,K值大的产蛋白酶活力高;而当K值相近时,菌落大的产蛋白酶活力高,但哪个因素对蛋白酶活力影响更大并未提及。张玉涛等[7]对多株米曲霉的菌落直径(D)和K值对蛋白酶活(U)的影响进行回归分析,得出这样一个关系:U=1.30K+0.032D-1.26。这个公式在一定程度上说明了K值对蛋白酶活力影响更大。根据实验测定及生产数据,发现米曲霉2号的蛋白酶活力始终大于米曲霉1号,这进一步说明K值对蛋白酶活的影响更大。因此,在利用酪蛋白平板对菌种进行初筛时,应首先考虑K值大小,其次再考虑菌落大小。
2.3 不同酶的活力比较
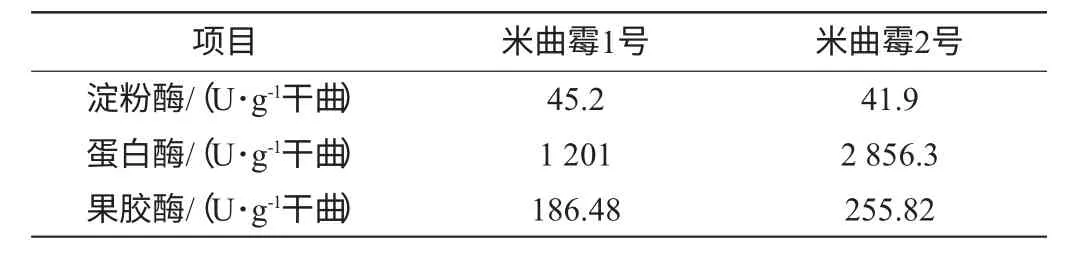
表5 两株米曲霉不同酶的活力比较Table 5 Different enzyme activity of two strains of A.oryzae
由表5可知,曲培养44h后,两株米曲霉的淀粉酶酶活力差异较小,米曲霉2号要稍低于米曲霉1号,而果胶酶和蛋白酶活力则是米曲霉2号高于米曲霉1号,其中蛋白酶活力要远远高于米曲霉1号。这说明,在酶活力方面,米曲霉2号更有优势。
2.4 成曲蛋白酶性质对比
2.4.1 两株米曲霉产酶活力的周期
在制成曲时,开始0~20h不取样,在20h、24h、28h、32h、36h、40h、44h、48h、52h时抽样检测中性蛋白酶活力,作出不同时间的酶活力关系曲线,找出最高中性蛋白酶酶活力的大致时间段,结果见图3。
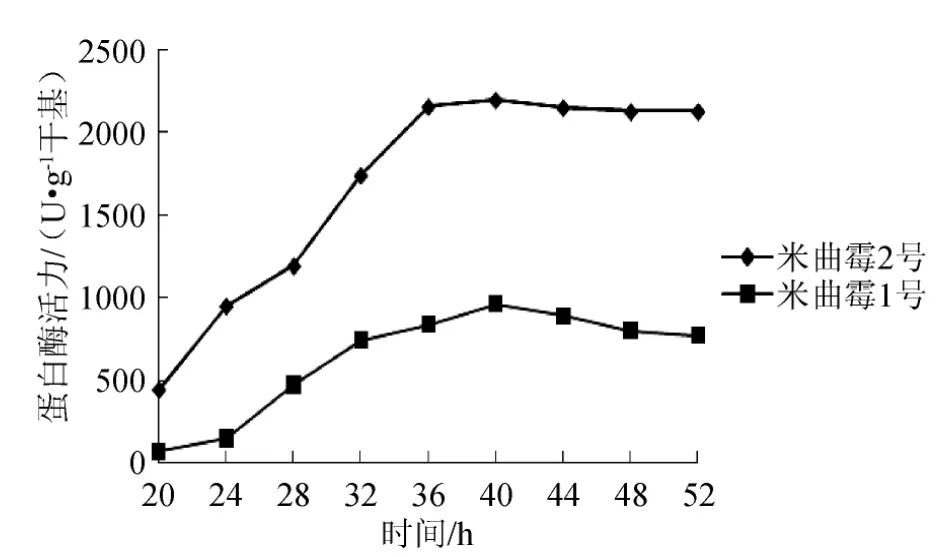
图3 成曲制作过程中的蛋白酶活力变化Fig.3 Variation of protease activity in the process of mature koji production
由图3可知,随着培养时间的延长,成曲的蛋白酶活力呈逐渐上升的趋势,到达一定值后趋于稳定或略微下降。米曲霉1号和2号的成曲均在培养40h左右,蛋白酶活力达到最大值,但米曲霉2号的最大酶活力远远高于米曲霉1号。
2.4.2 不同pH条件下成曲蛋白酶活力的曲线
配制pH3~10的磷酸盐缓冲液或乳酸盐缓冲液。按照福林法步骤测定酶活力,结果见图4。
从图4可知,米曲霉2号明显比1号的蛋白酶活力高。在pH3~7的区间,米曲霉2号的酶活力上升较明显,在pH7左右有一个酶活力峰,而后开始缓慢下降,至pH9时有最高酶活力峰,说明米曲霉2号成曲蛋白酶多为碱性蛋白酶。而米曲霉1号在大约pH6的时候有最高峰,pH9时也有一个酶活力峰,但较pH6低,说明米曲霉1号菌的最适反应pH值为6,其碱性蛋白酶相对较弱。以上说明这两个菌株是米曲霉的不同菌株,两个菌株在蛋白酶活力的最高峰值的pH值不同,且蛋白酶活力的值相差较大。与前期观察结果相符合。

图4 成曲不同pH条件下测定的蛋白酶活力Fig.4 Protease activity of mature koji under different pH conditions
2.4.3 不同温度条件下成曲蛋白酶活力的曲线
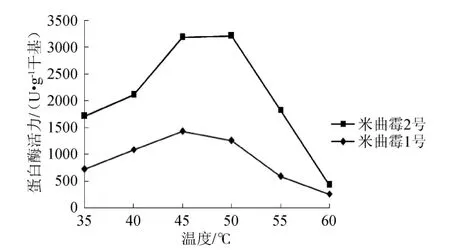
图5 成曲在不同温度下测定的蛋白酶活力Fig.5 Protease activity of mature koji under different temperature
由图5可知,在35~60℃之间,随着温度的升高,两株米曲霉的成曲蛋白酶活力均先升高后降低,但米曲霉1号的最适酶促反应温度为45℃,米曲霉2号的最适酶促反应温度为50℃,且2号的酶活远高于1号。
2.4.4 成曲蛋白酶的耐盐曲线

图6 成曲在不同氯化钠浓度下测定的蛋白酶活力Fig.6 Protease activity of mature koji under different sodium chloride concentration
由图6可知,随着盐分含量的增高,两株米曲霉的成曲蛋白酶活力均逐渐降低,在20%氯化钠条件下,蛋白酶活力均降至无盐条件下的20%~30%。但米曲霉2号的蛋白酶活力在不同的盐分含量下始终是米曲霉1号的2倍多。
3 结论
由米曲霉形态特征及蛋白酶性质等方面的比较可知,2株米曲霉是不同的菌株,有着明显的差异。米曲霉1号菌落较大、发芽和产孢子较快,种曲及成曲颜色偏黄,菌丝较短,孢子较多;而米曲霉2号菌落较小,孢子发芽时间及产孢子时间比1号晚,成曲孢子较1号少,但菌丝长且粗壮,种曲颜色偏绿,成曲颜色偏白。米曲霉2号的产酶能力强。
蛋白酶性质的研究结果显示,成曲的蛋白酶性质有差异,1号和2号的最适反应温度分别为45℃和50℃,最适反应pH分别为6.0和9.0。在生产应用过程中,两菌株各有优缺点,其生产性能同其形态和酶学性质等有密切的相关性,因此对两株菌种的基本性状及酶的研究对企业生产极为重要。
本研究仅从基本的微生物形态和酶活力等方面进行实验,在分子生物学、基因层面还有待进一步研究。
[1]徐德峰,赵谋明.中国酱油菌株AS3.951 的改良现状与思考[J].中国调味品,2009(5):32-38.
[2]朱佳珍,王超碧,梁惠芳.食品微生物学[M].北京:中国轻工业出版社,1998.
[3]武金霞,朱秀燕,张贺迎.酱油成曲淀粉酶组分的鉴定及单组分的分离纯化[J].中国调味品,2010,35(8):47-50.
[4]王天龙,仇宏伟,陈海华,等.3,5-二硝基水杨酸法测定果胶酶活力的条件研究[J].食品与机械,2008,24(3):96-99.
[5]党敏娜,吕东津,傅 亮,等.一种酱油菌种筛选的方法[J].中国调味品,2004(9):16-17.
[6]刘达玉,段献银,黄 丹,等.高盐稀态酱油专用米曲霉的紫外诱变选育[J].西南大学学报:自然科学版,2013,35(2):155-159.
[7]张玉涛,许学书,王 宏.米曲霉固体发酵过程中的动力学[J].无锡轻工大学学报,2003,22(4):41-44.
[8]王夫杰,鲁 绯.我国酱油研究现状与发展趋势[J].中国酿造,2010,29(10):3-7.
[9]王 栋,冯 杰,郑志永,等.酱油发酵用2 种米曲霉中性蛋白酶的酶学性质比较[J].食品与生物技术学报,2012,31(5):479-485.
[10]黄持都,鲁 绯,纪凤娣,等.酱油研究进展[J].中国酿造,2009,28(10):7-10.
[11]于艳颖,董海莉,平文祥,等.米曲霉HDF-7 蛋白酶的分离纯化及酶学性质研究[J].黑龙江大学工程学报,2011,2(5):74-79.
[12]包启安.酱油科学与酿造技术[M].北京:中国轻工业出版社,2011.
[13]欧阳平凯,曹竹安,马宏建,等.发酵工程关键技术及其应用[M].北京:化学工业出版社,2005.
[14]NAKADAI T,NASUNO S.Use of glutaminase for soy sauce made by Koji or a preparation of proteases fromAspergillus oryzae[J].J Ferment Bioeng,1989,67(3):158-162.
[15]鲁梅芳,黒婷婷,曹小红,等.曲种纤维素酶活力与酱油成分相关性的研究[J].中国酿造,2009,28(9):55-60.
