多不饱和脂肪酸对大鼠大脑细胞膜脂肪酸组成的影响
2014-04-24郑冬冬王丽梅刘烈炬
岳 崟,叶 诚,郑冬冬,王丽梅 *,刘烈炬
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.湖北出入境检验检疫局检验检疫技术中心,湖北 武汉 430050)
脂肪酸是构成生物体的基本成分,也是机体必需的营养物质。脑组织的重要成分是脂肪酸,占大脑干质量的10%以上[1],其含量和密度与大脑的生长发育功能密切相关[2]。多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)也是组成大脑的重要成分,其在大脑中的含量以及其中n-3、n-6的比例对大脑学习记忆功能有很大影响[3-7];PUFAs也是细胞膜的重要组成成分,解剖学的研究曾证明PUFAs对维持神经细胞膜的结构、细胞膜的流动性、神经突触的正常结构以及突触可塑性起了重要的作用[8-10],但PUFAs发挥生理功能的机制尚未明确,并且研究大脑细胞膜中脂肪酸种类与含量的报道较少,也主要集中于研究一种脂肪酸的作用。因此研究摄入不同类型的PUFAs对大鼠大脑细胞膜脂肪酸的组成与含量的影响,有利于阐明不同家族的PUFAs发挥生理功效的可能原因(是否与影响大脑细胞膜脂肪酸的成分与含量有关),也有利于进一步研究PUFAs发挥作用的可能机制。该实验研究不同类型PUFAs对细胞膜中脂肪酸种类与含量的影响,为深入研究PUFAs的生理功能提供参考。
1 材料与方法
1.1 材料与试剂
清洁级SD雄性大鼠56只,初断乳,体质量(85±10)g,购于华中科技大学同济医学院,动物许可证号SCXK2010-0009。
普通饲料(配方:玉米45%、三等粉25%、麸皮10%、鱼粉5%、豆粕10%、骨粉4%、盐0.5%、多维0.2%),购自华中科技大学同济医学院实验动物部;特殊饲料(扣除不饱和脂肪酸的饲料,配方:玉米18%、鱼粉4%、麸皮12%、面粉33%、豆粕31.5%、骨粉1%、盐0.5%),购自湖北省实验动物研究中心。
鱼油:湖北福星生物科技有限公司;紫苏油:湖北李时珍保健油有限责任公司;核桃油:湖北李时珍保健油有限责任公司;红花油:新疆塔城红花缘科技有限公司;α-亚油酸:郑州众信化工有限公司;羧甲基纤维素钠:连云港友进食品添加剂有限公司;Tris-HCl 0.05mol/L;NaOH-CH3OH 0.15mol/L;正己烷(分析纯):天津市天力有限公司。
1.2 仪器与设备
WH-1微型漩涡混合仪:上海沪西分析仪器厂有限公司;5mL手动玻璃匀浆器:宁波新芝科器研究所;TGL-16M型高速离心机:长沙平凡仪器仪表有限公司;KQ2200V超声波破碎仪:昆山市超声仪器有限公司;PL402-L分析天平:梅特勒-托利多仪器有限公司;DHG-9145A干燥箱:上海一恒科学仪器有限公司;Agilent 7890 GC/5975C气相色谱质谱联用仪:美国Agilent公司;HH-6数显恒温水浴锅:国华电器有限公司。
1.3 方法
1.3.1 动物分组与喂养
56只初断乳雄性SD大鼠置于标准动物房饲养,适应一周后,随机分成阴性组;必需脂肪酸(essential fatty acids,EFA)缺乏组;n-3PUFAs组(鱼油组[300mg/(kg·d)]、紫苏组[2.45mL/(kg·d)];n-6PUFAs组(α-亚油酸组[1.32g/(kg·d)];核桃组[2.45mL/(kg·d)];红花组[1.65g/(kg·d)]。此剂量参照郭艳芬等[11]的研究,根据大鼠体质量给油(每3d称质量1次)。阴性组饲喂普通饲料,EFA缺乏组饲喂特殊饲料,2组均灌胃相应剂量5‰的羧甲基纤维素(carboxymethyl cellulose,CMC)溶液,连续灌胃给油8周。
1.3.2 大脑组织总细胞膜的提取与甲酯化
大鼠禁食12h后,1.2g/kg乌拉坦麻醉(现配),断头处死,迅速于冰上剥离大脑组织,预冷生理盐水漂洗并剔除血液与结缔组织。然后转移至匀浆器,加入Tris-HCl溶液,研磨;匀浆后,于4℃、3 000r/min离心20min;弃上清液,Tris-HCl重悬沉淀,4℃超声破膜30min,将破膜细胞悬液于4℃、3 000r/min离心20min;去沉淀,上清液4℃、10 000r/min离心20min,弃上清,留沉淀,并重复上述步骤1次,得沉淀即为细胞膜。
甲酯化方法参照国际油脂中心发布的最新分析方法[12],取5mL的正己烷加入1.0g的细胞膜中,充分振荡10min,使其充分溶解,然后加入0.15mol/L的NaOH-CH3OH溶液2mL,振荡摇匀于50℃水浴锅中甲酯化30min,完全甲酯化后用于进样;鱼油标准品的甲酯化方法同上。
1.3.3 气相色谱-质谱分析
色谱条件:色谱柱为DB-WAXETR(30m×0.25mm×0.25μm);采用程序升温法:起始温度为140℃,保持2min,然后以10℃/min 升至160℃后保持3min,最后以2℃/min的速度升温至240℃,保持3min。载气为N2(99.999%),氢气流量为2 mL/min,分流比为50∶1,前进样口温度250℃,检测器温度280℃。质谱电离条件:70eV,扫描分子量:50~450amu。谱库:Wiley/NBS,NIST。
1.3.4 统计学方法
实验结果用“x±s”表示,使用SPSS19.0对数据进行分析,多组间比较,用ANVON方法分析,组间比较,用T检验分析,并且认为P<0.05有统计学意义,P<0.01有显著性差异。
2 结果与分析
2.1 各组细胞膜脂肪酸的组成
该实验条件下,各组大鼠大脑细胞膜脂肪酸得到完全分离,各组均检测到:C12:0、C14:0、C15:0、C16:0、C18:0、C16:1、C17:1、C18:1、C16:2、C16:3、C18:3、C20:3、C16:4、C20:4、C20:5、C22:5、C22:6,各组大鼠细胞膜中脂肪酸的种类无差别。
2.2 各组细胞膜脂肪酸的相对百分含量
使用峰面积归一法,测得各组大鼠细胞膜脂肪酸的相对百分含量,详见表1。与阴性组和EFA缺乏组相比,其余各组均能显著提高C20:3(P<0.05和P<0.01)的含量,显著减少C16:1(P<0.01)的含量;与阴性组相比,除α-亚油酸组外,其余各组均能显著提高C18:0、C18:1、C22:5(P<0.01)减少C12:0、C14:0、C15:0、C16:2、C18:3、C16:4的含量,而与EFA缺乏组相比,以上脂肪酸除阴性组以外,其余组均有显著性差异(P<0.05和P<0.01);与阴性组和EFA缺乏组相比,鱼油组与红花组能显著提高C22:6、C20:4的含量(P<0.05和P<0.01);与阴性组和EFA缺乏组相比,红花组、紫苏组、核桃组能显著提高C20:5的含量(P<0.05和P<0.01);只有鱼油组检测到C20:0;EFA缺乏组与阴性组比较,没有显著性差异,无统计学意义。
其中值得关注的是C22:6二十二碳六烯酸(docosa hexaenoic acid,DHA)、C20:5二十碳五烯酸(eicosapentaenoic acid,EPA)、C20:4花生四烯酸(arachidonic acid,AA)、C18:3亚麻酸(α-linolenic acid,ALA)。由表2可以看出,只有鱼油组与红花组大鼠大脑膜DHA的含量相比阴性组与EFA缺乏组显著提高(P<0.05和P<0.01),而其余组无显著性差异,若鱼油组与红花组相比,鱼油组DHA的含量比红花组含量显著增高(P<0.01);在EPA的比较中,紫苏组、核桃组、红花组比阴性组与EFA缺乏组的含量显著增高(P<0.05和P<0.01),但是这两组的EPA含量之间相比,无显著性差异;在AA的比较中,只有鱼油组与红花组的含量较阴性组有显著性差异(P<0.05),鱼油组含量较EFA缺乏组具有显著性差异(P<0.01),鱼油组与红花组相比具有显著性差异(P<0.01);在ALA的含量比较中,除了α-亚油酸组外,其余各组较阴性组与EFA缺乏组均具有显著性差异(P<0.01)。
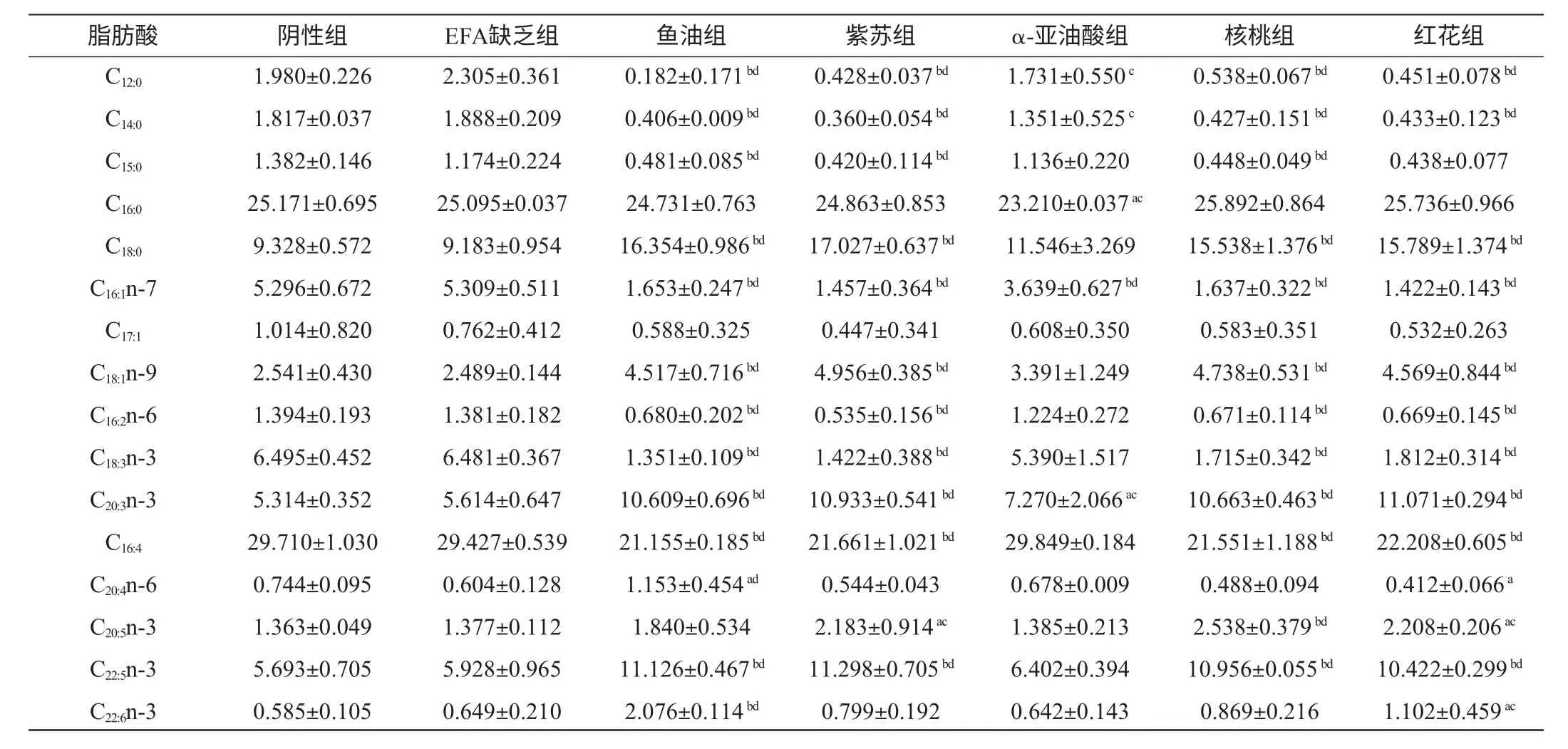
表1 不同油脂对大鼠大脑细胞膜脂肪酸相对含量的影响Table 1 Effect of different oils on the relative content of fatty acids in cerebral cytomembrane of rats
2.3 各组细胞膜不同类型脂肪酸的比较
根据表1的统计结果,将每组脂肪酸进行分类,分析不同类型的PUFAs对细胞膜不同类型脂肪酸的影响,见表2。与阴性组和EFA缺乏组相比,紫苏组、核桃组与红花组均能显著提高细胞膜中饱和脂肪酸的总含量,显著减少n-6PUFAs与单不饱和脂肪酸的含量(P<0.05和P<0.01),而紫苏组与核桃组单不饱和脂肪酸总量只有和阴性组比较具有显著性差异(P<0.05);鱼油组、红花组、紫苏组与核桃组能显著提高细胞膜中n-3PUFAs的总含量(P<0.01);与阴性对照组相比,鱼油组、核桃组与红花组能显著提高DHA/AA的比值,而与EFA缺乏组比较,只有鱼油组与红花组能提高其比值;与阴性组和EFA缺乏组相比,鱼油组、紫苏组、核桃组与红花组均能显著提高细胞膜n-3PUFAs/n-6PUFA的比值,各组PUFAs的总量与MUFA/PUFA的比值无显著性差异。

表2 大鼠大脑细胞膜脂肪酸的分类比较Table 2 Comparison of different fatty acids in cerebral cytomembrane of rats
3 讨论
细胞膜是细胞与周围环境联系的纽带,脂肪酸是构成生物膜的重要成分[13],具有重要的生理功能,与细胞识别、免疫以及种族特异性相关[14],其中发挥重要功能的有PUFAs,有研究证明PUFAs在大脑的组成与含量与阿尔茨海默病的发病率有关[15],其中非常重要的就是n-3PUFAs的DHA,有动物实验证明,摄入DHA可以增加DHA在脑内的含量[13,16],从而调节大脑发挥生理功能;α-亚麻酸是极其重要的PUFAs,是n-3PUFAs的前体,对中枢神经系统起着极其重要的作用[17,18];AA和α-亚油酸也是极其重要n-6PUFAs,α-亚油酸是AA的前体,其与大脑的细胞膜、结构以及功能都密切相关[19]。因此讨论不同的PUFAs在大脑细胞膜的含量意义重大。
由实验结果可以看出,PUFAs对大脑总细胞膜脂肪酸的类别无影响,说明补充不同类别的PUFAs,不能改变细胞膜脂肪酸的成分。在对脂肪酸含量的比较中n-3PUFAs组的鱼油组与n-3PUFAs组的红花组能显著提高大脑细胞膜中DHA与AA的含量,这与齐可民[20]、CALON F等[13,16]的研究结果一致,但鱼油组中DHA、AA的含量较红花组显著增多,其余组与阴性组相比也没有统计学意义。
摄入不同类型的PUFAs能显著提高n-3PUFAs在细胞膜中的含量,并且n-3PUFAs组与n-6PUFAs组的作用相差不大;摄入紫苏油、核桃油和红花油能有效降低n-6PUFAs的含量,增加饱和脂肪酸的含量;除摄入α-亚油酸以外,摄入其余油脂均能有效减少单不饱和脂肪酸的含量,提高细胞膜中n-3PUFAs/n-6PUFA的比值;摄入鱼油、核桃油和红花籽油能有效提高细胞膜中DHA与AA的比值;缺乏EFA对细胞膜脂肪酸的种类与含量没有影响,这可能与EFA的缺乏时间有关,短期缺乏EFA对细胞膜脂肪酸的组成无影响。由实验结果可以引申出更加深层的问题,为什么单独摄入α-亚油酸与摄入主要含α-亚油酸的油脂,对细胞膜脂肪酸影响不同,是否与油脂中的其他活性成分相关?在受到PUFAs作用后,细胞膜n-3与n-6PUFAs的含量和比值发生变化,DHA/AA的比值发生变化,可能介导的下一步反应是什么?目前研究n-3PUFAs的作用略多,并且已经有大量的结论表明n-3PUFAs在脑细胞,组织和维持人体健康方面发挥了重要的作用[23]。PUFAs在细胞膜中的种类与含量的变化与PUFAs的生理功能之间的联系以及可能的机理,也有待进一步研究。
[1]JULIEN C,BERTHIAUME L,HADJ-TAHAR A,et al.Postmortem brain fatty acid profile of levodopa-treated Parkinson disease patients and parkinsonian monkeys[J].Neurochem Int,2006,48(5):404-414.
[2]石如玲,许建功,杨 磊,等.老年和青年大鼠大脑皮质脂肪酸组成及含量的对比分析[J].中国生物化学与分子生物学报,2010,26(12):1165-1169.
[3]NILSSON A,RADEBORG K,SALO I,et al.Effects of supplementation with n-3 polyunsaturated fatty acids on cognitive performance and cardiometabolic risk markers in healthy 51 to 72 years old subjects:a randomized controlled cross-over study[J].Nutr J,2012,11(1):99-108.
[4]PETURSDOTTIR A L,FARR S A,MORLEY J E,et al.Effect of dietary n-3 polyunsaturated fatty acids on brain lipid fatty acid composition,learning ability,and memory of senescence-accelerated mouse[J].J Gerontol A-Biol,2008,63(11):1153-1160.
[5]HEINRICHS S C.Dietary omega-3 fatty acid supplementation for optimizing neuronal structure and function[J].Mol Nutr Food Res,2010,54(4):447-456.
[6]SU H M.Mechanisms of n-3 fatty acid-mediated development and maintenance of learning memory performance[J].J Nutr Biochem,2010,21(5):364-373.
[7]YURKO-MAURO K.Cognitive and cardiovascular benefits of docosahexaenoic acid in aging and cognitive decline[J].Curr Alzheimer Res,2010,7(3):190-196.
[8]YAMASHIMA T.A putative link of PUFA,GPR40 and adult-born hippocampal neurons for memory[J].Prog neurobiol,2008,84(2):105-115.
[9]CHYTROVA G,YING Z,GOMEZ-PINILLA F.Exercise contributes to the effects of DHA dietary supplementation by acting on membrane-related synaptic systems[J].Brain Res,2010,1341:32-40.
[10]YANG R H,WANG F,HOU X H,et al.Dietary omega-3 polyunsaturated fatty acids improves learning performance of diabetic rats by regulating the neuron excitability[J].Neuroscience,2012,212:93-103.
[11]郭艳芬,王丽梅,肖 娜,等.发育期补充DHA 对大鼠空间学习记忆能力的影响[J].中国油脂,2011,36(9):43-47.
[12]LERARY C.Analysis of Fatty Acid[OL].http://www.cyberlipid.org/cyberlip/home0001.html.2004-12-23.
[13]CALON F,COLE G.Neuroprotective action of omega-3 polyunsaturated fatty acids against neurodegenerative diseases:evidence from animal studies[J].Prostag Leukotr Ess,2007,77(5):287-293.
[14]RILEY M S,COOPER V S,LENSKI R E,et al.Rapid phenotypic change and diversification of a soil bacterium during 1000 generations of experimental evolution[J].Microbiology,2001,147(4):995-1006.
[15]JICHA G A,MARKESBERY W R.Omega-3 fatty acids:potential role in the management of early Alzheimer’s disease[J].Clin Interv Aging,2010,5:45-61.
[16]LEVANT B,OZIAS M K,CARLSON S E.Specific brain regions of female rats are differentially depleted of docosahexaenoic acid by reproductive activity and an (n-3) fatty acid-deficient diet[J].J Nutr,2007,137(1):130-134.
[17]BURDGE G C,CALDER P C.Conversion of alpha-linolenic acid to longer-chain polyunsaturated fatty acids in human adults[J].Reprod Nutr Dev,2005,45(5):581-597.
[18]ALESSANDRI J M,GUESNET P,VANCASSEL S,et al.Polyunsaturated fatty acids in the central nervous system:evolution of concepts and nutritional implications throughout life[J].Reprod Nutri Dev,2004,44(6):509-538.
[19]RAPOPOR S I.Arachidonic acid and the brain[J].J Nutr,2008,138(12):2515-2520.
[20]齐可民,焦 宏,江载芳.饮食脂肪对小鼠脑聚集长链多不饱和脂肪酸的影响[J].首都医科大学学报,2005,26(5):521-524.
[21]张 侃,曾 琳,龙在云,等.必需脂肪酸对大鼠脑组织中EPA,DHA含量的影响及意义[J].第三军医大学学报,2005,27(12):1213-1215.
[22]徐章华,邵玉芬.α-亚麻酸对大鼠行为,视网膜及肝脑脂肪酸构成的影响[J].中国公共卫生,2002,18(3):301-303.
[23]CHILDS C E,ROMEU-NADAL M,BURDGE G C,et al.Gender differences in the n-3 fatty acid content of tissues[J].P Nutr Soc,2008,67(1):19-27.
