益生菌的功能活性及其分子机理探究的研究进展
2014-04-24孙美玲王鲁峰潘思轶
刘 齐,孙美玲,王鲁峰,潘思轶*
(1.湖北大学知行学院 生物工程系,湖北 武汉 430011;2.华中农业大学 食品科技学院,湖北 武汉 430070)
益生菌起源于共生的生态学语probiosis。其定义为通过改善肠道内菌群平衡,对宿主起到有益作用的活性微生物[1]。以益生菌为原料制成的产品也就是通常所说的微生态制剂,其作用是用来改善肠道菌群结构、抑制有害微生物生长,提高人体免疫力。
作为微生态制剂的益生菌必须符合以下几个条件:耐酸耐胆汁,能够以存活的状态到达肠道内;能够在肠道内定植并且能够在肠道内增殖;已经被科学证实能够改善肠道内菌群结构并且能够起到有益作用;已经证实是安全可靠的或原本就是肠道菌群中的一种;存活在食品中能够保持有效的数量。
益生菌最早由俄国微生物学家在20世纪初发现,发展至今已有一个多世纪。在这一个多世纪中,出现了大量益生菌相关的学术专著,同时益生菌的概念以及功效已经被科学家和消费者所认同。目前随着现代科学技术的不断发展以及学科交叉程度的加深,益生菌的相关研究也取得了非常多的重大突破。但是由于人或动物肠道中的微生态环境非常复杂,微生物与微生物之间存在有共生、竞争等多种相互关系,目前益生菌的生理功能及分子作用机理还知之甚少。归纳有以下几个方面:
1 加强粘膜屏障
作为肠道中能够正常定植的益生菌,不仅能够在人体肠道中形成优势菌群而且能够紧密结合在肠粘膜上构成一道天然生物屏障,使得整个人体肠道处在“健康”状态。目前大量体外和体内试验表明,作为益生菌中一种的乳酸杆菌能通过分泌有机酸使得环境中pH值降低、产生次生代谢产物(抑菌毒素)、与肠道中有害细菌竞争性获得营养物质以及形成膜菌群等方式来抑制致病菌或条件性致病菌的生长,从而保护肠道生物屏障[2]。REN Z G等[3]在研究肝脏移植手术后肠道障碍功能时发现相对于空白对照而言,喂食双歧杆菌和乳杆菌对于术后肠道屏障功能的恢复与提高有显著帮助,不仅如此,这些益生菌对于改善肠道微生物菌群结构也能够起到非常积极、有效的作用。目前,关于益生菌对于肠道屏障功能提高的研究主要集中在婴幼儿的研究上,尤其是早产婴儿中居多。
研究发现,益生菌的适当补充能够有效的降低早产婴儿的坏死性结肠炎发病率以及死亡率,益生菌在治疗成人与小孩的急性腹泻感染的治疗是非常有用的。BINNS C等[4]通过对于婴幼儿抗生素引起的腹泻案例数据分析比较之后发现益生菌能够有效阻止该种腹泻的发生。上述研究结果指出益生菌对于治疗婴幼儿腹泻能够起到显著性效果,同时也指出虽然益生菌能够有效治疗婴幼儿腹泻症状但是不能够有效预防婴幼儿腹泻症状的发生。HOYOS A B等[5]对于当地早产儿使用益生菌制剂,对比于历史数据发现,益生菌能够有效增加早产儿体质量,同时能够使得坏死性小肠结肠炎的发病率降低75%,由坏死性小肠结肠炎引起的早产儿死亡率降低25%。LIN H C等[6]对台湾地区早产儿的相似研究也表明益生菌辅助疗法能够有效的降低坏死性小肠结肠炎的发病率与致死率。BIN-NUN A等[7]对于以色列地区体质量低于1.5kg的早产儿采用双盲实验发现使用益生菌制剂的早产儿坏死性小肠结肠炎发病率从14%降为1%。随着元分析方法的不断发展,更是使得益生菌肠道保护的研究得到了进一步的发展。DESHPANDE G等[8]利用元分析方法确定了益生菌长期治疗早产儿坏死性小肠结肠炎的菌种、菌株、用量、服用形式等因素。益生菌能够治疗早产儿坏死性小肠结肠炎的生理机制是由多方面所影响的。主要的机理是一方面益生菌在小肠末梢和结肠处益生菌能够起到生物反应器功能,其能够发酵代谢大量短链脂肪酸、乳酸、醋酸等物质合成早产儿需要的维生素、抗菌素和生长发育所必需的脂肪酸等物质;另一方面是由于处在小肠与回肠处的益生菌能够提高宿主的抵抗力(如加强肠道黏附、增加黏液分泌、加强肠道运动型、分泌产生保护功能的营养物质)或者是通过增加有益微生物的数量来抑制有害微生物的生长[9]。而上述2种生理机制都是基于Toll样受体(Toll-like receptors,T LR)分子调节机制所控制。从分子水平上来说,益生菌之所以能够起到肠道保护和调节肠道内微生物群落结构的作用主要是基于益生菌表面的脂多糖、鞭毛以及脂磷壁酸等表面结果形成相应活性细胞因子,然后通过胞间信号通道刺激NFκ-B转录因子转录增加TLR受体分子的表达从而达到肠道菌群平衡和上皮细胞修复[10-12]。
2 抗菌效应
作为存在于人体或动物肠道中的非致病性细菌,益生菌对于肠道的健康和平衡起到非常重要的作用。益生菌主要是通过细菌拮抗、免疫调节或者是肠上皮细胞组织结构改变的方式来调节肠道健康与身体健康。目前公认的益生菌抗菌效应模式有以下几种:(1)竞争性或拮抗作用;(2)增加消化酶活性;(3)降低有害细菌酶活与氨产物;(4)增加消化;(5)中和肠毒素或者刺激免疫系统[13]。
GIANNENAS I等[14]以300d大的肉鸡为实验材料,评价不同益生菌作为饲料补充剂对于艾美尔球虫的抑制作用。6周的实验结果显示复合益生菌饲喂的肉鸡体质量明显高于受感染的对照;在回肠和小肠中,乳杆菌组肉鸡的益生菌数量明显高于其他组。说明益生菌通过竞争性抑制回肠和小肠中有害微生物的生长,从而增加肉鸡体质量。CARLO C等在从大西洋鳕鱼肠道中分离得到的2株益生菌(GP-12与GP-21)对于霍乱弧菌和沙门氏菌的抑制作用试验中发现这2株益生菌对于肠道上皮细胞的黏附喜好是不同的。GP-12对于肠道前中段细胞的黏附性较强而GP-21对于肠道后端上皮细胞的黏附性较强;霍乱弧菌与肠道上皮细胞的黏附性明显受到GP-12和GP-21的影响且符合竞争性抑制机制特点,而GP-21对于沙门氏菌的抑制符合竞争性特点而GP-12却是另外特殊的机制;在镜检观察中发现GP-21存在明显自我聚集现象而GP-12存在和肠道菌共生的现象。CARLO C L等[15]的实验说明益生菌抑制肠道有害菌的生长有赖于上皮细胞的种类和他们之间的作用关系。DELGADO S等[16-18]在体外试验中也发现益生菌能够通过与沙门氏菌、大肠杆菌等肠道有害细菌竞争性结合Caco-2细胞来抑制上述有害细菌的生长。
除了通过竞争性或拮抗维持正常的肠道微生物群落关系的机理之外,益生菌还可以通过产生次生代谢产物来增加消化酶活性或降低有害细菌酶活。SARIENA S T等[19]通过体外实验评价了15种益生菌对于革兰氏阳性和阴性有害微生物的抑制作用。在实验中发现抑制微生物生长的其中主要的一个原因就是益生菌在糖发酵过程中产生的有机酸类物质抑制了微生物生长,降低了环境pH值。BANDA I G L等[20]在从塞内加尔鳗鱼肠道中分离的益生菌对美人鱼发光杆菌抑制作用的研究发现对照和Pdp11饲喂的鳗鱼的肠道和肝脏细胞中出现大量脂肪球聚集。说明益生菌通过激发脂蛋白的合成来改变上皮细胞的功能,从而抑制有害微生物的生长。
3 影响免疫系统
益生菌对机体免疫的影响,主要通过调节参与吞噬功能的一系列细胞因子的分泌来实现。当肠道内存在有益生菌的时候,人体内的单核细胞和巨噬细胞(吞噬细胞)、嗜中性粒细胞和自然杀伤(natural killer,NK)细胞(多形核白细胞)的活力会被激活。在上述细胞的活动下,大量的活性氧、溶酶体酶、白介素(interleutin,IL)和干扰素(interferon,IFN)等[21]免疫因子产生,从而增强人体免疫力。蓝景刚等在关于双歧杆菌增强机体免疫力的试验中发现向小鼠腹腔中注射双歧杆菌能够有效增强小鼠NK细胞及激活的杀伤(lymphokine-activated killer,LAK)细胞活性,与此同时腹腔局部的细胞因子IL-1、肿瘤坏死因子(tumor necrosis factor,TNF)、IL-6活性增强,而这些细胞因子都是由巨噬细胞分泌而来。葛凤霞等[22]报道,向小鼠腹腔中注入乳酸杆菌后,巨噬细胞活性指示酶——酸性磷酸酶、非特异性酯酶的数量明显增加。柳洪洁等[23]报道干酷乳杆菌(Lactobacillus casei)和保加利亚乳杆菌(Lactobacillus bulgaricus)可以通过刺激机体内免疫细胞(巨噬细胞、淋巴细胞)活性来提高机体的免疫力。
有些益生菌在进入到机体肠道中后,能够迅速形成优势菌群、调整肠道菌群结构,活化肠粘膜相关淋巴组织、促使其分泌大量分泌型免疫球蛋白A(secretory lgA,SIgA),从而提高机体免疫力。PERDIGON G等[24]研究发现嗜热链球菌和嗜酸乳杆菌能显著增加动物肠黏膜的免疫反应,促进肠道分泌型免疫球蛋白(SIgA)的分泌。分泌型免疫球蛋白(SIgA)在粘膜免疫的过程中能够中和肠道中有害细菌产生的毒素、限制肠道粘膜上皮的有害细菌以及病原体生长、甚至在肠道粘膜局部抗感染过程中也起到非常重要的作用。益生菌不光能够刺激分泌型球蛋白的分泌,其同样能够刺激其他分泌型抗体的产生。柴家前等[25]在对饲喂了乳杆菌的雏鸡进行消化道中抗体浓度连续性观测的试验中发现益生菌能够在早期显著提高鸡消化道分泌型IgA抗体的浓度。
4 抑制肠道疾病
益生菌抑制肠道疾病主要是通过拮抗功能抑制有害微生物的成长,从而改变肠道微生物菌群结构起到抑制肠道疾病的作用。益生菌在现代疾病治疗中起到重要作用。大多数可行的临床研究显示作为安慰剂的益生菌对于特殊的病症有明显作用,如阻止抗生素介导的腹泻、急性胃炎的治疗、过敏性肠炎以及幽门螺杆菌感染等。
目前公认的口服益生菌主要通过以下3种方式来抑制疾病的发生:1)改变肠道的微生态状态;2)作用于肠黏膜障碍;3)通过与肠道相关免疫系统的作用调节免疫反应[26-27]。目前的证据显示益生菌的抗病作用机制非常独特,每个益生菌种都能产生自己的一套抗病机制。然而其效果均依赖于使用的剂量以及服用的频率。益生菌抗病机制总结如图1所示。
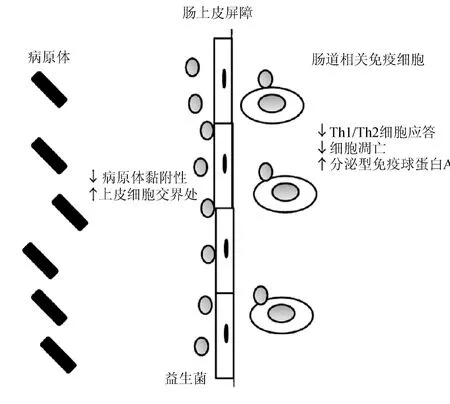
图1 益生菌抗病作用机理[28]Fig.1 Mechanisms of probiotics resistance effect
5 抑制抗生素介导的腹泻
抗生素介导的腹泻是抗菌治疗的普遍存在的副作用。许多研究者相信抗生素介导的腹泻是由于肠道微生物菌群改变所致,然而也有学者认为引起此种腹泻的主要是梭状芽孢杆菌。目前研究显示梭状芽孢杆菌风险部分依赖于抗生素服用的时间和抗生素的剂量(服用抗生素18d后,其相关风险系数为7.8)。与之相关性最强的抗生素有喹诺酮类、阿莫西林、头孢以及克林霉素等抗生素[29]。JOHNSONS等[30]在益生菌对梭状芽孢杆菌感染的人群影响实验中发现,在接受抗生素治疗的人群中,服用益生菌作为梭状芽孢杆菌感染前期预防的效果要比不服用要好的多。推测其原因可能是因为宿主肠道微生物菌群已经被改变。该研究从11个样本试验中发现,嗜酸乳杆菌CL1285以及干酪乳杆菌LBC80R能够有效地预防梭状芽孢杆菌的感染。KONING C J等[31]通过38名健康人群研究发现,服用了不同益生菌的人群每天排便次数显著高于服用安慰剂(不含有益生菌)的人群,虽然在所有受试人群粪便中都检测到梭状芽孢杆菌及其毒素。
6 抑制术后并发症
RAYES N等[32-33]在肝脏移植手术过后采用益生菌作为治疗药物分别对95名以及66名病人进行双盲实验后发现,在术后第1天连续服用益生菌的病人中术后感染并发症的发病率从48%分别减少到13%和3%(P=0.017)。LIU Z等[34]在结肠手术过后采用植物乳杆菌、嗜酸乳杆菌以及双歧杆菌作为治疗药物对100名病人进行试验后发现,在术前6d到术后10d时间内服用上述益生菌能够将术后并发症发病率从46%降低至14%。同时LIU Z等[34]还发现服用益生菌的受试人群体内乳糖/甘露糖比例下降以及封闭蛋白以及闭合蛋白早在肠道上皮细胞附近紧密结合。
7 抑制感染并发症
近10年有8篇关于益生菌抑制急性重症患者败血症并发症相关的研究,其结果见表1。其中5篇研究发现益生菌能够显著降低重症患者并发症的发病率。其中有2篇是研究益生菌对于多创伤重症病人的并发症抑制作用,结果显示益生菌能够通过调节肠道屏障功能以及改变免疫调节功能抑制并发症的发生。在这些研究中发现受试病人体内循环脂多糖数量降低,同时肠道中微生物生长滞后,说明益生菌在调节肠道屏障作用、阻止脂多糖介导的微生物生长与转移、修复Th1/Th2细胞因子应激反应平衡等方面都起到巨大的作用。
8 抑制肿瘤生长
人类肠道中存在有一个复杂丰富的微生物群体(1013~1014CFU)。这些内生微生物与其的真核宿主形成了共生关系而起这种紧密的共生关系帮助其与宿主形成了体内平衡。然而这种共生关系会受到许多因素(感染、饮食、压力、炎症)的左右从而影响健康甚至导致肿瘤的产生尤其是结肠癌。研究显示结肠癌产生的刺激因素主要是炎症环境以及肠道内的微生物组成。这主要是因为肠道中的微生物能够引起大量提高癌症风险的生理生化反应。这其中包括上皮细胞增殖控制、必需营养物质和生物活性物质的产生以及致病菌生长繁殖等[43]。SOBHANI I等[44]通过对比结肠癌病人和正常人群粪便中微生物组成发现结肠癌病人粪便中拟杆菌以及普氏菌数量明显多于正常人群。说明结肠癌的发生和宿主肠道内微生物组成有着一定的关联。而许多研究证明益生菌对于抑制结肠癌的发病及其前导损伤方面能够起到积极的效果。

表1 近十年进入加护病房重症病人利用益生菌治疗研究(双盲实验)汇总[35-42]Table1 Summary of results of probiotic preparations administered in icu critically ill patients in a decade (double blind experiment)
益生菌抑制癌症的精确机制可能是一个多渠道调节,这其中包括细胞增殖、活性氧、细胞凋亡、特殊酶产物以及影响宿主代谢组等方面。CAPURSO G等[45]通过体外实验发现嗜酸乳杆菌GG能够使得HGC-27以及DLD-1癌症细胞中的多元胺减少,从而抑制癌症细胞分裂增殖。KIM Y等[46]在双歧杆菌SPM0212抗癌活性以及细菌酶活抑制试验中发现,该菌株能够通过抑制β葡萄糖醛酸酶、β葡糖苷酶以及脲酶来有效抑制HT-29、SW480以及CACO-2癌症细胞的增殖。PARK E等[47]在评估多发酵芽胞杆菌(Bacillus polyfermenticus)对于雄性F334小鼠致癌作用及抗氧化效果的研究中发现,饲喂益生菌的小鼠其变性隐性病灶数量明显低于空白组,同时血液中白细胞DNA损伤以及脂质过氧化水平均得到恢复。该研究说明B.polyfermenticus能够通过降低体内活性氧作用抑制结肠癌的发生。PAGNINI C等[48]研究发现益生菌能够通过一种“肿瘤监督”的生理学机制来抑制结肠癌的发生。
9 降低人体胆固醇含量
血清胆固醇水平直接关系到人们的健康。血清中胆固醇含量过高容易引发高血压、冠心病等心血管疾病。以正常胆固醇水平为基础,血清胆固醇每升高1mmol,机体患冠心病的危险大约增加35%,冠心病死亡的危险增加45%,相反血清胆固醇每减少1%,患冠心病的危险性就降低2%~3%[49]。目前许多体内以及体外研究已经证实益生菌能够起到降低血清胆固醇含量的作用,而这些益生菌主要集中在乳杆菌中。NGUYEN T D T等[50]以小鼠为模型,将胚芽乳杆菌PH04喂食小鼠。结果发现与对照组相比,喂食胚芽乳杆菌PH04菌株14d后的小鼠中血清胆固醇(serum cholesterol,SC)和甘油三酸酯(triglyceride fatty acid,TG)分别下降了7%和10%,因此认为胚芽乳杆菌可以作为降胆固醇的益生菌。LIONG M T 等[51]在对嗜酸乳杆菌(Lactobacillus acidophilus)和干酪乳杆菌(Lactobacillus casei)体外降低胆固醇的研究中也发现,2种微生物培养基中胆固醇的减少量与这2种菌体的生长情况密切相关。PEREIRA D I A等[52]在发酵乳杆菌(Lactobacillus fermentum)体外降胆固醇实验中发现其和嗜酸乳杆菌以及干酪乳杆菌一样都具有降低血清胆固醇潜在能力。
目前关于益生菌降低血清胆固醇含量的机理主要存在吸收同化理论和共沉淀两种认识。前者主要是GILLILAND提出,其通过向培养基中加入胆固醇物质观察乳酸菌生长情况后发现培养基中的胆固醇含量明显降低而乳酸菌胞内胆固醇含量明显增加从而认为乳酸菌能够通过同化吸收胞外胆固醇来降低环境中的胆固醇含量。LIONG M T等[51]在对11株乳酸菌体外胆固醇去除试验中发现,生长于含有胆固醇培养基的菌体脂肪酸组成和不含有胆固醇培养基中菌体的脂肪酸组成存在有明显差异。因此,其认为菌体吸收同化了培养基中的胆固醇形成自身物质。共沉淀理论则认为胆固醇水平的降低并不是由于乳酸菌的同化吸收而是由于胆酸盐与胆固醇的共沉淀所导致的。TARANTO M P等[53]在研究罗氏乳杆菌(Lactobacillus renteril)降低胆固醇的试验中发现,在加入胆固醇和未加入胆固醇的培养基中,L.renteril自身脂肪酸组成并没有发生显著性变化,而其胆盐水解酶活性却存在显著性差异。其加入胆固醇的培养基中生长的L.renteril 中胆盐水解酶活性明显高于未加入胆固醇的培养基中生长的L.renteril。由此其认为L.renteril并没有通过同化吸收作用去除掉环境中的胆固醇而是通过形成大量胆酸盐与胆固醇形成沉淀来降低环境中胆固醇。
10 展望
尽管益生菌的概念在现在已经被大家越来越熟知,但是国内外关于益生菌的科学研究仍然需要不断发展,尤其是对于益生菌的益生机理研究更是少之又少。虽然目前对于益生菌的功能活性与机理研究取得了一定的成绩,但是许多机理都只是处在推测和假定阶段,并没有完全实质的证据证明这些机理的真实性和合理性。随着基因组、转录组、蛋白组和代谢组技术的不断完善和发展,为益生菌的系统研究提供了很好的思路,可以更加准确地评价和筛选特定功能益生菌,为探究其益生机理提供了可靠的技术和工具。
[1]FAO/WHO Expert Consultation.Guidelines for the evaluation of probiotics in food[M].London:Ontario(Canada);2002.
[2]黄 回,韩春茂.乳杆菌生态免疫营养在维护肠黏膜屏障中的作用[J].中华烧伤杂志,2005,21(2):155-157.
[3]REN Z G,LIU H,JIANG J W,et al.Protective effect of probiotics on intestinal barrier function in malnourished rats after liver transplantation[J].Hepatobiliary Pancreat Dis Int,2011,10(5):489-496.
[4]BINNS C,LEE M K.The use of probiotics to prevent diarrhea in young children attending child care centers:A review[J].J Exp Clin Med,2010,2(6):269-273.
[5]HOYOS A B.Reduced incidence of necrotizing enterocolitis associated with enteral administration of Lactobacillus acidophilus and Bifidobacterium infantis to neonates in an intensive care unit[J].Int J Infect Dis,1999,3(4):197-202.
[6]LIN H C,SU B H,CHEN A C,et al.Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants[J].Pediatrics,2005,115(1):1-4.
[7]BIN-NUN A,BROMIKER R,WILSCHANSKI M,et al.Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates[J].J Pediatr,2005,147(2):192-196.
[8]DESHPANDE G,RAO S,PATOLE S.Probiotics for prevention of necrotising enterocolitis in preterm neonates with very low birthweight:a systematic review of randomised controlled trials[J].Lancet,2007,369(9573):1614-1620.
[9]NEISH A S.Microbes in gastrointestinal health and disease[J].Gastroenterology,2009,136(1):65-80.
[10]HAMER H M,JONKER D,VENEMA K,et al.The role of butyrate on colonic function[J].Aliment Pharm Therap,2008,27(2):104-119.
[11]NEISH A S.The gut microflora and intestinal epithelial cells:a continuing dialogue[J].Microbes Infect,2002,4(3):309-317.
[12]NEISH A S,GEWIRTZ A T,ZENG H,et al.Prokaryotic regulation of epithelial responses by inhibition of IkappaB-alpha ubiquitination[J].Science,2000,289(5484):1560-1563.
[13]JIN L Z,HO Y W,ABDULLAH N,et al.Growth performance,intestinal microbial populations,and serum cholesterol of broilers fed diets containing Lactobacillus cultures[J].Poultry Sci,1998,77(9):1259-1265.
[14]GIANNENASA I,PAPADOPOULOSB E,TSALIE E.Assessment of dietary supplementation with probiotics on performance,intestinal morphology and microflora of chickens infected with Eimeria tenella[J].Vet Parasitol,2012,188(1-2):31-40.
[15]CARLO C L,CHRISTOPHER M A.In vitro adherence of two candidate probiotics from Atlantic cod and their interference with the adhesion of two pathogenic bacteria[J].Vet Microbiol,2011,148(2-4):252-259.
[16]DELGADO S,O’SULLIVAN E,FITZGERALD G,et al.Subtractive screening for pro-biotic properties of Lactobacillus species from the human gastrointestinal tract in the search for new probiotics[J].J Food Sci,2007,72(8):310-315.
[17]CANDELA M,PERNA F,CAMEVALI P,et al.Interaction of probiotic Lactobacillus and Bifidobacterium strains with human intestinal epithelial cells:adhesion properties,competition against enteropathogens and modulation of IL-8 production[J].Int J Food Microbiol,2008,125(3):286-292.
[18]RIDWAN B U,KONING C J,BESSELINK M G,et al.Antimicrobial activity of a multispecies probiotic(Ecologic641)against pathogens isolated from infected pancreatic necrosis[J].Lett Appl Microbiol,2008,46(1):61-67.
[19]SARIENA S T,BARLOW J,COSTABILE A.In vitro evaluation of the antimicrobial activity of a range of probiotics against pathogens:Evidence for the effects of organic acids[J].Anaerobe,2012,18(5):530-538.
[20]BANDA I G L,LOBO C,RUBIO J M L.Influence of two closely related probiotics on juvenile Senegalese sole(Soleasenegalensis,Kaup 1858)performance and protection against Photobacterium damselae subsp.piscicida[J].Aquaculture,2010,306(1-4):281-288.
[21]蓝景刚,胡 宏.双歧杆菌及其表面分子的免疫增强作用[J].中国微生态学杂志,1999,11(3):79-85.
[22]葛凤霞,袁小林,张 朝.乳酸杆菌对小鼠腹腔巨噬细胞活化作用及细胞毒作用的初步研究[J].中国微生态学杂志,1998,10(1):35-41.
[23]柳洪洁,成连贵,牛钟相.SPF 鸡与普通鸡消化道主要正常菌群数量的比较[J].生态学杂志,2005,24(7):153-159.
[24]PERDIGON G,ALVAREZ S,RACHID M,et al.Immune system stimulation by probiotics[J].Journal of Dairy Science,1995,78(7):1597-1606.
[25]柴家前,孙明军,杨 倩.短乳杆菌的分离鉴定及其对鸡肠粘膜SIgA分泌的影响[J].中国兽医学报,2001,21(5):80-86
[26]HOOPER L V,GORDON J I.Commensal host-bacterial relationships in the gut[J].Science,2001,292(5519):1115-1118.
[27]OELSCHLAEGER T A.Mechanisms of probiotic actions:a review[J].Int J Med Microbiol,2010,300(1):57-62.
[28]KOTAZAMPASSI K,GIAMARELLOS-BOURBOULIS E J.Probiotics for infectious diseases:more drugs,less dietary supplementation[J].Int J Antimicrob Arg,2012,40(4):288-296.
[29]STEVENS V,DUMYATI G,FINE L S,et al.Cumulative antibiotic exposures over time and the risk of Clostridium difficile infection[J].Clin Infect Dis,2011,53(1):42-48.
[30]JOHNSON S,MAZIADE P J,MCFARLAND L V,et al.Is primary prevention of Clostridium difficile infection possible with specific probiotics?[J].Int J Infect Dis,2012,16(11):e786-792.
[31]KONING C J,JONKERS D M,STOBBERINGH E E,et al.The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxicillin[J].Am J Gastroenterol,2008,103(1):178-189.
[32]RAYES N,SEEHOFER D,HANSEN S,et al.Early enteral supply of Lactobacillus and fiber versus selective bowel decontamination:a controlled trial in liver transplant recipients[J].Transplantation,2002,74(1):123-127.
[33]RAYES N,SEEHOFER D,THERUVATH T,et al.Supply of pre-and probiotics reduces bacterial infection rates after liver transplantation-a randomized,double-blind trial[J].Am J Transplant,2005,5(1):125-130.
[34]LIU Z,QIN H,YANG Z,et al.Randomised clinical trial:the effects of perioperative probiotic treatment on barrier function and postoperative infectious complications in colorectal cancer surgery-a double-blind study[J].Aliment Pharm Therap,2011,33(1):50-63.
[35]JAIN P K,MCNAUGHT C E,ANDERSON A D,et al.Influence of synbiotic containing Lactobacillus acidophilus La5,Bifidobacterium lactis Bb12,Streptococcus thermophilus,Lactobacillus bulgaricus and oligofructose on gut barrier function and sepsis in critically ill patients:a randomized controlled trial[J].Clin Nutr,2004,23(4):467-475.
[36]KOTZAMPASSIK,GIAMARELLOS-BOURBOULISEJ,VOUDOURIS A,et al.Benefits of a synbiotic formula (Synbiotic 2000Forte) in critically ill trauma patients:results of a randomized controlled trial[J].World J Surg,2006,30(10):1848-1855.
[37]FORESTIER C,GUELON D,CLUYTENS V,et al.Oral probiotic and prevention of Pseudomonas aeruginosa infections:a randomized,doubleblind,placebo-controlled pilot study in intensive care unit patients[J].Crit Care,2008,12(3):69-77.
[38]KNIGHT D J,GARDINER D,BANKS A,et al.Effect of synbiotic therapy on the incidence of ventilator-associated pneumonia in critically ill patients:a randomized,double-blind,placebo-controlled trial[J].Intens Care Med,2009,35(5):854-861.
[39]SHIMIZU K,OGURA H,GOTO M,et al.Synbiotics decrease the incidence of septic complications in patients with severe SIRS:a preliminary report[J].Digest Dis Sci,2009,54(5):1071-1078.
[40]BARRAOUD D,BLARD C,HEIN F,et al.Probiotics in the critically ill patient:a double blind,randomized,placebo-controlled trial[J].Intens Care Med,2010,36(9):1540-1547.
[41]MORROW L E,KOLLEF M H,CASALE T B.Probiotic prophylaxis of ventilator-associated pneumonia:a blinded,randomized,controlled trial[J].Am J Resp Crit Care,2010,182(8):1058-1064.
[42]TAN M,ZHU J C,DU J,et al.Effects of probiotics on serum levels of Th1/Th2 cytokine and clinical outcomes in severe traumatic brain-injured patients:a prospective pilot study[J].Crit Care,2011,15(6):285-290.
[43]ZHU Y M,Michelle L T,JOBIN C,et al.Gut microbiota and probiotics in colon tumorigenesis[J].Cancer Lett,2011,309(2):119-127.
[44]SOBHANI I,TAP J,ROUDOT-THORAVAL F,et al.Microbial dysbiosis in colorectal cancer(CRC)patients[J].PLoS One,2011,6(1):e16393.
[45]CAPURSO G,MARIGNANI M,DELLE F G.Probiotics and the incidence of colorectal cancer:when evidence is not evident[J].Digest Liver Dis,2006,38(S2):S277-S282.
[46]KIM Y,LEE D,KIM D,et al.Inhibition of proliferation in colon cancer cell lines and harmful enzyme activity of colon bacteria by Bifidobacterium adolescentis SPM0212[J].Arch Pharm Res,2008,31(4):468-473.
[47]PARK E,JEON G I,PARK J S,et al.A probiotic strain of Bacillus polyfermenticus reduces DMH induced precancerous lesions in F344 male rat[J].Biol Pharm Bull,2007,30(3):569-574.
[48]PAGNINI C,CORLETO V D,HOANG S B,et al.Commensal bacteria and“Oncologic Surveillance”suggestions from an experimental model[J].J Clin Gastroenterol,2008,42(3):S193-S196.
[49]MANSON J E,TOSTESON H,RIDKER P M,et al.The primary prevention of myocardial infarction[J].New Engl J Med,1992,326(21):1406-1416.
[50]NGUYENT D T,KANG J H,LEE M S.Characterization of Lactobacillus plantarum PH04,a potential probiotic bacterium with cholesterollowering effects[J].Int J Food Microbiol,2007,113(3):358-361.
[51]LIONG M T,SHAH N P.Acid and bile tolerance and cholesterol removal ability of Lactobacilli strains[J].J Dairy Sci,2005,88(1):55-66.
[52]PEREIRA D I A,MCCARTNEY A L,GIBSON G R.An in vitro study of the probiotic potential of a bile-salt-hydrolyzing Lactobacillus fermentum strain,and determination of its cholesterol-lowering properties[J].Appl Environ Microb,2003,69(8):4732-4752.
[53]TARANTO M P,MEDICI M,PERDIGON G,et al.Evidence for hypocholesterolemic effect of Lactobacillus reuteri in hyper-cholesterolemic mice[J].J Dairy Sci,1998,81(9):2336-2340.
