中药QHF复方对人乳腺癌MCF-7细胞的体外抗癌效果研究
2014-04-24万信念常俊杰
艾 婷,周 军,陈 涛,胡 卫,万信念,常俊杰
乳腺癌是最常见的导致妇女死亡的恶性肿瘤之一,据统计在西方国家,乳腺癌每年的发病率和死亡率在所有妇女癌症中是最高的,且呈逐年增加的趋势,严重威胁女性的健康。预计到2030年,乳腺癌的死亡率将是现在的两倍[1]。中药复方目前仍是中医药防治肿瘤的主流,QHF复方是从具有清热解毒(Q)、活血化瘀 (H)、扶正固本 (F)作用的中药中提取的多个抗肿瘤有效组分,通过文献研究及动物实验,并采用均匀设计法筛选得到的成分组方[2]。前期实验已经表明QHF复方在体内具有良好的抗肿瘤作用,本实验拟进一步研究其体外抗癌作用的效果及可能的机制。
1 材料与方法
1.1 实验材料 人乳腺癌MCF-7细胞系华中科技大学同济医学院惠赠。华蟾素注射液购自安徽金蟾生化股份有限公司,国药准字:Z34020273,批号:120811-3,规格:5 ml/支;20(R)人参皂苷Rg3标准品购自上海源叶生物科技有限公司,批号:20120506,规格:20 mg/瓶;香菇多糖购自南京泽朗植提技术有限公司,规格:1 g/包;注射用血塞通 (冻干)购自昆明制药集团股份有限公司,国药准字:Z20026438,批号:12GA12,规格:400 mg/支;注射用盐酸多柔比星购自浙江海正药业股份有限公司,国药准字:H33021980,批号:012027CF,规格:10 mg/支;DMEM培养基购自美国Gibco公司;胎牛血清购自美国Sigma公司;胰蛋白酶购自上海源叶生物科技有限公司;人血管内皮生长因子酶联免疫分析试剂盒购自上海劲马有限公司。
1.2 实验方法
1.2.1 药物的配制 (1)20(R)人参皂苷Rg3原液的配制:用分析天平准确称取10 mg 20(R)人参皂苷Rg3,在超净工作台上加入400μl二甲基亚砜 (DMSO)溶解,加DMEM培养基至10ml,使其浓度为1mg/ml,4℃冰箱保存。(2)三七总皂苷原液的配制:用分析天平准确称取血塞通冻干粉末10 mg,在超净工作台上加DMEM培养基至10 ml,使其浓度为1 mg/Ml,4℃冰箱保存。(3)香菇多糖原液的配制:用分析天平准确称取60 mg香菇多糖,在超净工作台上加DMEM培养基至10 ml,使其浓度为10 mg/ml,4℃冰箱保存。(4)中药QHF复方的配制:按照华蟾素∶人参皂苷Rg3∶三七总皂苷∶香菇多糖=57∶1∶0.4∶7的比例进行配制。QHF浓度从高到低依次命名为:QHF1、QHF2、QHF3、QHF4和QHF5,每次配制3 ml。配方见表1,4℃冰箱保存。(5)盐酸多柔比星原液的配制:在超净工作台上,加DMEM培养基将盐酸多柔比星稀释至1 mg/ml,4℃冰箱避光保存。
1.2.2 细胞培养 人乳腺癌MCF-7细胞用含10%胎牛血清、1%青/链霉素的DMEM高糖培养基,于37℃,含5%二氧化碳 (CO2)的培养箱中培养,每2 d换液一次,当细胞稳定生长并处于对数生长期时用于实验。
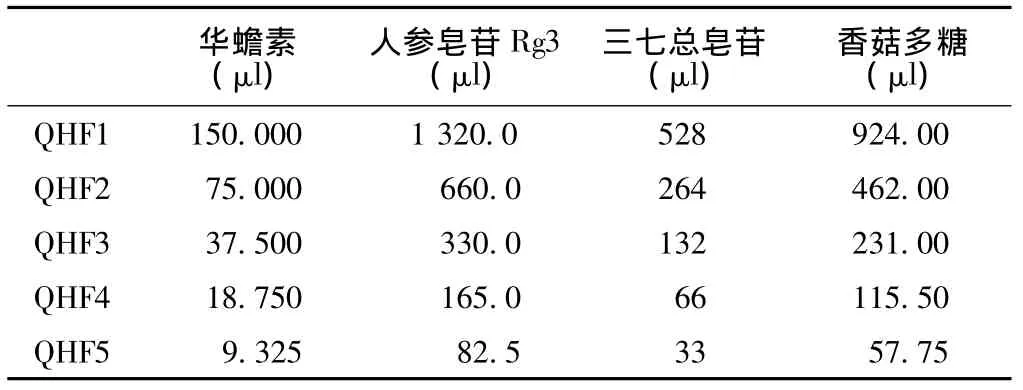
表1 QHF复方的配制 (3 ml)Table 1 Preparation of QHF
1.2.3 四甲基偶氮唑盐微量酶反应比色法 (MTT法)测定中药QHF复方对细胞生长的影响 取对数生长期的MCF-7细胞,用0.25%胰蛋白酶消化后收集细胞计数,以2×104个细胞/孔的浓度接种于96孔板,37℃,含5%CO2的培养箱中培养20 h后给药。设空白组 (不加细胞)、正常对照组、阳性对照组 (加入盐酸多柔比星使其终浓度为2.5μg/ml)、QHF药物组 (分为5个浓度)分别培养24 h、48 h和72 h,每个浓度和时间点设5个复孔。药物作用时间终止前4 h,于每孔中各加入5 mg/ml MTT 20μl,继续培养细胞4 h。吸弃96孔内培养基,每孔加入150μl DMSO,摇床上振荡5 min,使紫色结晶充分溶解。于酶标仪上在波长570 nm处检测各孔光密度值。按下列公式计算药物对肿瘤细胞的生长抑制率=〔(正常对照组OD值-实验组OD值)/(正常对照组OD值-空白组OD值)〕 ×100%。
1.2.4 流式细胞仪检测细胞周期 根据MTT法计算出中药QHF复方半数抑制浓度 (IC50),将实验分为正常对照组、QHF复方组 (浓度为IC50)、盐酸多柔比星组、联合用药组(中药QHF复方+盐酸多柔比星)。取对数生长期细胞用胰酶消化后台盼蓝染色,细胞计数,细胞活力大于95%,调整细胞浓度为2×104/ml。给药后继续培养48 h。消化收集细胞制备单细胞悬液,将细胞重悬于1 ml75%的冰乙醇中,4℃固定过夜。过夜后,800 r/min离心5 min(离心半径135 mm),弃去固定液,磷酸盐缓冲液 (PBS)3 ml冲洗2次,800 r/min离心5 min(离心半径135 mm),每个标本加入40μg/Ml RNA酶400μl,37℃水浴30 min,然后每个标本加入碘化并啶(PI)染液100μl混匀,4℃避光染色30 min,用300目尼龙膜过滤后上流式细胞仪检测细胞周期。
1.2.5 酶联免疫吸附测定 (ELISA)法检测细胞上清液中血管内皮生长因子 (VEGF)的含量 收集不同浓度中药QHF复方处理后的MCF-7细胞上清液,检测各组上清液中VEGF含量,具体的实验步骤按试剂盒操作说明进行。
1.2.6 细胞迁移实验 取对数生长期细胞用胰酶消化后,用含0.2%胎牛血清清蛋白 (BSA)的无血清DMEM培养基重悬细胞,台盼蓝染色,细胞计数,细胞活力大于95%,调整细胞浓度为7×104/ml。取100μl细胞悬液加入Transwell小室的上室中,分别加入不同浓度的中药QHF复方,使上室中的液体总浓度为200μl。下室中加入600μl含10%胎牛血清的DMEM培养基,将小室放入,于37℃,含5%CO2的培养箱中培养24 h。培养结束后,吸弃小室内的培养基,用棉签轻轻擦去膜内表面的细胞,用4%多聚甲醛固定1 h,结晶紫染色30 min后,清水冲洗3次,用镊子轻轻揭下滤膜,放在载玻片上。200倍光镜下观察滤膜外的细胞,随机选择5个视野进行细胞计数,计算出平均值。
1.2.7 细胞侵袭实验 将盛有Matrigel胶的EP管从-20℃冰箱中取出,4℃过夜融化。用预冷的枪头将Matrigel胶与无血清的DMEM培养基按1∶3稀释。在小室滤膜的上表面涂一层50μl稀释过的Matrigel胶,放入37℃,CO2的培养箱中30 min,使其聚合成凝胶,用之前在紫外灯下杀菌2 h。其余步骤同迁移性实验。
1.3 统计学方法 采用SPSS 13.0统计软件进行统计学分析。计量资料以 (±s)表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 中药QHF复方对MCF-7细胞的体外增殖抑制效果MTT实验结果显示:不同浓度的QHF作用于MCF-7细胞24、48、72 h后,随着中药QHF复方浓度的增加,生长抑制率不断增加;且随着时间延长,生长抑制率逐渐增加 (=18.383,P <0.01,见图 1)。24、48、72 h的中药 QHF 复方IC50值对应华蟾素浓度分别为 214.3、44.8、2.8 μl。
2.2 流式细胞仪检测细胞周期结果 作用48 h后,与正常对照组比较,QHF复方组、盐酸多柔比星组、联合用药组细胞周期位于G0/G1期和S期的比例增多,位于G2/M期的比例减少,差异均有统计学意义 (P<0.05);与联合用药组比较,QHF复方组、盐酸多柔比星组细胞周期位于G0/G1期的比例减少,位于S期和G2/M期的比例增多,差异均有统计学意义(P <0.05,见表2)。
表2 不同组人乳腺癌MCF-7细胞不同细胞周期所占比例比较(± s,%)Table 2 Comparison of different cell cyclesofhuman breast cancer cell line MCF-7 in different groups

表2 不同组人乳腺癌MCF-7细胞不同细胞周期所占比例比较(± s,%)Table 2 Comparison of different cell cyclesofhuman breast cancer cell line MCF-7 in different groups
注:与正常对照组比较,*P<0.05;与联合用药组比较,△P<0.05
组别 例数 G0/G1期 S期 G2/M期正常对照组 3 3.9 ±0.25 9.7 ±0.36 86.4 ±4.68 QHF 复方组 3 43.5 ±1.32*△ 34.9 ±3.17*△ 21.6 ±1.80*△盐酸多柔比星组 3 43.1 ±3.80*△ 35.1 ±1.96*△ 21.8 ±2.69*△联合用药组 3 56.6 ±3.14* 32.9 ±1.60* 10.5 ±2.27*F 0.000 0.000 0.000 238.234 110.256 383.572 P值值
2.3 中药QHF复方对MCF-7细胞上清液中VEGF含量的影响 ELISA结果显示:作用48 h后,与正常对照组比较,QHF1组、QHF2组、QHF3组、QHF4组和QHF5组上清液中VEGF含量均下降,差异有统计学意义 (F=238.234,P<0.05,见图 2)。
2.4 中药QHF复方对MCF-7细胞迁移及侵袭能力的影响
Transwell实验结果显示:QHF1组、QHF2组对细胞的抑制作用较大,使穿膜的细胞数显著减少,对Transwell实验结果影响较大,选取QHF3组、QHF4组和QHF5组3个抑制作用相对较低的浓度进行实验。与正常对照组 (127.3±5.7)比较,QHF3组 (17.7 ±5.0)、QHF4 组 (51.3 ±2.9)和 QHF5 组(63.0±6.6)穿透滤膜的MCF-7细胞数目减少,差异有统计学意义 (F=109.667,P <0.01,见图3)。
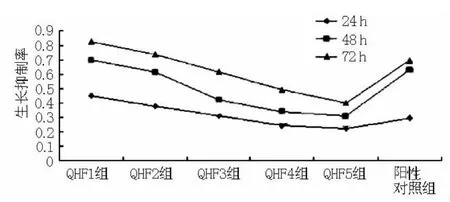
图1 中药QHF复方对MCF-7细胞的生长抑制率Figure 1 Growth-inhibiting effect of compound QHF on MCF-7 cells

图2 ELISA法检测上清液中VEGF的表达Figure 2 Expression of VEGF determined by ELISA

图3 中药QHF复方对MCF-7细胞侵袭能力的影响 (结晶紫染色,光镜,×200)Figure 3 Effect of compound QHF on MCF-7 cell invasion determined by crystal violet staining
3 讨论
乳腺癌是导致妇女死亡最常见的恶性肿瘤之一,容易早期发生血行播散,对女性健康威胁极大。目前,乳腺癌的治疗措施有外科手术、化疗、放疗、靶向生物治疗等,对大多数乳腺癌细胞有一定的杀伤作用,但仍有25%~30%的早期乳腺癌患者在随访10~15年之后发生远处转移[3]。同时肿瘤细胞的耐药性及化疗药物的毒副作用也是肿瘤治疗过程中的另一难题,因此动、植物来源的天然化合物已经成为抗癌药物的主要研究方向。目前中药复方仍是中医药防治肿瘤的主流,其多成分、多环节和多靶点整体调节的特点对于多基因调控、发病机制复杂、病情多变的肿瘤防治来说具有非常重要的意义。且中药又因其独特的抗肿瘤效应、放化疗增敏以及减轻放化疗毒副作用及延长患者生存期等方面独具效果而逐渐被重视[4-6]。因此,本实验的目的就是探讨中药QHF复方在体外对人乳腺癌MCF-7细胞增殖、迁移、侵袭及VEGF表达的影响,从而为乳腺癌的临床治疗奠定基础。
中药QHF复方是由华蟾素、人参皂苷Rg3、三七总皂苷、香菇多糖以一定比例配伍而成,其中华蟾素与人参皂苷Rg3在复方中占主导地位[7]。华蟾素注射液由中华大蟾蜍皮经过水化萃取、加工而成,美国已经完成华蟾素注射液Ⅰ期抗肿瘤的临床试验,目前正在进行华蟾素注射液的Ⅱ期抗肿瘤临床试验[8]。研究表明华蟾素能抑制HepG-2细胞的增殖并呈浓度依赖性,还能阻滞肿瘤细胞周期[9],本研究 MTT实验结果显示不同浓度的中药QHF复方均能抑制人乳腺癌MCF-7细胞的增殖,且随着药物浓度的增大及作用时间的延长,其对MCF-7细胞的生长抑制率也随之增大;流式细胞仪结果显示,QHF复方组细胞周期位于G0/G1期和S期的比例增多,位于G2/M期的比例减少。人参皂苷Rg3是一种四环三萜皂苷,是从中药人参根的浸出液中分离出来的一种有效单体成分,其抗肿瘤作用已经引起了广泛重视,但确切机制尚未明了。有研究证实人参皂苷Rg3能抑制动物体内多种移植瘤的生长、浸润和转移,且对重要脏器无明显毒副作用[10]。本研究通过Transwell实验表明,中药QHF复方能降低MCF-7细胞的迁移和侵袭能力,且呈现较好的浓度依赖性。研究结果表明QHF复方有抑制肿瘤细胞增殖、迁移和侵袭的能力,与现有的研究报道结果相符[11]。
乳腺癌患者死亡的主要原因是肿瘤的侵袭和转移,而导致肿瘤侵袭和转移的一个重要因素是肿瘤新生血管的形成。已经证实VEGF是目前发现最重要的直接作用于血管内皮的生长因子[12]。VEGF是由肿瘤细胞分泌进入体液,其能特异性地对血管内皮细胞的增殖、迁移和细胞外基质的降解及血管构建等方面进行调控。研究表明,无论是在mRNA水平还是蛋白水平,在多种恶性肿瘤中VEGF的表达均增高,而抑制VEGF的表达可抑制肿瘤的生长[13]。因此探讨中药QHF复方对人乳腺癌MCF-7细胞VEGF表达的影响对研究中药QHF复方抗肿瘤的具体机制有重要意义。本研究结果表明,中药QHF复方能降低人乳腺癌MCF-7细胞上清液中VEGF含量,提示中药QHF复方抑制人乳腺癌MCF-7细胞增殖、迁移和侵袭的作用的可能与其抑制肿瘤细胞VEGF的分泌和合成有关。目前,对中药抗肿瘤血管生成研究主要围绕中药对肿瘤新生血管形成的影响及抑制VEGF/血管内皮细胞生长因子受体 (VEGFR)相关信号通路展开[14],但其调控信号传导从细胞外经细胞膜及细胞质到细胞核而发挥效应的具体机制和环节尚需进一步的研究证实,也是本课题今后研究的方向之一。
1 Justo N,Wilking N,Jönsson B,et al.A review of breast cancer care and outcomes in Latin America[J].Oncologist,2013,18(3):248-256.
2 Tao C,Dan L,Ling F,etal.In vivo and vitroeffectsofQHF combined with chemotherapy on hepatocellular carcinoma[J].Journal of Biomedical Research,2010,24(2):161-168.
3 Brackstone M,Townson JL,Chambers AF.Tumour dormancy in breast cancer:an update[J].Breast Cancer Res,2007,9(3):208.
4 Huang KW,Wu HL,Lin HL,et al.Combining antiangiogenic therapy with immunotherapy exerts better therapeutical effects on large tumors in a woodchuck hepatomamodel[J].Proc Natl Acad Sci U S A,2010,107(33):14769-14774.
5 Chen Y,Hao H,He S,etal.Lipoxin A4 and its analogue suppress the tumor growth of transplanted H22 in mice:the role of antiangiogenesis[J].Mol Cancer Ther,2010,9(8):2164-2174.
6 Banerjee S,A′Hern R,Detre S,et al.Biological evidence for dual antiangiogenic-antiaromatase activity of the VEGFR inhibitor PTK787/ZK222584 in vivo[J].Clin Cancer Res,2010,16(16):4178-4187.
7 Chen T,LiD,Fu YL,etal.Screening of QHF formula for effective ingredients from Chinese herbs and its anti-hepatic cell cancer effect in combination with chemotherapy [J].Chinese Medical Journal,2008,121(4):363-368.
8 Meng Z,Yang P,Shen Y,et al.Pilot study of huachansu in patients with hepatocellular carcinoma,nonsmall-cell lung cancer,or pancreatic cancer[J].Cancer,2009,115(22):5309-5318.
9 Tian LL,Gao S,Cui XN.Effects of Cinobufacini injections on the proliferation,apoptosis and expression of topoisomeraseⅡ ofhepatocarcinoma HepG-2 cells[J].Chin JClin Pharmacol,2013,29(7):530-533.
10 Thompson Coon J,Ernst E.Panax ginseng:a systematic review of adverse effects and drug interactions[J].Focus on Alternative and Complementary Therapies,2002,7(1):111-112.
11 王泉,陈涛,艾婷,等.中药复方QHF抑制人肝癌HepG2细胞转移的实验研究[C].第九次全国中西医结合基础理论研究学术研讨会论文汇编,2013.
12 Edelstein ML,AbediMR,Wixon J.Gene therapy clinical trialsworldwide to 2007--an update [J].The Journal of Gene Medicine,2007,9(10):833-842.
13 Shin GH,Park KS,Chung KH,et al.Up-regulation of interleukin-8 by vascular endothelial growth factor in vasculatures in vivo[J].The Korean Journal of Hematology,2009,44(4):199-204.
14 Yu X,Zhu J,MiM,et al.Anti-angiogenic genistein inhibits VEGF-induced endothelial cell activation by decreasing PTK activity and MAPK activation[J].Medical Oncology,2012,29(1):349-357.
