二氯乙烷在N型吸附剂上的竞争吸附及吸附平衡研究
2014-04-13赵向苗朱建华许玮玮
赵向苗,朱建华, 田 俊, 王 琪, 许玮玮, 杨 梅, 尹 星
(1. 中国石油集团工程设计有限责任公司华北分公司,河北 任丘 062552;2. 中国石油大学(北京),北京 102249;3.晋煤金石化工投资集团有限公司,河北 石家庄 050041)
二氯乙烷在N型吸附剂上的竞争吸附及吸附平衡研究
赵向苗1,朱建华2, 田 俊1, 王 琪1, 许玮玮1, 杨 梅1, 尹 星3
(1. 中国石油集团工程设计有限责任公司华北分公司,河北 任丘 062552;2. 中国石油大学(北京),北京 102249;3.晋煤金石化工投资集团有限公司,河北 石家庄 050041)
在模拟汽油体系中研究了二氯乙烷在 N 型吸附剂上的竞争吸附及吸附平衡。研究结果表明,汽油中存在的烯烃和芳烃与二氯乙烷之间存在着强烈的竞争吸附,严重影响了N型吸附剂的脱氯性能;二氯乙烷在N 型吸附剂上的吸附等温线适合利用 Langmuir方程进行拟合,而通过对吸附热力学函数值的估算,表明二氯乙烷在N型吸附剂上的吸附过程为可自发进行的放热过程。
汽油;氯化物;竞争吸附;吸附平衡
在原油开采及炼制过程中使用了含氯的化学助剂,导致原油及其馏分油中的有机氯化物含量超标,这些有机氯化物通常以氯代烃的形态存在,利用电脱盐装置难以脱除,将会随原油进入到下游的加工装置,在一定条件下发生热裂解或加氢反应,生成氯离子,危害石油加工的各个单元,如造成设备腐蚀、管线堵塞及催化剂中毒等[1-3]。
工业化吸附体系多为多种组分构成的混合物,这些多元体系的吸附平衡数据难以获得,因此可根据单一组分在吸附剂上的吸附程度不同,获得其吸附平衡数据,为吸附装置的设计提供指导。在原油开采及后续加工过程中常常加入含二氯乙烷的化学助剂[4],故选择二氯乙烷作为有机氯化物的模型化合物,考察模拟汽油体系中竞争组分与二氯乙烷的竞争吸附,并测定N型吸附剂对二氯乙烷的吸附等温线,对该吸附过程进行热力学分析,为吸附脱除油品中有机氯化物技术的开发提供指导。
1 实验部分
1.1 实验原料和仪器
实验药品:二氯乙烷,正辛烷,冰醋酸,环己烯,甲苯,环己烷,正庚烷,上述药品均为国药集团的分析纯试剂;自制的N型吸附剂和二次蒸馏水。
实验仪器:马弗炉(TCW,浙江余姚第二热工仪表厂),恒温水浴(SHJ-A,江苏省金坛市杰瑞尔仪器有限公司),微库仑滴定仪(KY-200,江苏姜堰科苑电子仪器有限公司),自动双重纯水蒸馏器(SZ-93,上海亚荣生化仪器厂)。
1.2 实验方法和内容
(1)竞争吸附
以环己烷、正庚烷和正辛烷作为模拟汽油中烷烃组分,以二氯乙烷作为有机氯化物的模型化合物建立烷烃类模拟汽油体系;以甲苯作为模拟汽油中芳烃组分,与正辛烷、二氯乙烷建立芳烃体积分数分别为 5%、10%和 20%的含芳烃类模拟汽油体系;以环己烯作为模拟汽油中烯烃组分,与正辛烷、二氯乙烷建立烯烃含量分别为 5%、10%和 20%的含烯烃类模拟汽油体系。以上模拟汽油体系中初始氯含量均为 30 不清 mg/L,在剂油质量比为 1:30、温度为 30 ℃的吸附条件下,分别考察烷烃、芳烃及烯烃对N型吸附剂脱氯性能的影响。以氯脱除率作为评价吸附剂脱氯性能的指标,计算公式如下:

式中:χ — 氯脱除率,%;
C0—模拟汽油中的初始氯含量,mg/L;
Ct—不同吸附时刻模拟汽油中的氯含量,mg/L。
(2)吸附等温线的测定
首先,以正辛烷和二氯乙烷建立初始氯含量10~480 mg/L 之间的模拟汽油体系;然后,将模拟汽油分别装入静态吸附装置中,恒温后加入相同质量的N型吸附剂,当吸附达到平衡后,取一定量的样品,利用微库仑滴定仪测量样品中的氯含量。N型吸附剂对二氯乙烷平衡吸附量的计算公式如下:

式中:Qe—吸附剂的平衡吸附量,mg/g;
C0—模拟汽油中的初始氯含量,mg/L;
Ce—吸附平衡时模拟汽油中的氯含量,mg/L;
m1—模拟汽油的质量,g;
m2—吸附剂的质量,g;
ρ —模拟汽油的密度,g/cm3。
以 Ce为横坐标,Qe为纵坐标作图,可得到模拟汽油体系中二氯乙烷在N型吸附剂上的吸附等温线。
2 结果与讨论
2.1 竞争组分对 N 型吸附剂脱氯性能的影响
汽油的组分复杂,按照碳碳键结合的方式可将其划分为烷烃、烯烃和芳烃类化合物,这些组分均可能与有机氯化物产生竞争吸附,从而影响吸附剂的吸附脱氯性能。为考察这种竞争吸附作用,建立了纯饱和烃(正辛烷、正庚烷和环己烷)、含芳烃(正辛烷含少量甲苯)及含烯烃(正辛烷含少量环己烯)三种类型的模拟汽油体系,考察烷烃、芳烃及烯烃三类化合物对N型吸附剂脱氯性能的影响,结果如图1所示。
由图1可知,在N型吸附剂上,模拟汽油中不同类型的烷烃类化合物对N型吸附剂的吸附脱氯性能无明显影响,在充足的吸附时间下均能取得较好的吸附脱氯效果;而烯烃和芳烃组分与二氯乙烷之间存在着强烈的竞争吸附,竞争吸附组分烯烃、芳烃的量越大,对二氯乙烷的吸附脱除就越不利,且烯烃要比芳烃对吸附剂的脱氯性能的负面影响更为显著。这表明汽油中的烯烃、芳烃与二氯乙烷在N型吸附剂相同的吸附中心上吸附,它们之间存在竞争吸附作用,进而导致N型吸附剂脱氯性能的下降。通过以上讨论,可以初步断定N型吸附剂对饱和烃为主要组分的直馏汽油具有较好的吸附脱氯性能,但对烯烃及芳烃含量相对较高的催化裂化汽油,将无法达到较好的吸附脱除有机氯化物的效果。

图 1 烷烃(a)、芳烃(b)及烯烃(c)对N型吸附剂脱氯性能的影响Fig.1 Effect of alkanes(a),aromatics(b) and olefins(c) on the dechlorination performance of N type of adsorbent
2.2 吸附等温线
吸附平衡是一种简捷的吸附剂评价方法,可依据吸附剂的平衡吸附量数据,对不同类型的吸附剂进行优选。吸附等温线被广泛用于表征吸附体系的平衡状态,将平衡吸附量与溶液中吸附质的平衡浓度作图即可得到液相吸附的等温线。
利用正辛烷和二氯乙烷建立初始氯含量 10~480 mg/L 之间的模拟汽油体系;分别选择吸附温度为 283.15、298.15 及 313.15 K,在剂油质量比为 1:100的条件下进行静态吸附脱氯实验,可得到二氯乙烷在N型吸附剂上的吸附等温线,如图2所示。
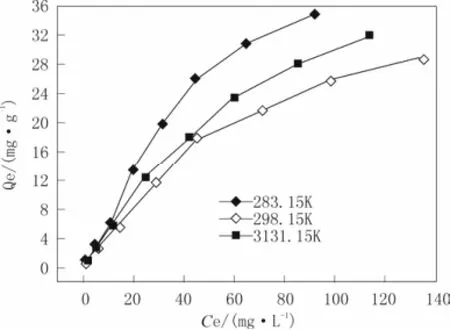
图 2 二氯乙烷在 N 型吸附剂上的吸附等温线Fig.2 Adsorption isotherms of dichloroethane on N type of adsorbent
由图2可以看出,随着模拟汽油体系中二氯乙烷平衡浓度的增加,N型吸附剂对二氯乙烷的平衡吸附量也随之增大。当二氯乙烷的平衡浓度升高到一定数值时,吸附剂的平衡吸附量趋于恒定值,此时可认为吸附剂已达到饱和,继续增大二氯乙烷的浓度也无法进一步吸附。这是因为在吸附剂加量不变的条件下吸附剂的吸附位数量有限,当二氯乙烷的初始浓度较低时,吸附剂可提供充足的活性吸附位用于二氯乙烷的吸附,因而吸附剂的平衡吸附量将会随着二氯乙烷浓度的增大而增加。当二氯乙烷的初始浓度较高时,吸附剂的活性吸附位则相对不足,吸附剂达到吸附饱和后将不能对体系中二氯乙烷进行吸附,因而对二氯乙烷的平衡吸附量几乎趋于恒定。此外,二氯乙烷在N型吸附剂上的吸附等温线为L型曲线,表明吸附质分子与活性吸附位间的作用力较强,且溶剂与其无竞争吸附作用。
根据实验测定的吸附等温线,分别采用Langmuir 和 Freundlich 吸附等温方程[5]进行拟合,方程分别如式(2)和(3)所示。


式中:Qe—吸附剂的平衡吸附量,mg/g;
Ce—吸附质的平衡浓度,mg/L;
Qmax—饱和的理论吸附量,mg/g;
KL—Langmuir常数,L/mg;
KF—与吸附剂种类、特性、温度及所采用单位有关的常数;
n—经验常数,与温度有关。
KL的大小与吸附剂、吸附质的性质及吸附温度有关,KL值越大,表明吸附剂对吸附质的吸附能力越强。而 KF一般为温度的函数,温度越高,KF值越小;n值的大小反映了吸附剂对吸附质吸附能力的强弱,与吸附质分子和吸附剂表面的作用强度有关。
此外,平衡参数 RL是 Langmuir 吸附等温方程的一个重要的无量纲参数,RL可表示为:

RL可用于判断吸附过程的性质:当 RL=0 时为不可逆吸附过程,当 0<RL<1 时对吸附有利,当 RL=1时则不利于吸附的进行[6]。
分别利用 Langmuir方程和 Freundlich 方程对二氯乙烷在N型吸附剂上吸附等温线进行拟合,结果如图3所示,拟合参数列于表1中。
对于 Langmuir型吸附等温方程,KL值 7.15~7.73之间,表示N型吸附剂对二氯乙烷具有较强的吸附能力,RL值在 0.21~0.94 之间,表明是有利于吸附进行的。而对于 Freundlich 型吸附等温方程,较高的KF值对应于吸附剂对吸附质具有较强的吸附能力,并且温度越低,KF值越大,表明吸附剂对吸附质的吸附能力越强;n值均大于1,表明在指定吸附条件下吸附剂对吸附质的吸附是有利的[7],即使在二氯乙烷浓度很低时,仍可将其吸附脱除至痕量。
与 Freundlich 型吸附等温方程相比,各温度条件下的 Langmuir 型吸附等温方程拟合的相关系数R2均较高而剩余标准差 s 均较低,故 Langmuir型吸附等温方程更适于描述二氯乙烷在N型吸附剂上的吸附过程。
2.3 吸附热力学计算
为了研究二氯乙烷在 N型吸附剂上的吸附机理,需对其吸附过程的热力学数据进行估算。通过在不同温度条件下N型吸附剂对二氯乙烷的吸附实验结果,可计算吸附过程的自由能变 、熵变 和焓变 ,计算式分别如式(5)和(6)所示:


根据上述公式,可对二氯乙烷在N型吸附剂上的吸附过程进行热力学计算。在计算过程中,利用了一个与 Van’t Hoffs 方程类似的假定[8],即在温度变化不太大的范围内,焓变及熵变与温度无关,计算结果如表2所示。

图 3 吸附等温线的 Langmuir(a)和 Freundlich(b)方程拟合Fig.3 The adsorption isotherm fitted by Langmuir (a) and Freundlich (b) adsorption isotherm equation

表 1 Langmuir 和 Freundlich 吸附等温线的拟合参数Table 1 The fitting parameters of Langmuir and Freundlich adsorption isotherms
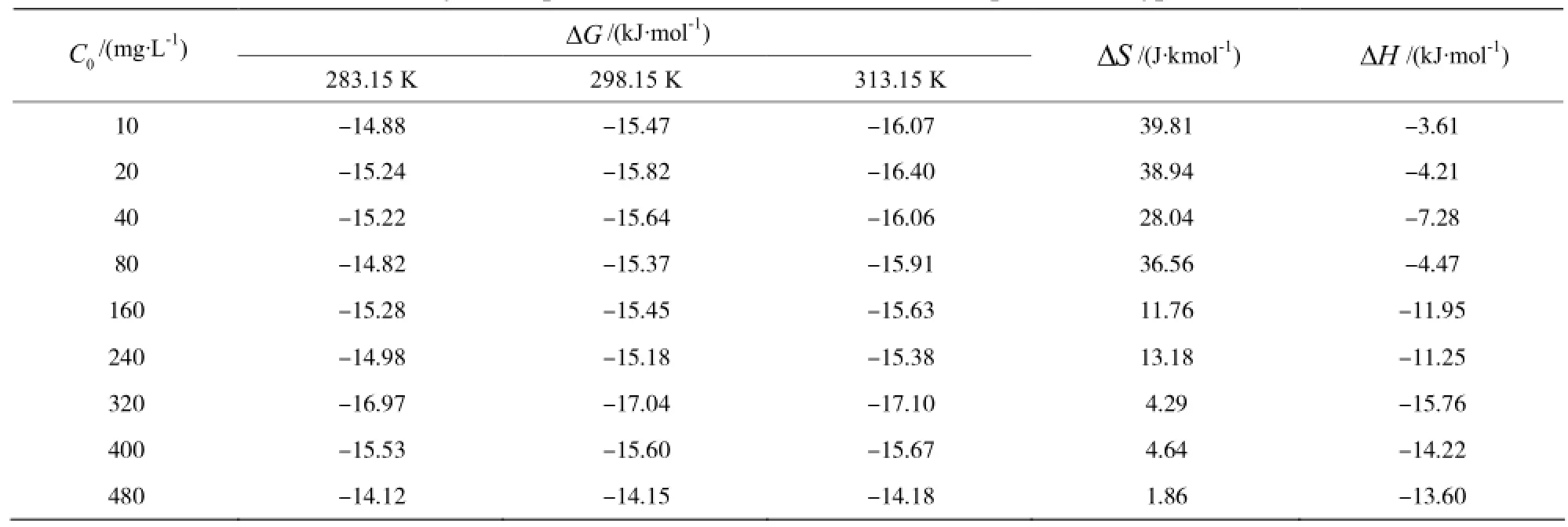
表 2 二氯乙烷在 N 型吸附剂吸附的热力学参数Table 2 Thermodynamic parameters of dichloroethane adsorption on N type of adsorbent
由表2中的数据可知,在实验条件下,二氯乙烷在N型吸附剂上的吸附焓变ΔH 均为负值,表明该吸附过程为放热过程,升温将不利于吸附的进行,吸附过程的焓变 ΔH 在-3.61~-15.76 kJ/mol之间,在氢键的键能范围内,因此可以推断该吸附过程除了范德华力外,还可能存在有氢键作用,但不会存在化学键力,据此可以推测该吸附过程为物理吸附。吸附过程的自由能变ΔG均为负值,表明在实验条件下,该吸附过程是可以自发进行的。
溶质分子在吸附剂上的吸附,将使其有序程度提高,自由度减小,是一熵值减小的过程,而溶剂分子从吸附剂活性吸附位上的脱附为熵值增大的过程,吸附过程的熵变ΔS 应为两者之和。一般来讲,ΔS >-10 J/mol·K 即表明在吸附过程中存在有脱附现象[9]。在本文的实验条件下,吸附过程的熵变 ΔS为正值,表明随着吸附的进行,体系的混乱度增大,由此可以推断在该吸附过程中,吸附质分子在吸附剂上吸附的同时还伴随有脱附现象的发生,进而导致吸附过程的总熵变ΔS为正。
3 结 论
(1)在 N 型吸附剂上,模拟汽油中的烯烃和芳烃组分与二氯乙烷存在着强烈的竞争吸附,竞争组分的量越大,对吸附剂吸附脱氯性能的负面影响就越大,且烯烃比芳烃对吸附剂吸附脱氯性能的负面影响更为显著。
(2)二氯乙烷在 N 型吸附剂上的吸附等温线属于 L 型吸附曲线,Langmuir吸附等温线方程可较好地描述该吸附过程。
(3)对二氯乙烷在 N 型吸附剂上吸附过程的热力学分析表明,二氯乙烷在N型吸附剂上的吸附过程为可自发进行的放热过程,且随吸附的进行,吸附体系的混乱度增大。
[1]何凤友.热脱氯技术在催化重整装置中的应用[J].炼油设计, 2000, 30(3): 55.
[2]石玉水.催化重整和柴油加氢装置的腐蚀分析及其防腐措施[J].石化技术与应用, 2007, 25(1): 22-25.
[3]黄晓文,黄蔼民,谢涛.柴油加氢装置高压换热器管束铵盐结晶原因分析及对策[J].炼油技术与工程, 2007, 37(4): 17-19.
[4]马永乐,李双刚. 加氢装置新氢系统铵盐堵塞原因及对策[J]. 当代化工, 2004, 33(6): 314-316.
[5]Fu F L, Xiong Y, Xie B P, etc. Adsorption of Acid Red 73 On Copper Dithiocarbamate Precipitate-Type Solid Wastes[J]. Chemosphere,2007, 66(1): 1-7.
[6]Arami M., Limaee N Y, Mahmoodi N M, etc. Removal of Dyes From Colored Textile Wastewater by Orange Peel Adsorbent: Equilibrium and Kinetic Studies[J]. Journal of Colloid and Interface Science, 2005, 288(2): 371-376.
[7]Guinaz O, Kaya A, Matyar F, etc. Sorption of Basic Dyes From Aqueous Solution by Activated Sludge[J]. Journal of Hazardous Materials,2004, 108(3): 183-188.
[8]耿信鹏. 用液/固吸附计量置换模型计算热力学函数变量[J].纺织高校基础科学学报, 1997, 10(2): 103-110.
[9]Scheckel K G, Sparks D L. Temperature Effects On Nickel Sorption Kinetics at the Mineral-Water Interface[J]. Soil Science Society of America Journal, 2001, 65(3): 719-728.
辽河石化沥青产品走出国门
5月18日,盘锦火车站装运沥青,这是辽河石化公司准备运往蒙古国的沥青产品。此次,辽河石化公司沥青将应用在蒙古国的2个项目。
据了解,自 2012 年 8 月,辽河石化公司通过与中国石油国际事业有限公司合作,沥青产品成功打入蒙古国市场以来,已累计向蒙古国出口沥青近2万吨。
辽河石化公司是集团公司重要的沥青生产基地,沥青产品成功打入蒙古国市场,既支持了蒙古国经济建设,也为中国石油的沥青销售拓展了新的渠道。辽河石化公司还向朝鲜销售了 900 吨 AB—90 机场用石油沥青。
Competitive Adsorption and Adsorption Equilibrium of Dichloroethane on N Type of Adsorbent
ZHAO Xiang-miao, ZHU Jian-hua, TIAN Jun, WANG Qi, XU Wei-wei, YANG Mei, YIN Xing
(1. China Petroleum Engineering Co., Ltd. North China Company, Hebei Renqiu 062552, China; 2. China University of Petroleum, Beijing 102249, China; 3. Jinmei Jinshi Chemical Investment Group Co.,Ltd.,Hebei Shijiazhuang 050041, China)
The investigation was carried out for the competitive adsorption and adsorption equilibrium of dichloroethane on N type of adsorbent in the model gasoline system. The experimental results indicated that there was strong competitive adsorption between the olefins, aromatics and dichloroethane in the model gasoline, which could seriously affect the dechlorination performance of N type of adsorbent. Besides, the adsorption isotherm of dichloroethane on N type of adsorbent could be preferably fitted by Langmuir adsorption isotherm equation. Finally, the calculation results of the thermodynamic parameters demonstrated that the adsorption process of dichloroethane on N type of adsorbent was an exothermic one, and could proceed spontaneously.
Gasoline; Chloride; Competitive adsorption; Adsorptive equilibrium
TQ 028
: A文献标识码: 1671-0460(2014)07-1149-04
2014-06-24
赵向苗(1985-),男,河北任丘人,助理工程师,硕士,2012 年毕业于中国石油大学(北京)化学工程专业,研究方向:油气储运设计工作。E-mail:zhaoxiangmiao@126.com。
