黄葵胶囊中间体稠膏不同干燥方法的对比研究
2014-04-11刘汉清唐海涛
刘 霖, 刘汉清*, 刘 嘉, 王 进, 唐海涛, 张 平
(1.南京中医药大学, 江苏 南京 210046; 2.江苏建康职业学院,江苏 南京 210029;3.江苏苏中药业集团股份有限公司, 江苏 姜堰 225500)
黄葵胶囊中间体稠膏不同干燥方法的对比研究
刘 霖1, 刘汉清1*, 刘 嘉2, 王 进1, 唐海涛3, 张 平3
(1.南京中医药大学, 江苏 南京 210046; 2.江苏建康职业学院,江苏 南京 210029;3.江苏苏中药业集团股份有限公司, 江苏 姜堰 225500)
目的 优选黄葵胶囊中间体稠膏的干燥方法,为其产业化提高产品质量和生产效率提供依据。方法 以芦丁、金丝桃苷、异槲皮苷、杨梅素和槲皮素的干燥前后转移率为评价指标,结合干燥时间、物料的外观性状,综合比较真空带式干燥、刮板干燥及减压干燥的效果。结果 真空带式干燥、刮板干燥和真空减压干燥中,芦丁干燥转移率分别为 89.63% ~93.05%、 80.05% ~80.27%、 69.21% ~73.11%, 金丝桃苷干燥转移率为 94.11% ~94.69%、 78.98%~80.23%、 68.41% ~70.02%, 异槲皮苷干燥转移率为 94.53% ~94.70%、 82.22% ~82.55%、 75.24% ~75.51%,杨梅素干燥转移率为 93.48% ~94.19%、 71.45% ~72.21%、 53.16% ~55.69%, 槲皮素干燥转移率为 93.07% ~96.32%、 90.61% ~92.08%、 72.16% ~85.72%。 结论 无论干燥物的外观性状, 还是指标成分的转移率, 真空带式干燥均优于刮板干燥和真空减压干燥。真空带式干燥是黄葵胶囊中间体稠膏干燥产业化宜选用的方法。
黄葵胶囊;中间体稠膏;干燥方法
黄葵胶囊具有抗炎[1-2]和抑菌作用, 能抗血小板聚 集,调节免疫[3-4], 抗氧 化 和消除氧自由基[5], 抗 肾 小 球 免 疫炎症反应, 消除循环免疫复合物, 利 尿和降 低尿蛋白[6-8],保护肾小球和肾小管功 能[9-11]等作用。 临床广泛 应用于慢性肾炎治疗等, 疗效确切[12-13]。 干燥是黄葵胶囊制备过程中的重要工艺。本实验比较研究真空带式干燥、刮板干燥及减压干燥对其中间体稠膏的干燥效果,为其产业化提高产品质量和生产效率提供依据。
1 设备与试药
1.1 设备 MTVBD01-04-01 真 空 带 式 干 燥 机 ( 上 海 朗 脉科技有限公司); GT-800 刮板干燥机 (常州市武干干燥设备有限公司); FZG-15 型真空干燥机 ( 常州宇通干燥设备有限公司) ; Dionex ultimate 3000 高效液相色谱仪 ( 美国戴安公司); RE-2000E旋转蒸发器 (郑州市亚荣仪器有限公司); HH-4 型数显恒温水浴锅 (金坛市富华仪器有限公司); 电子分析天平 (METTLER TOLEDO, d=0.01 mg);LC-300B型超声波清洗器 ( 山东济宁鲁超); BS-6KH电子天平 (上海友声衡器有限公司制造); SHZ-D ( Ⅲ) 循环水式真空泵 (巩义市予华仪器有限责任公司)。
1.2 试药 芦丁对照品 (100080-200707)、 金丝桃苷对照品 ( 111521-201004)、 槲 皮 素 对 照 品 ( 100081-200907 ),均供含量测定用,购自中国食品药品检定研究院 (纯度≥97.0%); 杨梅 素对 照 品 (201008)、 异 槲 皮 苷 对 照 品(201010), 均供含量测定用, 购自四川维克奇生物科技有限公司 (纯度≥98%)。
黄葵胶囊中间体稠膏 3 批, 批号 20120903 (相对密度1.27, 60 ℃), 批号 20120912 (相对密度 1.26, 60 ℃),批号 20120928 (相对密度 1.27, 60 ℃); 乙腈为色谱纯;水为重蒸馏水,磷酸等试剂均为分析纯。
2 方法和结果
2.1 不同方法干燥条件
2.1.1 带式真空干燥 称取黄葵胶囊中间体稠膏 2 kg, 置于真空带式干燥机中,设定加热水温度前区、中区、后区,冷却区分别为: 120 ℃、 120 ℃、 90 ℃、 25 ℃, 干燥面温度约为 70 ℃, 真空度为 12 ~15 mbar(1 mbar=100 Pa),干燥至物料含水为 5% ~6%时停止。
2.1.2 刮板干燥 称取黄葵胶囊中间体稠膏 2 kg, 置于刮板干燥机中, 设定刮板加热温度为 152 ℃, 压力为 0.6 MPa, 干燥至物料含水为 5% ~6%时停止。
2.1.3 减压干燥 称取黄葵胶囊中间体稠膏 2 kg, 置于真空减压干燥机中, 设定加热温度为 70 ℃, 真空度 -0.08 MPa, 干燥至物料含水为 5% ~6%时停止。
2.2 芦丁、 金丝桃苷、 异槲皮苷、 杨梅素及槲皮素测定方法[14]
2.2.1 对照品溶液的制备 按文献 [5] 方法制备即得含芦丁0.031 2 mg/mL、 金丝桃苷0.118 3 mg/mL、 异槲皮苷0.088 0 mg/m L、 杨 梅 素 0.037 2 mg/m L、 槲 皮 素 0.011 0 mg/mL的混合对照品贮备液。 将制得的混合对照品贮备液逐级稀释制得浓度分别为初浓度 1/1、 1/2、 1/4、 1/8、 1/ 10、 1/16 的系列混合对照品溶液。
2.2.2 样品溶液制备 称取不同干燥方法的待测样品约1.15 g, 精密称定, 置 50 mL量瓶中, 加 70%乙醇约 40 mL, 超声 30 min, 放至室温, 用 70% 乙醇定 容, 摇匀,再精密量取 1 mL至 25 m L量瓶中, 70%乙醇定容至刻度,溶液过 0.45 μm微孔滤膜, 取续滤液即得。
2.2.3 色谱 条 件 Thermo scientific Hypersil GOLD色谱柱(250 mm×4.6 mm, 5 μm); 流动相为乙腈 ( A) -0.2%磷酸水 ( B), 采 用 梯 度 洗 脱 ( 0 ~10 min, 90% ~87%B;10 ~20min, 87% ~84%B; 20 ~65 min, 84% ~75%B;65 ~70 min, 75% ~90%B) ; 体积流 量 0.8 mL/min; 检测波长 360 nm; 柱温 30 ℃; 进样量 10 μL。 色谱峰记录时间为 70 min。 在此色谱条件下, 对照品及成品各峰分离度均良好 (见图1)。

图1 对照品 (A) 及稠膏 (B) HPLC图
2.2.4 线性关系考察 分别精密吸取 “2.2.1” 项下制得的系列混合对照品溶液适量,在本实验色谱条件下,各质量浓度对照品溶液分别进样 10.0 μL。 以质量浓度 μg/mL(X) 为横坐标, 峰面积值 A(Y) 为纵坐标进行线性回归,5种待定量的物质,峰面积与质量浓度呈线性关系,回归方程、 相关系数及线性范围结果见表 1。 结果表明各成分在各自质量浓度范围内线性关系良好。
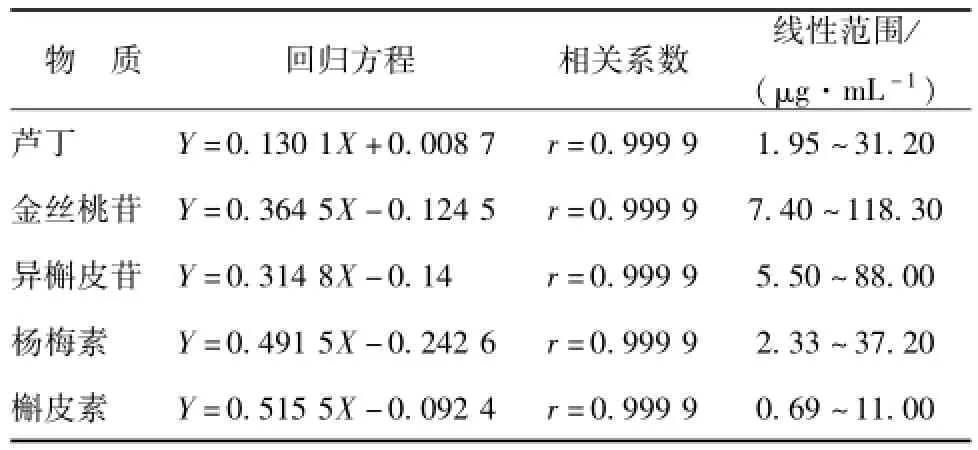
表1 不同物质的回归方程、 相关系数及线性范围
2.2.5 方法学考察 精密量取 “2.2.2” 项下制得的样品溶液一份,连续进样6次,以峰面积计算各指标成分的RSD, 考察方法的精密度, 结果 5 种成分的 RSD均小于1.8%; 精密量取同一批号的样品 6 份, 按照 “2.2.2” 项下方法制备样品溶液,进样测定,以峰面积计算各指标成分的 RSD, 考察方法的重复性, 结果 5 种成分的 RSD均小于 4.0%; 取 “2.2.2” 项下制备的样品溶液一份, 分别于0、 2、 4、 8、 12、 24 h 检测, 以峰面积计算各指标成分的RSD, 考察方法的稳定性, 结果 5 种成分的 RSD均小于4.3%。 结果表明该方法的精密度, 重复性, 稳定性均符合要求。
取同一批次已知含有量的黄葵胶囊干浸膏6份,各取 0.5 g, 精密称定, 分别精密加入一定量的芦丁、 金丝桃苷、异槲皮苷、杨梅素、槲皮素对照品,按“2.2.2” 项下方法制备供试液, 按上述色谱条件分别进样 10 μL进行分析, 记录各色谱峰峰面积, 计算加样回收率, 结果见表2。
2.3 结果 对 3 种干燥方式的干燥时间和物料外观性状进行比较, 结果见表 3; 按照 “2.2.3” 项下色谱条件对 3 组样品 (各3批) 中指标成分分别进行定量测定, 并计算各成分的干燥前后转移率 (干燥前后转移率 =样品中指标成分的含有量/稠膏中指标成分的含有量 ×100%), 结果见表4。
3 讨论
3.1 本研究采用的 3 种方法的干燥条件均为经正交试验筛选的结果。在进行真空带式干燥最优工艺验证时,所得干浸膏的水分质量分数稳定在 5% ~6%, 经考察, 此水分质量分数适合后续的湿法制粒,因此将其定为干燥工艺干燥终点判定指标。
3.2 5 种指标性成分经真空带式干燥后含有量高于刮板干燥和真空减压干燥。分析认为这是因为刮板干燥温度高达150 ℃以上, 使物料中指标性成分受到破坏。 真空减压干燥时间较长,不但效率低,对指标成分也有影响。真空带式干燥过程温度较低且时间较短,因而指标性成分损失小,物料外观性状好,能最大程度地保证浸膏的质量;还可与粉碎设备联成一体,干燥物料可直接粉碎,既减少了操作环节,有利于防止吸湿,且因均在密闭条件下进行,也有利药剂卫生。本研究的结果表明,真空带式干燥是一种适合中药浸膏的新型干燥方法,也是一种值得推广的适合工业化生产的高效的干燥技术。
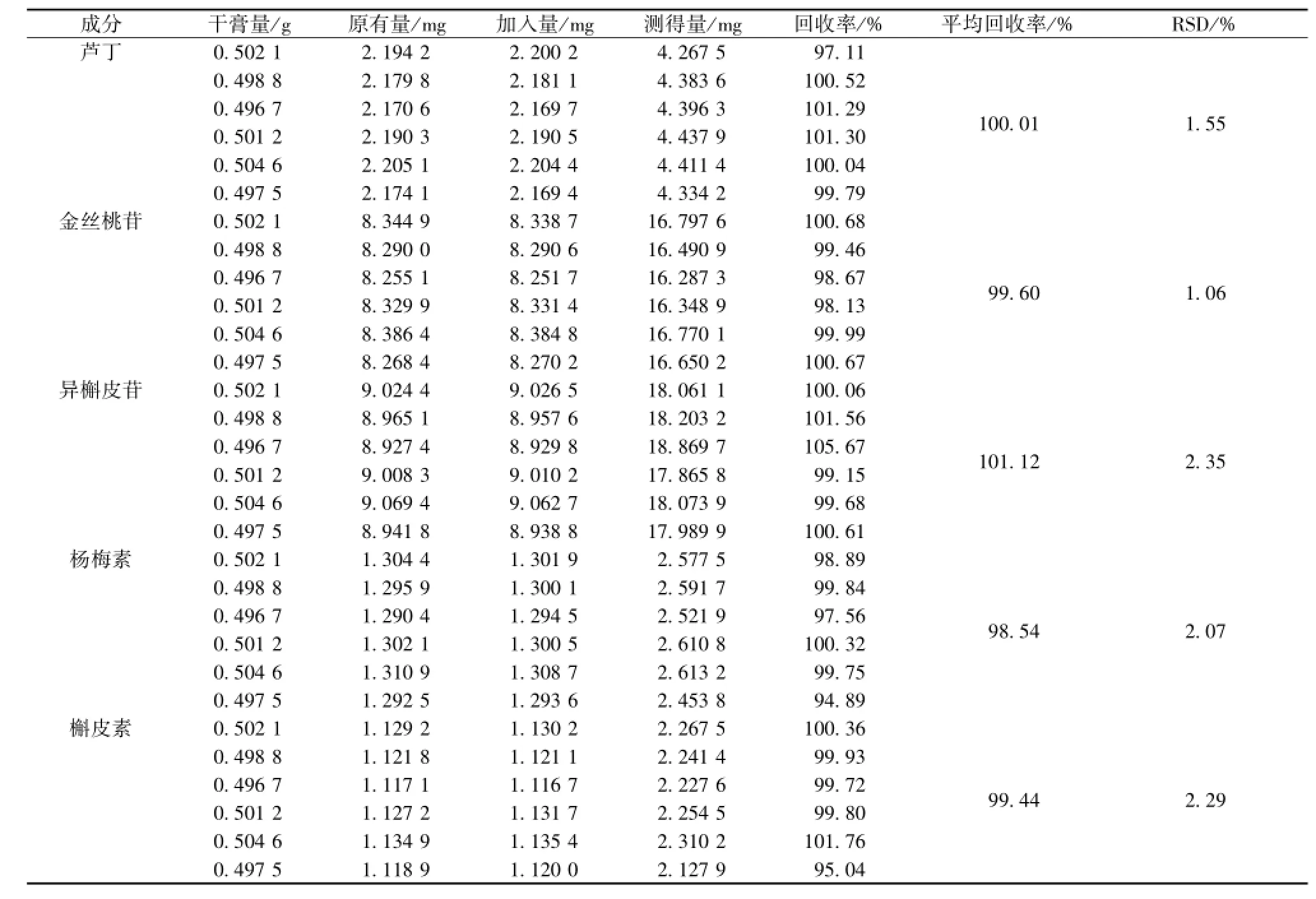
表 2 加样回收率试验 (n=6)

表 3 不同干燥方法的干燥时间和物料外观性状 (n=3)
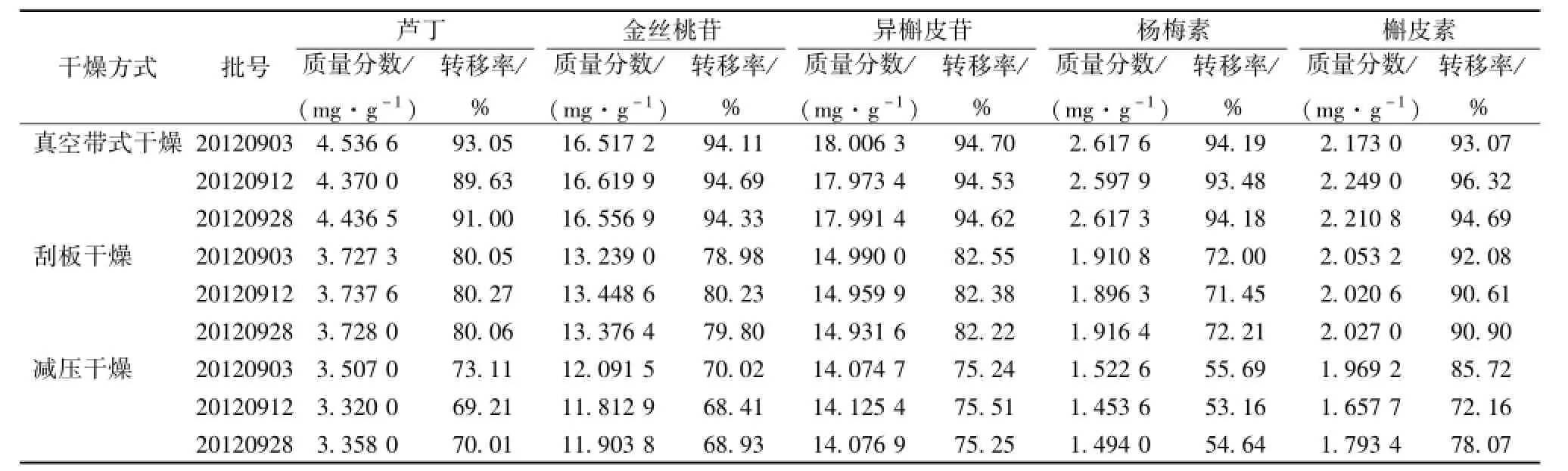
表 4 不同干燥方法指标性成分的质量分数和干燥前后转移率 (n=3)
参考文献:
[1] 崔 桅,陈玉兰,王玉亮.黄蜀葵花提取物对人中性粒细胞活化 及 分 泌 IL-8 的 影 响 [ J]. 天 津 药 学, 2003, 15(4): 1.
[ 2 ] 张清德, 曲忠森.黄葵胶囊对慢性肾脏病患者血清 SOD、MDA、 ET、 NO及尿蛋白的影响[J].中国中西医结合肾病杂志, 2010, 11(6): 544.
[3] 胡翠云,戴 敏,陈君君,等.黄蜀葵花总黄酮对大鼠湿热型慢性肾炎的作用及其对红细胞免疫黏附功能的影响[J].安徽中医学院学报, 2011, 30(1): 57.
[4] 谢 华,林洪丽, 陈淑妮, 等.黄葵胶囊联合免疫抑制剂治疗激素抵抗肾病综合征的临床研究[J].中国中西医结合肾病杂志, 2010, 11(12): 1106.
[ 5 ] Yokozawa T, Dong E, Kawai Y, et al.Protective effects of some flavonoids on the renal cellularmembrane[ J] .Exp Toxicol Pathol, 1999, 51 (1) : 9-14.
[6] 陈万欣,胡晓燕, 张志民, 等.黄葵胶囊治疗原发性肾病综合征 30 例[ J].南京中医药大学学报, 2012, 28 (3):289-291.
[7] 刘 洪,钟陵云,李荣亨.黄葵胶囊治疗糖尿病肾病的疗效观察和机制探讨[J].中国中西医结合肾病杂志, 2010, 11(7): 633.
[ 8 ] 王丽萍, 张 勇, 陈 建, 等.黄葵胶囊治疗 IgA肾病湿热证蛋白尿的临 床观察[J].中成药, 2010, 32 (1):18-21.
[9] 尹莲芳, 刘 璐,弓玉祥, 等.黄蜀葵花对肾病综合征模型大鼠肾小管损伤保护作用的研究[J].首都医科大学学报, 2000, 21(3): 209.
[10] 尹莲芳, 濮家伉, 弓玉祥, 等.黄蜀葵花对阿霉素肾病大鼠钠潴留改善作用的机制[ J].中华肾脏病杂志, 1999,15(5): 324.
[11] 高 菁, 李 靖, 秦 英.黄葵胶囊对早期慢性肾脏病肾小管功能的疗效观察 [J].中国中西医结合肾病杂志,2010, 11(5): 455.
[12] 胡翠云, 戴 敏, 陈君君, 等.黄蜀葵花总黄酮对大鼠湿热型慢性肾炎的作用及其对红细胞免疫黏附功能的影响[ J].安徽中医学院学报, 2011 , 30(1) : 57-60.
[13] 顾海东, 马西臣, 谭玉利, 等.黄葵胶囊对慢性肾病患者血清 Cystatin C、 hs-CRP[ J] . 中 国 当 代 医 药, 2011, 18(14): 11-13.
[14] 刘 霖, 唐仁茂, 刘汉清, 等.黄葵胶囊指纹图谱的建立及其在质量控制中的应用[J].中国药学杂志, 2013, 48(8): 533.
R284.2
: B
: 1001-1528(2014)01-0195-04
10.3969/j.issn.1001-1528.2014.01.051
2013-02-06
江苏省重点科研成果产业化项目 (BA2012131)。
刘 霖 (1989—) , 女, 硕士生, 从事中药新剂型新工艺新技术研究。 Tel: 15052854940, E-mail: liulin198951@126.com
*通信作者: 刘汉清, 男, 教授, 博士生导师, 从事中药新剂型新制剂新工艺新技术研究。 Tel: (025) 86595018, E-mail: hqliu636@ yahoo.com.cn
