基于液相色谱-飞行时间质谱联用和质量亏损过滤技术的黄葵黄酮类成分系统分析
2020-02-29高芯万瑶瑶李长印段徐彬丁选胜居文政
高芯 万瑶瑶 李长印 段徐彬 丁选胜 居文政


摘 要 采用液相色谱-飞行时间质谱联用(High-performance liquid chromatography time-of-flight mass spectrometry,LC-TOF-MS)分析黄葵总黄酮(Total flavones of Abelmoschus manihot L. Medic,TFA)提取物,采集其正负离子模式下的LC-TOF-MS分析数据。借助质量亏损过滤(Mass defect filter,MDF)技术提取原始数据中黄酮类相关特征离子,通过TOF-MS精确分子量归属各离子的元素组成及离子类型,根据元素组成和离子类型的相关性合并可能源自同一个化合物的准分子离子和碎片离子,依据不少于2个准分子离子的出现筛选确认目标化合物。借助标准品比对、 文献查阅、 数据库搜索等手段解析选定的目标化合物的母离子和子离子图谱,对其结构进行鉴定或合理归属。最终从TFA中筛选并初步鉴定出49种黄酮类化合物。鉴定结果表明, TFA中黄酮类化合物的形成主要涉及糖基化、 甲基化、 甲酰化、 乙酰化和葡萄糖醛酸化等转化反应。本研究丰富了对黄葵化学物质基础的认识,可为全面评价黄葵制剂质量、 深入开展黄葵药效学研究提供重要参考; 同时也表明LC-TOF-MS分析结合MDF技术是一种适用于中药化学成分的系统筛选方法。
关键词 黄葵; 黄酮; 液相色谱-飞行时间质谱; 质量亏损过滤; 成分系统筛选; 结构鉴定
1 引 言
中药黄蜀葵花为锦葵科秋葵属植物黄蜀葵(Abelmoschus manihot L. Medic)的干燥花,在《嘉佑本草》和《中华本草》中均有记载,其味甘、 辛,性凉,入肺、 肾、 膀胱经,有清利活血、 消肿解毒之功效,用于治疗淋病及痈疽肿毒。黄葵胶囊为黄蜀葵花的特色中药制剂,临床上广泛用于慢性肾病、 糖尿病肾病等疾病的治疗,疗效确切且安全性良好[1~3]。研究表明,黄酮类成分为黄葵胶囊和黄蜀葵花的主要化学成分和药效活性成分[4~9]。
全面了解黄葵制剂中黄酮类成分的化学结构信息,是阐明黄葵药效物质基础、 评价黄葵相关制剂质量和安全性的前提和基础。液相色谱-飞行时间质谱联用(Liquid chromatography-time-of-flight mass spectrometry,LC-TOF-MS)技术结合了液相色谱高效的分离能力及质谱高分辨率、 高质量精度的检测能力,非常适用于中药复杂化学成分的系统定性分析[9,10]。但是,LC-TOF-MS分析会产生复杂多维的研究数据,解析这些数据对于研究者是很大的挑战。近年来,质量亏损过滤(Mass defect filtering,MDF)技术作为处理TOF-MS等高分辨质谱数据的新方法[11],已被证明非常适用于中药化学成分的定性分析,特别是对某一类型(如黄酮、 皂苷等)化学成分的全面筛选和提取[12~16]。另一方面,各种开源和商业的化合物数据库则为中药化学成分的结构鉴定提供了极大便利。如AB Sciex和Agilent等仪器公司近期先后推出了与仪器配套的中药高分辨质谱数据库; 而PubChem、 ChemSpider等开源数据也在不断丰富和完善中。参考上述数据库,结合化学标准品比对和裂解规律解析,可以对筛选所得的中药材化学成分进行合理的结构解析和归属。基于此,本研究首先对黄葵总黄酮(Total flavones of Abelmoschus manihot,TFA)提取物进行LC-TOF-MS数据采集; 而后根据文献报道[4~9],建立筛选黄葵黄酮类化合物的MDF方法,全面提取LC-TOF-MS分析数据中的黄酮类化合物相关离子; 然后结合母离子的共存在,系统筛选确认TFA中存在的黄酮类化合物; 最后,参考标准品比对及其特征离子解析、 AB Sciex中药高分辨质谱数据库、 PubChem等网络数据库,对筛选所得化合物进行结构鉴定或合理归属,以期全面表征黄葵中所含有的黄酮类化合物的种类和存在形式。
2 实验部分
2.1 仪器与试剂
LC(美国Agilent公司)-Triple TOFTM 5600液相色谱-质谱联用仪(美国AB公司),配有PeakView version1.2数据处理软件和质谱自动校准调谐系统(CDS); CPA225D电子天平(德国Sartorius公司); Thermo Sorvall Legend Micro 17R离心机(美国Thermo公司); WH2微型旋涡混合仪(上海沪西分析仪器厂); Millipore Milli-Q Advantage A10超纯水系统(Milli-Q公司)。
甲醇和乙腈(HPLC级,德国Merck公司); 甲酸、 甲酸铵(质谱级,瑞士Fluka-Sigma-Aldrich公司); TOF-MS正离子调谐液(美国AB Sciex公司),批號4460131; TOF-MS负离子调谐液(美国AB Sciex公司),批号4460134; 化学对照品共8个,分别为: 芦丁(Rutin,批号B20771,上海源叶生物科技有限公司)、 金丝桃苷(Hyperoside,批号B20631,上海源叶生物科技有限公司)、 棉皮苷(Gossypin,批号B29264,上海源叶生物科技有限公司)、 棉皮素-8-O-β-D-葡萄糖醛酸(Gossypetin-8-O-β-D-glucuronide,批号ZES-1364S,法国EXTRASYNTHESE公司)、 棉皮素(Gossypetin,批号ZES-1176,法国EXTRASYNTHESE公司); 杨梅素(Myricetin,批号B21458,上海源叶生物科技有限公司)、 异槲皮素(Isoquercitrin,南京泽朗医药科技有限公司)、 槲皮素(Quercetin,批号13072505,购自成都曼思特生物科技有限公司)。
TFA提取物工艺简述如下: 黄蜀葵花药材先以60%乙醇回流提取,醇提液减压浓缩,得到不含醇的水提液; 而后将水提液用乙酸乙酯萃取,收集乙酸乙酯萃取液,在旋蒸仪上减压浓缩,并将所得物干燥粉碎,得粉末状TFA提取物,其含量以总黄酮计>60%。
2.2 实验方法
2.2.1 样品处理 准确称取TFA提取物20 mg, 溶于10 mL 70% 甲醇中, 制成母液, 取1 mL母液稀释10倍, 涡旋混匀, 在4℃以12000 g离心5 min, 取5 μL上清液进样分析。
准确称取8个对照品适量, 以甲醇溶解并稀释至适当浓度, 等量混合, 制备混合标准溶液, 混合标准溶液中各化合物的终浓度均约为100 ng/mL。取5 μL上清液进样分析。
2.2.2 色谱-质谱条件 AgilentPoroshell 120 SB-C18色谱柱(100 mm×3.0 mm, 2.7 m); Agilent Poroshell 120 SB-C18預柱(5 mm ×3.0 mm, 2.7 m); 流动相A为水+5 mmol/L甲酸铵+0.1%甲酸+0.1%甲醇, 流动相B为乙腈-水(9∶1,V/V)+5 mmol/L甲酸铵+0.1%甲酸。梯度洗脱程序: 0~0.5 min, 5% B; 0.5~12 min, 5%~100% B; 12~16 min, 100% B; 16~16.1 min,100%~5% B; 16.1~22 min, 5% B。流速为300 L/min, 柱温为35℃, 进样体积5 L, 进样室温度为8℃。
电喷雾离子源以正负离子模式采集数据, TOF-MS扫描模式参数设置如下: 分子量扫描范围m/z 100~1000, 累积时间0.250015 s; 离子化温度(TEM): 550℃; 雾化气(GS1): 60 psi (1 psi=6.895 kPa); 辅助加热气(GS2): 60 psi; 气帘气(CUR): 35 psi; 去簇电压(DP): 80 V; 碰撞能量(CE): 10 eV; 正负离子模式下喷雾电压(ISVF)分别为5500 V和4500 V。采用信息关联采集(Information dependent acquisition, IDA)、 智能化的动态背景扣除(Dynamic background subtraction, DBS)和高灵敏度的模式采集数据。主要的IDA转换标准如下: 信号强度大于500 cps, 4 Da以内排除同位素, 分子量误差50 mDa, 每个循环最多监测8个候选离子。子离子扫描模式的参数设置如下: 分子量扫描范围m/z 50~m/z1000, 累积时间0.100006 s; CE: (35±15) eV; 其它主要参数同TOF-MS扫描模式。采用AB公司的调谐液传递系统(CDS)对分子量准确度进行自动校准。通过AB公司的软件Analyst TF 1.6.2 software控制仪器操作和数据采集。
2.2.3 黄葵黄酮类化合物的MDF筛选和鉴定 首先,根据文献[4~9]报道构建黄葵中黄酮类化合物的分子式数据库,通过PeakView软件(AB Sciex公司,Version 1.2)的Mass Calculator功能计算得到该类化合物的7种常见准分子离子(正离子模式下的[M+H]+、 [M+Na]+和[M+NH4]+,负离子模式下的分子量和质量亏损范围,详见表1。
在此基础上,引入适当的允许误差,设定合适的分子量和质量亏损范围,对LC-TOF-MS原始数据进行黄酮类相关特征离子的MDF过滤。通过PeakView的IDA Explorer功能从MDF过滤后的数据中提取可产生子离子的特征离子。结合前期研究[15,16],初设离子信号强度下限分别设为12000 cps(正离子模式)和7000 cps(负离子模式)。
利用PeakView的Formula Finder功能对筛选所得目标离子的元素组成进行预测。其中,碳氢氧原子数目和不饱和度的范围设定如表1所示,分子量最大允许误差10
5,正离子模式下氮、 钠和钾原子0~1个; 负离子模式下氮、 氯原子0~1个。
采用XIC Manager功能提取筛选所得的目标离子,以检验其峰形完整性,确认其准确保留时间; 根据保留时间和TOF-MS提供的精确分子质量的匹配度,合并源自一个化合物的多个特征准分子离子(如正离子模式下的[M+H]+、 [M+Na]+、 [M+K]+、 [M+NH4]+,及负离子模式下的[M-H]
、 [M+HCl-H]
、 [M+HCOOH-H]
、 [M+HNO3-H]
等),通过至少两个准分子离子的存在确认每个化合物的存在。同时通过XIC提取,确认锁定的化合物并补充其同分异构体。
借助标准品比对、 文献报道和PubChem等数据库检索,解析IDA Explorer提供的子离子信息,对筛选得到的目标化合物进行初步鉴定。
3 结果与讨论
3.1 化合物筛选方法的确定
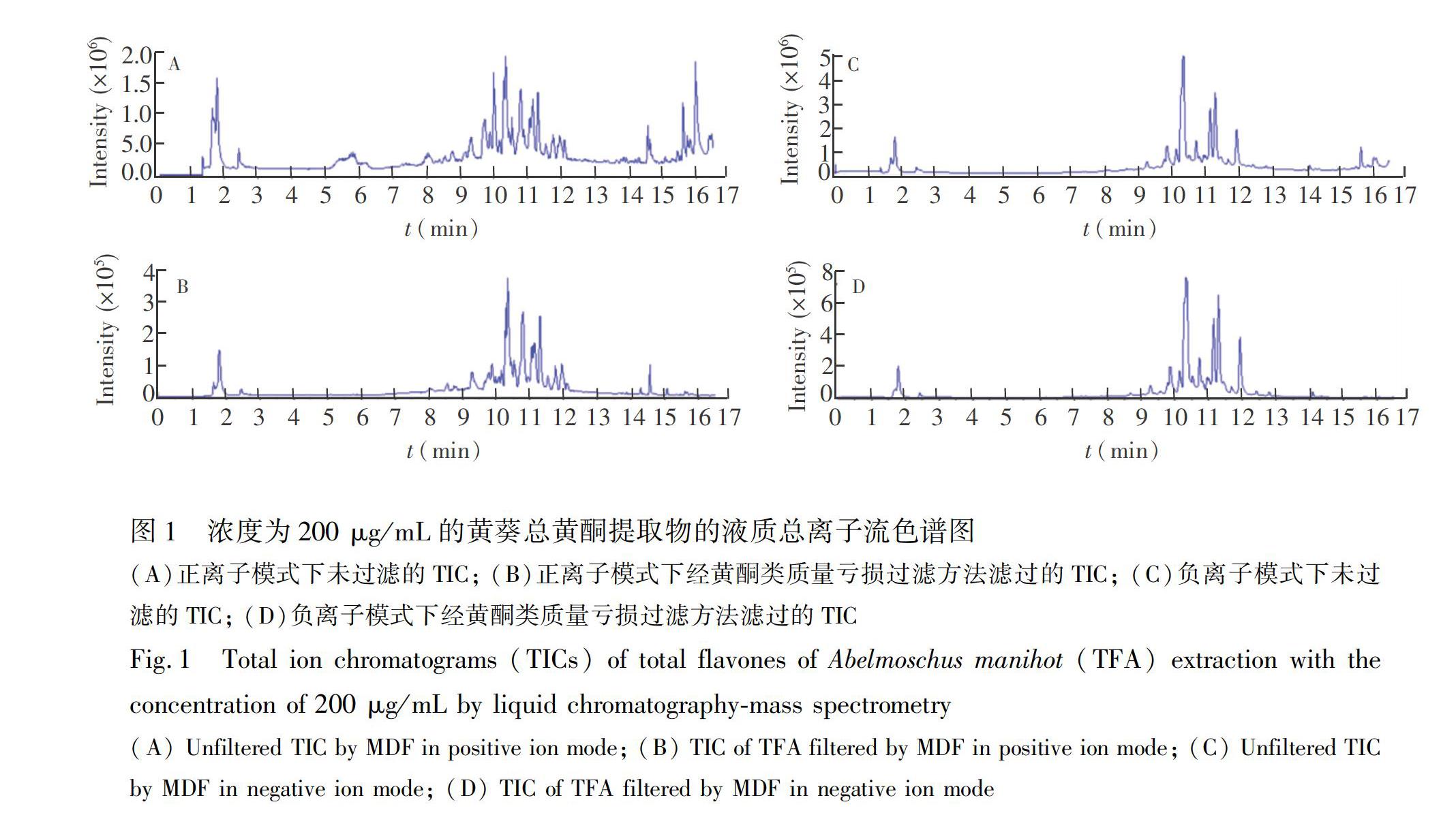
质量亏损和分子量筛选范围的设定依据为已有文献报道的黄葵黄酮类化合物。汇总文献[4~9]中相关信息可知,已知的黄葵相关黄酮类化合物共涉及到32个不同的分子式。借助Peakview软件的Mass calculator功能计算获得32个分子式的各种准分子加合离子包括正离子模式下[M+H]+、 [M+NH4]+和[M+Na]+及负离子模式下[M-H]
、 [M+HCOOH-H]
、 [M+HNO3-H]
和[M+HCl-H]
的精确分子质量,构建相应的黄葵黄酮类化合物加合离子数据库。其中,加合离子的选择主要依据前期研究和文献报道[4~9,15,16]而定。此数据库中包括了各化合物正负离子模式下质量亏损、 分子量、 分子组成及不饱和度的最大值和最小值,在此基础上,引入适当的允许误差,即可得到本研究中所设定的MDF和Formula finder的相关参数(表1)。MDF过滤前后TFA提取物总离子流色谱图(TIC)的对比如图1所示,经MDF过滤后的TIC基线更加平稳,而黄酮类化合物对应的色谱峰也得到了增强。理论上,凡是质量亏损落在设定范围内的信号离子均应作为黄酮类相关离子被筛选出来,进行进一步研究,而本研究设定了只筛选能产生子离子且信号强度在12000 cps(正离子模式)或7000 cps(负离子模式)以上的黄酮相关离子,以集中发现提取物中相对含量较高的黄酮类化合物。在锁定目标化合物后,通过提取目标化合物的提取离子流色谱图(XIC),确认目标化合物的存在; 同时,根据XIC图谱确认补充了一些丰度较大,但低于初筛阈值(即12000 cps或7000 cps)的同分异构体。
3.2 筛选结果
从TFA中共筛选出49种黄酮类化合物(見电子版文后支持信息表S1),各个黄酮类成分均存在2个以上的准分子离子, 进一步证明了筛选结果的可靠性; 各种准分子离子类型出现的频率从高到低依次为: [M-H]
(49次)>[M+H]+(41次)>[M+HNO3-H]
(37次)>[M+Na]+(27次)>[M+HCl-H]
(21次)>[M+HCOOH-H]
(13次); 其中,化合物C5、 C11、 C26、 C47、 C48和C49为根据锁定化合物的[M-H]的XIC图谱补充的丰度较高但小于7000 cps的黄酮类化合物。由于所有化合物都可产生[M-H],本研究给出了所有化合物此离子的峰强度信息,以初步提供各个化合物的相对含量信息。
3.3 筛选化合物的鉴定
黄酮类化合物的鉴定主要依据标准物质比对、 标准物质子离子色谱图的特征诊断离子比对、AB sciex中药高分辨质谱数据库搜索、 化合物元素组成与已报道的黄酮类化合物间的联系,以及PubChem等网络数据库的搜索匹配。为了提高鉴定的准确度,并为类似结构化合物的鉴定提供参考,在同样的LC-MS分析条件下分析了8种黄葵中常见的黄酮类标准品。通过保留时间和TOF-MS及TOF-MS/MS图谱比对,发现它们在TFA提取物中均可作为丰度比较高的色谱峰而被检测得到,分别为Rutin(C14)、 Hyperoside(C17)、 Gossypin(C18)、 Gossypetin-8-O-β-D-glucuronide(C25)、 Gossypetin(C30)、 Myricetin(C33)、 Isoquercitrin(C35)和Quercetin(C43)。图2所示为3种苷元化合物C43、 C33和C30在混合标准溶液和药材提取液中的二级TOF-MS质谱图。上述8种化合物,特别是3种苷元化合物的母离子和子离子特征分布可为解析其它41种黄酮类化合物的结构提供重要参考。用于鉴定各化合物的子离子详细信息和鉴定结果见电子版文后支持信息表S2; 各化合物可能的化学结构详见电子版文后支持信息图S1。本研究仅以棉皮素(Gossypetin)类化合物鉴定或归属过程为例,简述具体鉴定思路和过程如下:
如图2C~2F所示,经标准品比对可知,棉皮素(C30)和杨梅素(C33)虽为一组同分异构体,均可产生特征性母离子m/z 317和一系列共同的子离子,如m/z 299、 271、 245、 227、 195、 179、 167、 151、 139、 137、 111和109等,但两者产生的子离子的丰度明显不同。相比之下,棉皮素可产生高丰度的m/z 299、 245、 227、 195、 167、 139和111,而杨梅素则可产生高丰度的m/z 179、 151、 137和109; 这些子离子特征性分布有助于以两者为母核的化合物的结构区分和鉴定。以C25为例,其丰富的加合离子和m/z 317子离子的出现均提示,此化合物是以m/z 317为苷元离子
的葡萄糖醛酸苷; 而高丰度的系列上述棉皮素子离子的出现,表明C25为棉皮素的葡萄糖醛酸苷。通过标准品比对,C25被准确鉴定为Gossypetin-8-O-β-D-glucuronide,进一步验证了上述特征子离子分布在结构鉴定中的重要作用。
类似地,C1、 C3、 C18可被合理归属为棉皮素的葡萄糖苷,参考PubChem数据库,初步将其结构分别定为Gossypetin 3-glucoside、 Gossypetin 3'-glucoside和Gossypin,其中,C18可通过标准品比对进一步确认; 而其同分异构体C7则由于可产生明显的m/z 179、 m/z 151等特征离子而被合理归属为Myricetin 3-glucoside。 C38也可产生棉皮素上述特征子离子分布,且精确分子量提示C38与C25相比多一个CH2,参考芹菜素-7-O-葡萄糖醛酸甲酯苷[17]等结构类似的化合物,初步确定棉皮苷的甲基化位点发生在葡萄糖醛酸基的8位,据此,将C38归属为Gossypetin 8-O-methylglucuronide。同样地,C34、 C40和C45为一组同分异构体,由精确分子量得到的元素组成提示它们比C38多一个甲基(CH2),且具有棉皮素的特征子离子分布,据此,将其归属为双甲基化的C25。进一步对比其子离子可以发现,C34在母离子m/z 521和棉皮素苷元子离子间未见明显碎片离子,提示两个甲基应位于糖基上,而非苷元上; C45可产生明显的m/z 331子离子,与母离子m/z 521相差m/z 190,提示甲基化葡萄糖醛酸残基(m/z 176+14)的存在; C40可产生m/z 503和461的子离子,两者相差一个乙酰基(m/z 42,CH3CH2O),提示乙酰基的存在。根据以上分析,参考已知黄葵中黄酮类化合物的糖基化位点,C34、 C40和C45分别被初步确定为Gossypetin 8-dimethylglucuronide、 Gossypetin 3-acetylglucoside和4'-methylgossypetin 8-methylglucuronide。
C20可产生与C38类似的特征子离子,如m/z 507、 m/z 317等,提示其结构中具有C38母核。C20与C38母离子相差两个CH2O,且C20可产生明显的[M-H2O-H]
离子m/z 549,据此,初步推断其结构为C38在糖基上加乙二醇,即C20为C25的丙三醇酯,其具体精确结构有待进一步深入研究。
C8、 C16均可依次丢失m/z 162(葡萄糖),两次生成m/z 479(单糖苷离子)和m/z 317(苷元离子),并伴有m/z 299和m/z 271等棉皮素特征子离子出现,提示其均为棉皮素的二糖苷。鉴于C16糖苷碎片离子少见,且可产生较多的小分子苷元相关碎片离子; 而C8则具有m/z 595、 m/z 478等糖苷相关子离子,且苷元碎片离子较少; 结合PubChem数据库搜索,将C8和C16分别初步归属为Gossypetin-3,8-O-diglucoside和Gossypetin 3-sophoroside。类似地,C11、 C19、 C21分别初步鉴定为Gossypetin 8-glucuronide 3-glucoside、 Gossypetin-8-O-glucosyl-(1->2)-glucuronide和Gossypetin 8-methylglucuronide 3-glucoside。
綜上,共有17种黄酮类化合物被归属或鉴定为棉皮素类化合物。类似地,共鉴定或归属25种槲皮素(Quercetin)类化合物,5种其它类黄酮化合物以及甘草苷和异甘草苷,鉴定过程详见电子版文后支持信息S3.3.1~S3.3.3。
3.4 筛选鉴定结果分析
根据上述筛选鉴定结果,以槲皮素和棉皮素两个苷元为转化起点,对TFA中黄酮类成分可能涉及到的转化反应进行归纳总结(电子版文后支持信息图S1)。结果表明,糖基化、 甲基化、 甲酰化、 乙酰化、 内酯化、 葡萄糖醛酸化、 甘油酯化共7种转化反应参与了黄葵黄酮类化合物的生成,其中,以糖基化最为常见。需要指出的是,上述转化反应是以苷元为起点作为假设的,因此,其逆反应也可能是常见的转化反应; 同时,由于槲皮素和棉皮素仅相差一个羟基,因此,这两者之间,以及以该两者为母核的多种化合物间均有可能发生相互转化。
对比各化合物[M-H]的峰强度可知,Gossypetin 8-O-methylglucuronide(C38)峰高最强,但此化合物在以往的黄葵制剂质量评价中很少提及; 类似的化合物还有C27、 C28、 C2、 C31和C7等。在后续的黄葵制剂质量评价及活性研究中,关注或增加对于这些化合物的相关研究十分必要。
4 结 论
通过LC-TOF-MS技术并结合MDF方法,对TFA中黄酮类成分进行系统筛查和初步鉴定,共筛选鉴定出49种黄酮类化合物,并归纳出了糖基化、 葡萄糖醛酸化、 甲基化等黄酮类化合物的次生代谢转化途径,极大地丰富了对黄葵黄酮类化学成分的认识,对于全面评价黄葵相关制剂质量,阐明其药效物质基础具有重要的参考意义。同时,本研究也充分表明, LC-TOF-MS技术结合MDF方法可用于中药等复杂体系的化学成分的系统定性分析。
References
1 Zhang L, Li P,Xing C Y, Zhao Jiu Y, He Y N, Wang J Q, Wu X F, Liu Z S, Zhang A P, Lin H L, Ding X Q, Yin A P, Yuan F H, Fu P, Hao L, Miao L N, Xie R J, Wang R,Zhou C H, Guan G J, Hu Z, Lin S, Chang M, Zhang M, He L Q, Mei C L, Wang L, Chen X M. Am. J. Kidney Diseases,2014, 64(1): 57-65
2 MAO Zhi-Min, WAN Yi-Gang, SUN Wei, CHEN Hao-Li, HUANG Yan-Ru, SHI Xi-Miao, YAO Jian. China Journal of Chinese Materia Medica, 2014,39(21): 4110-4117
毛志敏, 万毅刚, 孙 伟, 陈好利, 黄燕如, 史喜苗, 姚 建. 中国中药杂志, 2014,(21): 4110-4117
3 Kim H, Dusabimana T, Kim S R, Je J, Jeong K, Kang M C, Cho K M, Kim H J, Park S W. Nutrients,2018,10(11):1703-1718
4 Du L Y, Tao J H, Jiang S, Qian D W, Guo J M, Duan J A. Biomed. Chromatogr.,2017,31(2): e3795-e3806
5 Guo J M, Du L Y, Shang E X, Li T, Liu Y, Qian D W, Tang Y P, Duan J A. Pharmaceut. Biol.,2016,54(4): 595-603
6 Guo J M, Lu Y W, Shang E X, Li T, Liu Y, Duan J A, Qian D W, Tang Y P. Phytomedicine,2015,22(5): 579-587
7 Guo J M, Lin P, Lu Y W, Duan J A, Shang E X, Qian D W, Tang Y P. J. Ethnopharmacol.,2013,148(1): 297-304
8 Guo J M, Xue C F, Duan J A, Shang E X, Qian D W, Tang Y P, Ou Y Q, Sha M. Chromatographia,2011,73(5-6): 447-456
9 CHI Yu-Mei, ZHU Hua-Yun, JU Ling, ZHANG Yu, SHEN Xiao-Ning, HUA Xiao-Yi, NIE Fen. Chinese J. Anal. Chem.,2009,37(2): 227-231
池玉梅, 朱華云, 居 羚, 张 瑜, 沈小宁, 华小懿, 聂 芬.分析化学,2009,37(2): 227-231
10 WEI Ming-Si, GU Xiao-Yu, YUAN Ming, WANG Hui, HUANG Tian-Shu, LIU Jia-Qi, SHEN Ling-Ling, TAN Xiao-Jie, Chinese J. Anal. Chem.,2019,47(7): 1114-1120
韦明思, 谷筱玉, 袁 铭, 王 晖, 黄天述, 刘佳琪, 申玲玲, 谭晓杰.分析化学,2019,47(7): 1114-1120
11 Zhang H, Zhang D, Ray K, Zhu M. J. Mass Spectrom.,2009,44(7): 999-1016
12 Zeng S L, Duan L, Chen B Z, Li P, Liu E H. J. Chromatogr. A,2017,1508: 106-120
13 Pan H, Yao C, Yang W, Yao S, Huang Y, Zhang Y, Wu W, Guo D. J. Chromatogr. A,2018,1563: 124-134
14 Tan T, Lai C J, Zeng S L, Li P, Liu E H. Anal. Bioanal. Chem.,2016,408(2): 527-533
15 SONG Hui-Ting, LI Chang-Yin, WAN Yao-Yao, DING Xuan-Sheng, TAN Xi-Ying, DAI Guo-Liang, LIU Shi-Jia, JU Wen-Zheng. China Journal of Chinese Materia Medica, 2017,42(4): 686-695
宋慧婷, 李长印, 万瑶瑶, 丁选胜, 谭喜莹, 戴国梁, 刘史佳, 居文政.中国中药杂志,2017,42(4): 686-695
16 Li C Y, Song H T, Liu S J, Wang Q, Dai G L, Ding X S, Ju W Z. J. Sep. Sci., 2016,39(6): 1099-1109
17 ZHANG Jia-Jia, LI Xiang-Mei, REN Li-Hua, FANG Cheng-Wu, WANG Fei. China Journal of Chinese Materia Medica, 2011,36(9): 1198-1201
张家佳, 李香梅, 任丽花, 方成武, 王 飞.中国中药杂志,2011,36(09): 1198-1201
Systematic Screening and Assignment of Flavones in Total Flavones
of Abelmoschus Manihot Based on High-performance Liquid
Chromatography Time-of-Flight Mass Spectrometry
Analysis and Mass Defect Filter
GAO Xin1, WAN Yao-Yao1, LI Chang-Yin*1, DUAN Xu-Bin1, DING Xuan-Sheng*2, JU Wen-Zheng1
1(Department of Clinical Pharmacology, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, China)
2(School of Pharmacy, China Pharmaceutical University, Nanjing 211198, China)
Abstract High-performance liquid chromatography time-of-flight mass spectrometry (HPLC-TOF-MS) was employed to analyze the extract of total flavones of Abelmoschus manihot L. Medic (TFA) in both positive and negative ion mode. The raw LC-MS data were filtered by a well-established mass defect filter (MDF) approach to screen the flavone-related ions, and then, each screened ion was assigned by TOF-MS accurate mass measurement to certain elemental composition and ion type. Next, the co-eluted ions from one single compound were attempted to be combined, and the presence of each compound was confirmed by at least two quasi-molecular ions. Aided by authentic standards comparison and searching literature and databases, the targeted compounds were tentatively identified or assigned according to their parent and fragment ions. Finally, 49 flavones were screened and tentatively identified or assigned from the TFA extract. The results showed that, glycosylation, methylation, formylation, acetylation and glucuronidation were considered to be the major conversion involved in the formation of the TFA flavones. The current study not only provided the sufficient chemical substance for further studies of TFA, such as quality control and pharmacological activity, but also demonstrated the potential of the combination of LC-TOF-MS and MDF for systematically screening the constituents of herbal medicines.
Keywords Abelmoschus manihot L. Medic; Flavones; High performance liquid chromatography time-of-flight mass spectrometry; Mass defect filter; Systematic compound screening; Compound identification
(Received 25 September 2019; accepted 20 December 2019)
This work was supported by the National Natural Science Foundation of China (No.81503300).