商陆皂苷甲致肝毒性的研究
2014-04-11姚广涛金若敏谢家骏
周 倩, 姚广涛, 金若敏, 谢家骏
(上海中医药大学 药物安全评价研究中心, 上海 201203)
商陆皂苷甲致肝毒性的研究
周 倩, 姚广涛*, 金若敏, 谢家骏
(上海中医药大学 药物安全评价研究中心, 上海 201203)
目的 通过体外、 体内实验相结合的方法考察商陆皂苷甲所致的肝毒性。 方法 MTT法测肝细胞 ( L-02 细胞)活力; 以不同质量浓度的商陆皂苷甲与肝细胞共培养后, 测细胞培养上清中的 AST(谷草转氨酶)、 ALP(碱性磷酸酶) 和 LDH (乳酸脱氢酶) 水平, 并在光镜下对细胞形态进行观察; Hoechst-PI双标染色观察细胞的凋亡和坏死情况; 取 KM种小鼠分为正常组和给药组, 给药组的小鼠每天尾静脉注射 10mg/kg商陆皂苷甲, 连续给药 7 d, 考察小鼠血清肝功能指标和肝组织的病理学变化。 结果 MTT的结果显示, 商陆皂苷甲能显著抑制肝细胞活力, 其 IC50为360.18 μg/mL; 400 μg/mL的商陆皂苷甲能升高细胞培养上清中的 AST、 ALP和 LDH ( P<0.01) 并使肝细胞出现变圆、 减少和死亡的现象; 300 和 350 μg/mL的商陆皂苷甲能使肝细胞发生凋亡和坏死; 体内实验表明, 小鼠血清中的AST和 ALT(谷丙转氨酶) 水平均明显升高 (P<0.01), 小鼠肝脏多出现肝细胞多发灶性坏死及肝细胞再生现象。结论 大剂量的商陆皂苷甲对肝脏具有一定的毒性作用。
商陆皂苷甲;肝毒性;肝细胞;小鼠
中药商陆系商陆属植物商陆 Phytolacca acinosa Roxb.和垂序商陆 Phytolacca americana L.的干燥根, 其味苦、 性寒, 有毒, 归肺、 肾、 大肠经[1]。现代药理研究发现,其具有抗炎、抗菌、抗病毒、抗肿瘤、增强免疫和祛痰平喘等作用,主治急慢性肾炎、血小板减少性紫癜、肾水肿、银屑病和慢性气管 炎 等[2-3]。商 陆 皂 苷 甲 为 商 陆 的 主 要 成 分 之一[4],具有显著的抗炎、 免疫抑制、提高 DNA的合成率等作用[5-6]。 商陆 在临床应用中的不 良反应时有报道,但有关其毒理方面的研究较少,本实验选用商陆中的主要成分商陆皂苷甲,采用体外与体内实验相结合的方法,考察其肝毒性。
1 材料
1.1 细胞株 L-02 细胞株 来自上海中科院细胞库。
1.2 试剂及材料 商陆皂苷甲 (上海融禾医药科技 发 展 有 限 公 司, 纯 度 >98%,批 号 为120417); DMEM 培 养 基 ( 美 国 Gibco公 司 ) ;MTT( 美国 Sigma公司);Hoechst 33342 ( 美 国Sigma公司) ; PI( 美国 Sigma公 司) ; 胎牛血 清(美国 Hyclone公司) ; 青 霉 素-链 霉素抗体 ( 美国 Gibco公 司) ; 胰 蛋白酶 ( 美国 Sigma公 司 ) ;DMSO (国药集团化学试剂有限公司);谷草转氨酶 (AST)、 谷丙转氨酶 ( ALT)、 碱性磷酸酶 (ALP) 和乳酸脱氢酶 (LDH) 均购于日本世诺临床诊断制品株式会社。
1.3 仪器 全自动酶标仪 (BioTek 公司); 荧光倒置 相 差 显 微 镜 ( Olympus公 司); CO2培 养 箱(Thermo公司); 日立 7080 全自动血液生化仪 (日本日立贸易有限公司)。
2 方法
肝细胞 (L-02 细胞) 采用的完全培养液为:DMEM培养液 +1%青霉素-链霉素抗体 +10%胎牛血清。
2.1 商陆皂苷甲对肝细胞活力的影响 参考文献[7],采用 0.25%胰酶消化处于对数生长期的肝细胞,制成细胞悬液,调整细胞密度约为7 ×104个 /mL, 接 种 于 96 孔 板 中 (每 孔 180 μL)。 孵育 24 h 后分别以含 150、 200、 250、300、 350、 400 μg/m L商陆皂苷甲的完全培养液处理细胞,另设不加药的阴性平行对照组,每组平行 4 孔, 置 37 ℃ CO2培养箱中培养。 20 h后每孔避光加入 20 μL MTT溶液, 置培养箱中继续培养。 4 h 后弃上清, 每孔加入200 μLDMSO溶解蓝紫色结晶, 另设 DMSO调零孔, 酶标板振荡混匀, 在酶标仪 570 nm检测波长处测定吸光度A,按公式计算细胞活力,并将给药组与对照组进行统计分析,实验重复 3次。公式:细胞活力%=[(给药组平均 A-调零孔 A) ÷(对照组平均 A-调零孔 A)] ×100%。
2.2 商陆皂苷甲对肝细胞上清功能性指标及细胞形态学的影响 参考文献[7], 采用 0.25%胰酶消化处于对数生长期的肝细胞,制成细胞悬液,调整细胞密度约为 18 ×104个/mL, 接种于 24 孔板中(每孔 900 μL)。 孵育 24 h 后分别以含 100、 200、300、400 μg/mL商陆皂苷甲的完全培养液处理细胞另设不加药的阴性平行对照组,每组平行3孔,置37 ℃ CO2培养箱中培养。 药物作用24 h 后用倒置相差显微镜对细胞形态学进行观察,立即取细胞培养上清, 1 200 r/min 离心 5 min, 取上清, 采用全自动血液生化仪对肝细胞培养上清液中的 AST、ALP和 LDH进行检测。
2.3 Hoechst-PI双标染色观察细胞的凋亡和坏死情况 同 “2.2” 项对细胞进行处理, 其中商陆皂苷甲 的 给 药 质量浓度设 为 200、 250、300、350 μg/mL, 给 药 24 h 后, 加 入 1 mg/m L的 Hoechst33342 (体系中终质量浓度为 10 μg/m L), 37℃避光反应 10 min 后加入 1 mg/mL的 PI( 体系中终质量浓度为 10 μg/mL), 4 ℃ 避 光反应 20 min后,立即用倒置荧光显微镜进行观察。
2.4 商陆皂苷甲对小鼠肝毒性的影响 KM小鼠 20 只 (雌雄各半), 进行随机分组, 即分为正常对照组和给药组。给药组小鼠每天尾静脉注射 10 mg/kg的商陆皂苷甲, 连续 7 d, 正常组尾静脉注射等容量的生理盐水,于末次给药1 h后, 进行摘眼球取血, 血浆静置 30 min 后 3 500 r/min 离心15 min,分离 出 血 清, 全 自 动 血 液 生化仪测 ALT和 AST,另取小鼠肝脏,对其进行组织病理学检查。 参考文献[8], 进行半定量分析:肝组织结构正常,无明显变性、坏死及炎症细胞浸润,记为0分;肝小叶结构尚正常,可见明显的混浊肿胀、气球样变或脂肪变性,散在点状坏死 (+), 记为 1 分; 肝小叶结构不清,可见明显的灶状坏死,伴有炎症细胞浸润(++), 记为2 分; 肝小叶结构不清、 可见明显的片状坏死,伴有炎症细胞浸润 (+++),记为3分;坏死细胞弥漫性存在于肝小叶中央,层次较多, 伴有炎症细胞浸润 (++++), 记为4分。
3 结 果
3.1 商陆皂苷甲对肝细胞活力的影响 与对照组相比, 给予 300 ~400 μg/mL商陆皂苷甲 24 h 后,各组的肝细胞活力均明显下降,有极显著性差异(P<0.01 或 0.05 ),且 呈 剂 量 依 赖 性,IC50为360.18 μg/mL, 见表 1。
表 1 商陆皂苷甲对 L-02 细胞活力的影响 (, n=4)Tab.1 L-02 cell viability in fluenced by esculentoside A(, n=4)
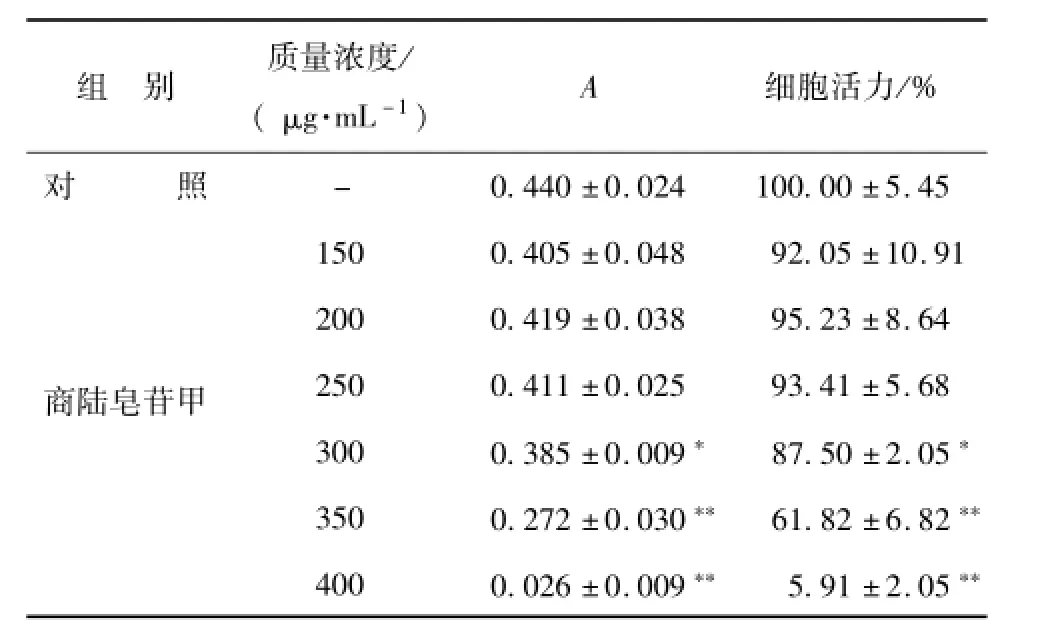
表 1 商陆皂苷甲对 L-02 细胞活力的影响 (, n=4)Tab.1 L-02 cell viability in fluenced by esculentoside A(, n=4)
注: 与对照组相比,**P<0.01,*P<0.05
组 别 质量浓度/( μg·m L-1) A 细 胞活 力/%对 照- 0.440 ±0.024 100.00 ±5.45 150 0.405 ±0.048 92.05 ±10.91 200 0.419 ±0.038 95.23 ±8.64商陆皂苷甲 250 0.411 ±0.025 93.41 ±5.68 300 0.385 ±0.009* 87.50 ±2.05*350 0.272 ±0.030** 61.82 ±6.82**400 0.026 ±0.009** 5.91 ±2.05**
3.2 商陆皂苷甲对肝细胞上清功能性指标及细胞形态学的影响 与对照组相比, 400 μg/mL组的肝细胞上清液中的 AST、 ALP、 LDH水平明显升高, 有显著性差异 (P<0.01), 见表 2。 正常肝细胞贴壁生长,细胞紧密衔接且呈不规则的多边形; 400 μg/m L商 陆皂苷甲组的 肝 细 胞明显变圆、减少、部分死亡且漂浮于培养液中,细胞 轮 廓 清 晰, 内 可 见 大 量 空 泡 产 生; 300 μg/mL商陆皂苷甲组的肝细胞内可见部分空泡产生; 100 和 200 μg/mL商陆皂苷甲组的肝细胞形态无明显的改变,见图1。
表 2 商陆 皂苷甲对 L-02 细胞功能性 指标的影响 (,n=3)Tab.2 Contents of AST, ALP, LDH in L-02 cell suPernatant influenced by esculentoside A(, n=3)

表 2 商陆 皂苷甲对 L-02 细胞功能性 指标的影响 (,n=3)Tab.2 Contents of AST, ALP, LDH in L-02 cell suPernatant influenced by esculentoside A(, n=3)
注: 与对照组相比,**P<0.01
组 别 质量浓度/( μg·mL-1)AST /(IU·L-1)ALP /(IU·L-1)LDH /(IU·L-1)对 照- 3.67 ±0.58 26.00 ±1.00 74.33 ±1.53 100 3.33 ±0.58 25.00 ±0.00 72.33 ±1.15商陆皂苷甲 200 3.33 ±0.58 24.33 ±0.58 71.33 ±1.53 300 4.00 ±0.00 25.67 ±1.15 75.00 ±2.65 400 13.67 ±0.58**31.33 ±1.53**189.00 ±3.46**

图 1 商陆皂苷甲对 L-02 细胞形态的影响 ( ×200)Fig.1 M orPhological changes of L-02 cell influenced by esculen toside A ( ×200)
3.3 Hoechst-PI双标染色观察细胞的凋亡和坏死情况 正常对照组肝细胞数较多,细胞多呈淡蓝色,亮蓝色的早期凋亡细胞和橘红色的晚期凋亡或坏死细胞为个别现象; 200 和 250 μg/mL商陆皂苷甲组的肝细胞未发生明显改变;随着剂量增大,300 μg/mL商陆皂苷甲组的肝细胞数量逐渐减少,凋亡和坏死细胞逐渐增加; 350 μg/mL商陆皂苷甲组的肝细胞数量显著减少且凋亡和坏死的细胞明显增多。见图2。
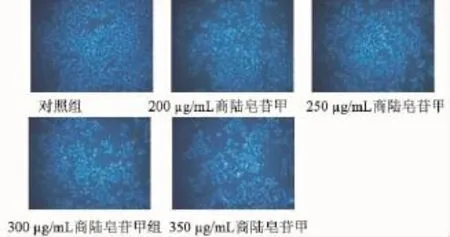
图 2 商陆皂苷甲对 L-02 细胞形态的影响 ( ×200)Fig.2 L-02 cell aPoPtosis and necrosis infulenced by esculentoside A( ×200)
3.4 商陆皂苷甲对小鼠肝毒性的影响 与正常对照组相比, 商陆皂苷甲组小鼠血清中的 ALT和AST水平均出现明显的升高 (P<0.01), 见表 3;光镜下观察,与对照组相比商陆皂苷甲组小鼠肝脏多出现肝细胞多发灶性坏死及肝细胞再生 (P<0.01), 见表4 及图 3。
4 讨论
商陆皂苷甲是中药商陆的主要成分与活性成分之一,临床大量服用商陆可引起消化系统损害,最先出现的不良反应是胃肠道症状,如恶心呕吐、食欲减退、腹胀、腹痛、腹泻,严重者可出现胃肠道糜烂、 溃疡及出血, 呈现呕血、 便血等[9]。 在误服商陆引起的中毒事件中,部分患者出现了肝功能的异常[10-12] 。
表3 KM小鼠给予商陆皂苷甲7 d后对血清生化指标的影响 (, n=10)Tab.3 Serum biochem ical indexes of KM m ice after being given esculentoside A for 7 days(, n=10)

表3 KM小鼠给予商陆皂苷甲7 d后对血清生化指标的影响 (, n=10)Tab.3 Serum biochem ical indexes of KM m ice after being given esculentoside A for 7 days(, n=10)
注: 与对照组相比,**P<0.01
组 别 剂量/(mg·kg-1)ALT/(U·L-1)AST/(U·L-1)正常对照组- 31.38 ±3.08 102.80 ±15.68商陆皂苷甲组 10 360.14 ±287.97**265.21 ±125.02**

表4 KM小鼠给予商陆皂苷甲7 d后对肝病理改变的影响Tab.4 HePatic histoPathology of KM m ice after being given esculen toside A for 7 days
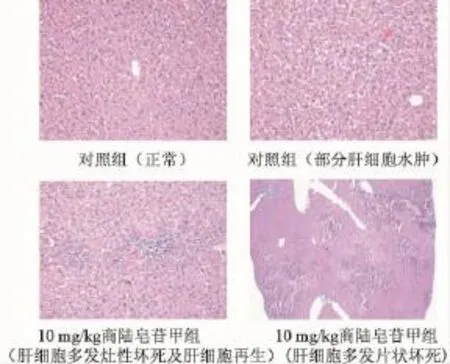
图 3 商陆皂苷甲对小鼠肝组织病理学的影响 ( ×200)Fig.3 HePatic histoPathology of KM m ice after being given esculentoside A( ×200)
体外实验研究 表 明, 300 ~400 μg/m L商 陆 皂苷甲对肝细胞活力有明显的抑制作用,且呈量-效关系。 400 μg/mL商陆皂苷甲组能显著升高肝细胞培养上清液中的 AST、 ALP和 LDH水平。 细胞形态学方 面 的影响主要 表 现 为 400 μg/m L商 陆 皂 苷甲组的肝细胞明显变圆、减少、部分死亡且漂浮于培养液中,细胞轮廓清晰,内可见大量空泡产生。300 和 350 μg/mL的商陆皂苷甲能使肝细胞不同程度的发生凋亡和坏死现象, 且呈现一定的量-效关系。以上的结果均表明商陆皂苷甲对肝细胞具有毒性。
体内实验研究表明, 给 予 10 mg/kg商 陆皂苷甲 7 d 后, KM小鼠血清中的 ALT和 AST水平出现明显的升高,肝组织出现明显的病变,显示大剂量的商陆皂苷甲对肝脏有较强的毒性作用。
商陆皂苷甲在中药商陆中的量约为 0.4%[4],其既是有效成分又是毒性成分,本研究提示在大剂量下,商陆皂苷甲对肝脏具有一定的毒性作用,提示在临床上使用商陆应予以注意,特别是对肝功能不良的患者。
[ 1 ] 国家药典委员会编.中华人民共和国药典[S].2010 年版一部.北京: 中国医药科技出版社, 2010.
[ 2 ] 李一飞, 姚广涛.商陆药理作用及毒性研究进展[J].中国实验方剂学杂志, 2011, 17(13): 248-251.
[ 3 ] 张家继, 李革李, 德 君.商陆的临床应用[J].中国中医急症, 2011, 20(6): 1002.
[4] 马 杰,赖道万,孙文基.商陆药材中商陆皂苷甲的含量测定[J].药物分析杂志, 2010, 30(1): 163-165.
[ 5 ] 马华林, 张欣洲, 张祥贵.商陆皂苷甲对 BXSB狼疮性肾炎小鼠的治 疗 作 用 [ J].广 东 医 学, 2011, 32 (12):1540-1542.
[ 6 ] Hu Z, Qiu L, Xiao Z, et al.Effects ofesculentoside A on autoimmune syndrome induced by Campylobacter jejuni in mice and itsmodulation on T-lymphocyte proliferation and apoptosis[ J] . Inter Immuno pharmacol, 2010, 10(1) : 65-71.
[7] 张 茜,周 绮,金若敏, 等.吴茱萸次碱对肝肾毒性的初步研究[ J].中国实验 方剂学杂志, 2011, 17 (8):221-225.
[8] 周 绮,张 茜,金若敏.吴茱萸致小鼠肝毒性时效、 量效关系研究[ J].中国实验方剂学杂志, 2011, 17 (9):232-235.
[9] 胡 莹, 曾聪彦, 梅全喜.急性商陆中毒反应82 例文献分析[J].时珍国医国药, 2011, 22(12): 3041.
[10] 陈金香.中西医结合治疗急性商陆中毒 26 例[J].浙江中医杂志, 2010, 45(7): 535.
[11] 郭宝科, 张风琴, 张 黎, 等.急性商陆中毒 10 例临床分析[ J] .中国工业医学杂志, 2005, 18(1) : 32-33.
[12] 汪晓风.2 例商陆中毒病人的救护[ J].护理研究, 2008,22(1): 183.
HePatotoxicity induced by esculentoside A
ZHOU Qian, YAO Guang-tao*, JIN Ruo-min, XIE Jia-jun
(Shanghai University of Traditional ChineseMedicine, Shanghai201203, China)
AIM To explore the hepatotoxicity of esculentoside A from Phytolacca acinosa Roxb.in vitro and in vivo.METHODS MTT assay was used to test the hepatic cells( L-02 cell) viability.The contents of aspartate aminotransferase( AST) , alkaline phosphatase( ALP)and lactic dehydrogenase( LDH) in hepatocytes supernatantwere detected after being incubated with the different concentrations of esculentoside A andmorphological changes of hepatocytes were observed by inverted phase contrastmicroscope.Cell apoptosis and necrosis were observed by Hoechst-PI stainingmethod.After 10 mg/kg esculentoside A were given tomice for 7 days through intravenous administration, hepatic function and histopathology inmice was investigated.RESULTS The MTT result showed that esculentoside A could obviously inhibit hepatic cells viability with the IC50of 360.18 μg/mL. 400 μg/mL esculentoside A could increase the levels of AST, ALP, LDH in hepatocytes supernatant( P<0.01 )and cellmorphology showed that 400 μg/mL esculentoside A could damage the shapes of hepatocytes.Three hundred and 350 μg/mL esculentoside A caused cell apoptosis and necrosis.The animal experiment showed that AST and alanine aminotransferase(ALT) in blood serum increased notably( P<0.01) .Histopathological examination revealed thatmost ofmice’ s livers had multiple focal necrosis of liver cells and liver regeneration.CONCLUSION Esculentoside A may cause hepatotoxicity.
esculentoside A; hepatotoxicity; hepatocytes; mice
R969
: A
: 1001-1528(2014)01-0014-05
10.3969/j.issn.1001-1528.2014.01.004
2013-02-06
国家重点基础研究发展计划 (973 计划) (2009CB522807); 国家 “十二五” 科技重大专项课题 “中药安全评价技术平台”(2011ZX09301-009)
周 倩 (1988—) , 女, 硕士生, 研究方向: 中药安全性评价。 E-mail: 423384692@qq.com
*通信作者: 姚广涛, 博士, 副研究员, 硕士生导师, 从事中药新药及其安全性评价研究。 Tel: (021) 51322472, E-mail: ygt1969@ yahoo.com.cn
