瘦素及瘦素受体与乳腺癌浸润、转移关系的研究
2014-04-08张志宁赵亚恒郑丽华刘运江
张志宁, 赵亚恒, 郑丽华,刘运江
肥胖与癌症的关系已经成为社会流行病学中健康问题的研究重点,WHO报道目前世界上至少有4亿肥胖人群,2015年肥胖人群数目将突破7亿[1]。肥胖或体重超标是乳腺癌发生的高危因素,也是肿瘤预后不良的关键因素。根据美国的数据统计,肥胖人群的肿瘤死亡率比正常体重人群高出52%(男性)和62%(女性)[2]。瘦素可以调节食物摄取和能量平衡,通常情况下瘦素通过下丘脑介导作用抑制食物摄入,抑制脂肪生成,促进脂肪消耗。当机体产生对瘦素抵抗时,脂肪合成增加,消耗减少,使机体储存更多的脂肪;同时脂肪组织会分泌更多的瘦素,从而形成恶性循环。乳腺癌发病率逐年上升,2013年数据显示乳腺癌成为20~59岁女性癌症患者最主要的死亡原因[1]。本研究探讨瘦素及瘦素受体与乳腺癌浸润、转移的关系,为预防乳腺癌提供参考数据。
1 材料与方法
1.1 临床资料
病例为2013年2月至2013年6月由河北医科大学第四医院乳腺中心收治,均为女性,均经病理确诊。良性乳腺疾病98例作为对照组,年龄(43.9±6.9)岁,包括乳腺腺病、乳腺炎、乳腺纤维瘤、导管内乳头状瘤、炎性肉芽肿等。乳腺癌97例为研究组,年龄(45.5±6.0)岁,并按腋窝淋巴结转移数多少分为A组(无腋窝淋巴结转移)19例;B组(1~3个腋窝淋巴结转移)19例;C组(4~9个腋窝淋巴结转移)19例;D组(9个以上腋窝淋巴结转移)20例;E组(远处转移)20例。组间年龄无统计学差异(P>0.05)。
1.2 主要实验仪器及试剂
1.2.1 实验仪器 (1)石蜡切片机(德国LEICA公司RM2255型);(2)摊片烤片机(孝感市泰康公司);(3)自动染色仪(德国LEICA公司ST5020型);(4)全自动免疫组化染色仪(美国LAB VISION AUTOSTAINER480型);(5)光密度值测试仪器(LEICA DM3000 B and IMAGE-INPLUS);(6)ELISA 设备(GENE Bio-Teck ELX800)。
1.2.2 实验试剂 (1)SP免疫组化染色试剂盒(北京中杉金桥生物技术有限公司);(2)瘦素ELISA试剂盒(美国Abcan公司)。
1.3 实验方法
1.3.1 身高与体重的测量 所有患者均于住院第1天晨起后,空腹测量身高、体重,并记录。
1.3.2 血清中瘦素的测量 乳腺癌患者均于清晨8点抽取空腹静脉血,于1 h内置冷冻离心机内分离血清 (3 000 r/min, 离心 10 min), 置-80 ℃保存,成批测量。取出瘦素ELISA试剂盒所需反应板,分别加入15 μl标准品、质控、血清样品于相应孔中;每孔加入100 μl缓冲液,轻轻混匀30 s,37 ℃孵育120 min;洗板:甩尽版内液体,用洗涤液洗涤反应板(每孔加入350 μl洗涤液),去除水滴,在厚叠吸水纸上排干;反复洗涤3次;加一抗及酶标抗体工作液:每孔加入一抗工作液100 μl,将反应板充分混匀后,置37 ℃恒温箱,孵育120 min,用前述洗板方法洗板,加入酶标抗体工作液100 μl,再次37 ℃静置120 min,再次洗板;显色:每孔加入底物工作液100 μl,置37 ℃暗处反应15 min终止;每孔加入终止液100 μl混匀。
1.3.3 石蜡标本的S-P染色及其光密度值测量 患者术后或穿刺后组织立即进行石蜡固定,待成批测定, 避免产生批间误差。石蜡切片,常规脱蜡;3% H2O2去离子水孵育5~10 min,以消除内源性过氧化物酶活性;蒸馏水冲洗,PBS 浸泡5 min(如需采用抗原修复,在此步骤后进行);滴加封闭用正常山羊血清工作液室温孵育10~15 min,倾去, 勿洗;滴加适当比例稀释的一抗,37 ℃孵育2~3 h或4 ℃过夜;PBS 冲洗,3 min×3次;滴加生物素化二抗工作液(IgG / Bio),室温或37 ℃;PBS 冲洗,3 min×3次;滴加辣根酶标记链霉卵白素工作液(S-A/HRP),室温或37 ℃;PBS 冲洗,3 min×3 次;显色剂显色(DAB或AEC) ;自来水充分冲洗;选择适当的封片剂封片,进行光密度值测定。
1.4 统计学处理 应用SPSS13.0统计软件包进行数据处理,MVD数值用Mean±SD表示,组间数据采用秩和检验,所有统计结果的判定,以a<0.05为差异有统计学意义。
2 结果
2.1 良性乳腺疾病患者与乳腺癌患者的BMI比较
乳腺癌患者的BMI为(25.77±4.12 )kg/m2,明显高于良性乳腺疾病患者的(24.36±3.74)kg/m2,P=0.028;肥胖患者相对于非肥胖患者患乳腺癌的相对危险度(RR)为1.44(表1)。

表1 肥胖与非肥胖患者的比例
2.2 瘦素在乳腺癌组织中的表达
瘦素在乳腺癌组织中的表达随腋窝淋巴结转移数增多而依次升高,各组间比较只有B组与C组之间差异无统计学意义(P=0.188),其余各组间均有统计学意义(表2)。

表2 瘦素在乳腺癌组织中的表达
2.3 瘦素受体在乳腺癌组织中的表达
瘦素受体在癌组织中的表达随腋窝淋巴结转移数增多而依次升高,各组间只有B组与C组(P=0.083)、C组与D组(P=0.379)之间差异无统计学意义,其余各组间均有统计学意义(表3)。

表3 瘦素受体在乳腺癌组织中的表达
2.4 瘦素在乳腺癌组血清中的表达
瘦素在乳腺癌患者血清中的表达依次升高。各组间比较只有D组和E组差异无统计学意义(P=0.329),其余各组之间差异均有统计学意义(表4)。
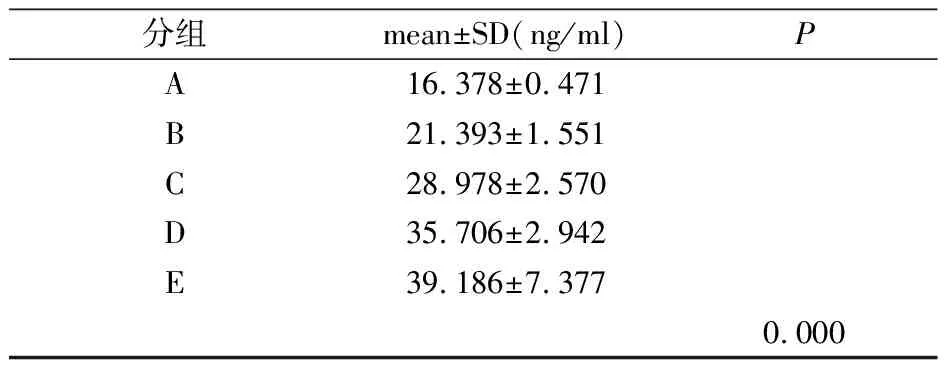
表4 瘦素在乳腺癌患者血清中的表达
3 讨论
在机体处于病理状态下,肥胖的发生与瘦素密切相关,同时脂肪细胞分泌瘦素,二者之间构成反馈调节体系,起到相互促进的作用,同时瘦素的增加又可以诱导一系列致癌信号的激活,从而促进癌症的发生、发展[2]。研究表明肥胖患者中瘦素水平增高是乳腺癌发病的危险因素,并且瘦素增高是乳腺癌预后不良的因素之一[3]。
瘦素是脂肪基因产生的多肽激素,是调节体重和身体组成的重要调节因素。血清中的瘦素通过下丘脑起到调节食欲及控制体重的作用。瘦素主要从脂肪细胞中分泌。偏瘦或者体重指数正常的女性对瘦素敏感性很强,瘦素通过作用于下丘脑来调节食欲及脂肪量,因此瘦素以前被认为能降低体重和肥胖。但是最近的研究表明肥胖女性的血清瘦素水平较高,导致下丘脑对瘦素无应答,不能够再调节体重及食欲,因此肥胖是瘦素产生抵抗的结果。
瘦素及瘦素受体结合后,可以被激活不同的信号转导通路,从而促进乳腺癌的发生、发展。这些通路包括JAK/STAT、SOCS-3、PI3K和IRS蛋白途径、瘦素和血管发生、瘦素和生长因子、瘦素与HER2、细胞周期蛋白D1和MCL-1等。瘦素及瘦素受体在正常乳腺组织中表达很少,而在乳腺癌组织却过度表达[4]。研究表明,在瘦素或瘦素受体缺乏的小鼠中不会发生乳腺肿瘤[5],这说明瘦素及瘦素受体在乳腺癌的发生中起到关键作用。血清中瘦素水平的增高也与乳腺癌的发生具有一定的联系[6]。在瘦素受体缺乏的肥胖Zucker大鼠中,应用致癌药物甲基亚硝脲后,相对于较瘦的大鼠其乳腺癌的发病率很低[7]。而且在瘦素受体缺乏的大鼠中,用二甲基苯蒽不能诱导其患乳腺癌。导致这种结果的原因很可能是由于瘦素受体缺乏或者是由于其他尚未研究清楚的原因导致的。
瘦素在乳腺癌组织中的表达明显高于正常乳腺组织[8-9],此类研究已经很多,本实验按腋窝淋巴结转移数多少进行分组,观察各组瘦素及瘦素受体在癌组织中表达的差异,以及在血清中瘦素的表达差异,研究瘦素及瘦素受体的表达与女性乳腺癌浸润、转移的关系。另肥胖是绝经后妇女患乳腺癌的一个高危因素,并且可以减少患者的生存率[10],我们通过比较乳腺癌患者及良性乳腺疾病患者的BMI,评价肥胖对乳腺癌的影响。结果显示,良性乳腺疾病患者BMI低于乳腺癌患者(P=0.028),肥胖导致乳腺癌的相对危险因素RR=1.44,可见肥胖为乳腺癌发病的高危因素。本实验按乳腺癌患者腋窝淋巴结转移数由少到多进行分组,观察各组瘦素及瘦素受体在癌组织中表达的差异,结果显示,瘦素及瘦素受体在癌组织中的表达在A到E组中依次升高,证明瘦素及瘦素受体可促进乳腺癌细胞的复发、转移。但在B、C组间无统计学差异,这可能是由于1~3个腋窝淋巴结转移与3~9个淋巴结转移间危险程度相似。结果还显示,血清中瘦素的水平D、E组间也无统计学差异,这可能是由于晚期患者的恶液质造成脂肪减少从而使瘦素分泌降低造成,也可能是本实验样本量偏少造成。本实验样本量偏少,有待扩大样本量进一步的验证。
参考文献:
[1] WHO, 2006.World Health Tissue Fact Sheet for World Wide Prevalence of Obesity[OL].http://www.who.int/mediacentre/factsheets/fs 311/en/index.html.
[2] Cirillo D, Rachiglio AM, la Montagna R, et al.Leptin signaling in breast cancer: An overview [J].J Cell Biochem, 2008, 105(4):956-964.
[3] Jonnathan G.Santillan-B, Hugo MZ, et al.The Tetrad BMI, Leptin, Leptin/Adiponectin (L/A) Ratio and CA 15-3 are Reliable Biomarkers of Breast Cancer [J].Journal of Clinical Laboratory Analysis, 2013, 27(1): 12-20.
[4] Jarde T, Caldefie-Chezet F, Damez M, et al.Adiponectin and leptin expression in primary ductal breast cancer and in adjacent healthy epithelial and myoepithelial tissue [J].Histopathology, 2008, 53(4):484-487.
[5] Cleary MP, Juneja SC, Phillips FC, et al.Leptin receptor deficient MMTV-TGF-alpha/LeprdbLeprdb female mice do not develop oncogene-induced mammary tumors [J].Exp Biol Med, 2004, 229(2):182-193.
[6] Cleary MP, Grande JP, Juneja SC, et al.Effect of dietary-induced Obesity and mammary tumor development in MMTV-neu female mice [J].Nutr Cancer, 2004, 50(2):174-180.
[7] Lee WM, Lu S, Medline A, et al.Susceptibility of lean and Obese Zucker rats to tumorigenesis induced by Nmethyl-N-nitrosurea [J].Cancer Lett, 2001,162(2):155-160.
[8] Ishikawa M, Kitayama J, Nagawa H.Enhanced expression of leptin and leptin receptor (OB-R) in human breast cancer[J].Clin Cancer Res, 2004,10(13):4325-4331.
[9] Amitbha R, Margot PC.Leptin as a potential therapeutic target for breast cancer prevention and treatment.Expert Opin Ther Targets[J], 2010, 14(4):443-451.
[10] Reeves GK, Pirie K, Beral V, et al.Cancer incidence and mortalityin relation to body mass index in the million women study: cohort study [J].BMJ, 2007, 335(7630):1134.
