中国新疆灰仓鼠真菌多样性
2014-04-02高正琴岳秉飞
高正琴,岳秉飞
灰仓鼠(Cricetulusmigratorius,grey hamster)是啮齿目(Rodentia)仓鼠科(Cricetidae)仓鼠亚科(Cricetinae)仓鼠属(Cricetulus)动物,栖息于荒漠平原及海拔几千米以上高山草甸,参与鼠疫、土拉伦、黑热病、森林脑炎等自然疫源性疾病传播。高正琴等在2008年和2011年两次分别对100多只灰仓鼠携带的细菌进行了调查研究[1-2]。目前,国内外尚未见有关灰仓鼠微生物背景资料的详细全面报道。由于缺乏早期的研究数据,特别是没有灰仓鼠携带真菌的多样性信息,至今中国尚无灰仓鼠质量控制标准。本研究应用TaqMan MGB探针实时荧光定量PCR和核糖体克隆测序及真菌培养鉴定技术,首次调查并分析中国新疆地区灰仓鼠携带真菌的多样性,以期获得更全面的微生物多样性信息,为我国灰仓鼠微生物学监测及质量标准的制定提供科学的参考依据。
1 材料与方法
1.1试剂和样本来源 真菌培养基、鉴定试剂和抗真菌药敏片分别购自英国OXOID公司和丹麦ROSCO公司。DNA提取和PCR扩增回收试剂盒等分子生物学试剂购自TaKaRa公司。白假丝酵母(Candidaalbicans)标准菌株ATCC10231和白假丝酵母TaqMan MGB探针实时荧光定量PCR检测试剂由本实验室提供。60只成年灰仓鼠来自中国新疆地区,采血分离血清,安乐死后收集被毛、气管、肠等标本。
1.2DNA提取和TaqMan MGB探针实时荧光定量PCR检测 按通用型基因组DNA提取试剂盒说明书操作提取灰仓鼠标本DNA。白假丝酵母TaqMan MGB探针荧光定量PCR检测基因引物探针序列: ITS基因的正向引物GZQCAITSTF:5′- GCTTGAAAGACGGTAGTGGTAAGG-3′;反向引物GZQCAITSTR:5′- CCGCCGCAAGCAATGTTTT-3′;探针GZQCAITSTP:5′- FAM- CCT
AAGCCATTGTCAAAGC-MGB-NFQ-3′。26S rRNA
基因的正向引物GZQCA26STF:5′- GGGCTTGAGATCAGACTTGGTATT-3′;反向引物GZQCA26STR:5′- TGCTGGCCCGGTAAACC-3′;探针GZQCAR26STP:FAM-TTGCATGCTGCTCTCT
C-MGB-NFQ。以提取的DNA为模板,分别使用白假丝酵母ITS基因和26S rRNA基因TaqMan MGB探针实时荧光定量PCR检测试剂上机。总反应体系20μL,包括正、反向引物(各900 nmol/L)和探针(250 nmol/L)共1 μL、TaqMan mix 10 μL、模板DNA 1 μL、nuclease-free water 8 μL。循环参数:95 ℃ 20 s;95 ℃ 3 s,60 ℃ 30 s,共40个循环。应用7500型荧光定量PCR仪进行检测。用仪器自带SDS软件实时观察PCR荧光扩增曲线并采集数据。
1.3灰仓鼠真菌分离培养鉴定 取上述灰仓鼠标本,分别接种沙堡氏葡萄糖琼脂斜面、改良马丁琼脂斜面、皮肤病原真菌鉴别琼脂平板,置28 ℃、35 ℃培养3~14 d。将分离获得的真菌菌株,划线接种改良马丁琼脂平板、皮肤病原真菌鉴别琼脂平板,置28 ℃、35 ℃培养培养3~14 d。挑取单菌落,接种改良马丁琼脂斜面、改良马丁琼脂平板、皮肤病原真菌鉴别琼脂平板、改良马丁液体培养基,置28 ℃、35 ℃培养3~14 d。通过观察分离株的菌落生长速度、表面质地、颜色、形态、气味、渗出物等进行大体分类。对每一类典型菌落进行镜检,观察菌丝和孢子形态和特征、孢子着生部位及排列方式等,摄录存档。参照各种真菌形态描述及检索表,进行真菌菌种初步鉴定[3]。
1.4灰仓鼠真菌药物敏感性试验 试验选用丹麦ROSCO 公司生产的N eo-Sensitab抗真菌药敏片:两性霉素(Amphotericin B,AMPHO;剂量10 μg)、制霉菌素(Nystatin,NYST;剂量50 μg)、酮康唑(Ketoconazole,KETO;剂量15 μg)、咪康唑(Miconazole,MICO;剂量10 μg)、克霉唑(Clotrimazole,CLOTRI;剂量10 μg)、益康唑(Econazole,ECONZ;剂量10 μg)、氟康唑(Fluconazole,FLZ;剂量25 μg)、沃尔康唑(Voriconazole,VOR;剂量1 μg)、特比萘芬(Terbinafine,TEB;剂量30 μg)、氟胞嘧啶(Fluorocytosine,FLU;剂量10 μg)。试验时用白假丝酵母ATCC 64548进行质控。
根据美国临床实验室标准化委员会(National Committee for Clinical Laboratory Standard,NCCLS)的规定,采用琼脂扩散法,将0.5麦氏单位真菌悬液均匀涂布在4 mm厚的改良Shadomy琼脂培养基表面,经35 ℃培养18~24 h后,读取结果。药敏片检测结果参考试剂盒内所提供的标准。根据药敏片周围真菌被抑制的范围直径大小来确定抗真菌药物对真菌的抑制作用[4-5]。
1.5真菌核糖体PCR扩增和克隆测序鉴定 采用真菌核糖体特定通用引物[6-7],以抽提的灰仓鼠真菌菌株DNA为模板进行PCR扩增。PCR总反应体系为50 μL,包括10×Buffer (Mg2+Plus) 5.0 μL、dNTP Mixture 4.0 μL、正反向引物(20pmol/μL)各1.0 μL、EX Taq(5U/μ L)0. 5μL、模板DNA 1 μL、nuclease-free water 37.5 μL。循环参数:95 ℃ 1 min 1 cycle;95℃ 15 s,55℃ 15 s,72℃ 30 s,35个循环;72℃ 7 min 1个循环。琼脂糖凝胶电泳检测真菌PCR扩增产物。将获得的目的基因片段回收纯化并克隆测序鉴定。将所获得的灰仓鼠真菌基因序列递交GenBank作进一步比对分析,核实确定各自种属。
2 结 果
2.1灰仓鼠真菌分离培养鉴定结果 本研究从60只灰仓鼠中共分离培养出60株真菌,编号为GZQ20120208GH1-GZQ20120208GH60。灰仓鼠不同种类真菌生长培养特性和菌丝孢子形态显微摄录照片见图1。
本研究利用培养手段从中国新疆灰仓鼠中分离得到60株真菌,经初步鉴定分析其主要分布在曲霉属(Aspergillus)、青霉属(Penicillium)、丝孢酵母属(Trichosporon)、假丝酵母属(Candida)、脉孢菌属(Neurospora)、间型脉孢菌、枝孢属(Cladosporium)。具体如下。
烟曲霉(Aspergillusfumigatus)5株(灰仓鼠烟曲霉GZQ20120208GH22、GZQ20120208GH35、GZQ20120208GH47、GZQ20120208GH50、GZQ20
120208GH51在28℃、37℃均能生长,在沙堡氏葡萄糖琼脂、改良马丁琼脂、皮肤病原真菌鉴别琼脂、改良马丁液体培养基上生长良好。菌落呈灰蓝绿色,表面有辐射状沟纹,背面呈黄色。菌落呈致密绒状,能产生成簇的菌丝体,无特殊气味。菌丝为有隔菌丝;分生孢子穗圆筒形,呈深浅不同的绿色,分生孢子梗光滑,带绿色;顶囊烧瓶状,仅上半部产生孢子;分生孢子球形,有刺,绿色(见图1中A1、A2、A3)。
焦曲霉(Aspergillusustus)4株(灰仓鼠焦曲霉GZQ20120208GH16、GZQ20120208GH21、GZQ20
120208GH23、GZQ20120208GH43在28℃、37℃均能生长,在沙堡氏葡萄糖琼脂、改良马丁琼脂、皮肤病原真菌鉴别琼脂、改良马丁液体培养基上生长良好。菌落呈茶褐色,絮状,表面有辐状沟纹,背面呈黄褐色,有淡黄色渗出液。分生孢子球形,褐色(见图1中B1、B2、B3)。
杂色曲霉(Aspergillusversicolor)4株(灰仓鼠杂色曲霉GZQ20120208GH3、GZQ20120208GH4、GZQ20120208GH33、GZQ20120208GH41在沙堡氏葡萄糖琼脂、改良马丁琼脂、皮肤病原真菌鉴别琼脂上生长缓慢。菌落呈白色,丝绒状,表面有辐射状沟纹,背面呈红褐色,有渗出液,有霉味。分生孢子球形(见图1中C1、C2、C3)。
聚多曲霉(Aspergillussydowii)15株(灰仓鼠聚多曲霉GZQ20120208GH11、GZQ20120208GH15、
GZQ20120208GH17、GZQ20120208GH18、GZQ20
120208GH19、GZQ20120208GH20、GZQ20120208
GH24、GZQ20120208GH25、GZQ20120208GH31、GZQ20120208GH34、GZQ20120208GH36、GZQ20
120208GH40、GZQ20120208GH44、GZQ20120208
GH46、GZQ20120208GH52在沙堡氏葡萄糖琼脂、改良马丁琼脂平板、皮肤病原真菌鉴别琼脂上生长缓慢。菌落呈蓝灰绿色,丝绒状,表面有辐射状沟纹,背面呈褐色,有渗出液,有霉味。分生孢子椭圆形(见图1中D1、D2、D3)。
黑曲霉(Aspergillusniger)2株(灰仓鼠黑曲霉GZQ20120208GH1、GZQ20120208GH12在沙堡氏葡萄糖琼脂、改良马丁琼脂上生长良好。菌落呈黑褐色,厚绒状,表面有射辐状沟纹,背面呈黄褐色。分生孢子头褐黑色放射状,分生孢子梗长短不一。顶囊球形,双层小梗。分生孢子褐色球形(见图1中E1、E2)。
日本曲霉(Aspergillusjaponicus)1株(灰仓鼠日本曲霉GZQ20120208GH53在沙堡氏葡萄糖琼脂、皮肤病原真菌鉴别琼脂上生长不良。菌落呈紫褐色,丝绒状,表面有不规则的浅皱纹,背面浅黄色,无渗出液。分生孢子球形(见图1中F1)。
宛氏拟青霉(Paecilomycesvariotii)12株(灰仓鼠宛氏拟青霉GZQ20120208GH9、GZQ20120208GH12、GZQ20120208GH32、GZQ20
2.报表填报不规范问题。一是建议加强教育主管部门与财政部门、财政业务部门与预算编审部门之间沟通,以便在预算下达时就能保持口径一致,避免高校财务人员凭职业判断来填报。二是建议主管部门每年编制完决算报表后,组织编报者进行学习总结,指出不规范的地方及其原因,防止在下一年度会计核算中重复出错。三是建议建立决算报表员交流平台,就如何提高决算报表质量、报表数据分析应用等相关情况展开经验讨论,有利于统一和提升业务能力、操作技能。
120208GH39、GZQ20120208GH42、GZQ20120208
GH49、GZQ20120208GH54、GZQ20120208GH55、GZQ20120208GH56、GZQ20120208GH58、GZQ20
120208GH59、GZQ20120208GH60在沙堡氏葡萄糖琼脂、改良马丁琼脂上生长良好。菌落黄褐色,棉絮状,背面黄色。分生孢子卵圆形(见图1中G1、G2)。
产黄青霉(Penicilliumchrysogenum)6株(灰仓鼠产黄青霉GZQ20120208GH5、GZQ20120208GH27、GZQ20120208GH29、GZQ20120208GH30、GZQ20120
208GH45、GZQ20120208GH57在沙堡氏葡萄糖琼脂、改良马丁琼脂上生长缓慢。菌落呈蓝绿色,丝绒状,表面有辐射状皱纹,背面浅黄褐色,有渗出液,无特殊气味。菌丝为有隔菌丝,菌丝被分隔成多个细胞,产生分散帚状枝分生孢子链,分生孢子为球形(见图1中H1、H2)。
黄灰青霉(Penicilliumaurantiogriseum)1株(灰仓鼠黄灰青霉GZQ20120208GH48在沙堡氏葡萄糖琼脂、改良马丁琼脂上生长缓慢。菌落呈青黄色,丝绒状,表面有辐射状皱纹,背面黄色,有渗出液,无特殊气味。菌丝为多细胞分枝。无性繁殖时,菌丝发生直立的多细胞分生孢子梗。梗的顶端不膨大,但具有可继续再分的指状分枝,每枝顶端有2-3个瓶状细胞,其上各生一串灰绿色分生孢子(见图1中I1)。 好食脉孢菌(Neurosporasitophila)1株(灰仓鼠好食脉孢菌GZQ20120208GH10在沙堡氏葡萄糖琼脂、改良马丁琼脂上生长良好。菌落呈桔黄色,棉絮状。具有疏松网状的长菌丝,有隔膜,分枝,多核;分生孢子卵圆形(见图1中J1、J2)。
间型脉孢菌(Neurosporaintermedia)2株(GZQ20120208GH37、GZQ20120208GH38)。芽枝状枝孢(Cladosporiumcladosporioides)1株(GZQ20120208GH14)。
白假丝酵母(Candidaalbicans)1株(灰仓鼠白假丝酵母GZQ20120208GH26在28℃、37℃均能生长,在沙堡氏葡萄糖琼脂、改良马丁琼脂、皮肤病原真菌鉴别琼脂上生长良好。菌落呈乳白色,乳酪样。假菌丝旁有卵圆形孢子(见图1中K1、K2、K3)。

图1 灰仓鼠真菌培养特性和形态照片
GH7、GZQ20120208GH8、GZQ20120208GH13、GZQ20120208GH28在沙堡氏葡萄糖琼脂、改良马丁琼脂上生长缓慢。菌落初呈灰白色、薄膜样,稍湿润,其后变为乳黄色、颗粒状、表面明显皱褶。分支分隔透明菌丝,椭圆形孢子,节孢子生出多个牙和牙管(见图1中L1、L2)。
部分生长不良及形态特征难以分辨的真菌菌株结合真菌核糖体基因克隆测序结果比对分析核实。本研究中灰仓鼠真菌分离培养鉴定结果显示,曲霉菌是最主要优势菌群,青霉菌是次优势菌群。
2.2灰仓鼠真菌药物敏感性试验结果 对灰仓鼠真菌进行药物敏感性试验,获得较好结果的有白假丝酵母(GZQ20120208GH26)、烟曲霉(GZQ201202
08GH22、GZQ20120208GH50、GZQ20120208GH51)、焦曲霉(GZQ20120208GH16)、日本曲霉(GZQ2012 0208GH53),结果显示,这些菌株对制霉菌素、克霉唑、沃尔康唑等药物敏感(表1)。

表1 灰仓鼠真菌药敏试验
2.3TaqMan MGB探针实时荧光定量PCR检测结果 本研究应用白假丝酵母TaqMan MGB探针实时荧光定量PCR从灰仓鼠中检出1份阳性样本GZQ20120208GH26(图略),该真菌菌株ITS和26S rRNA基因克隆测序结果已GenBank中与公布的Candidaalbicans核苷酸同源性高达100%(表略),其形态特征、培养特性和药敏结果均与白假丝酵母相似,命名为CAcm0208GH26,此为国内外首次发现灰仓鼠感染白假丝酵母(另文报道)。
2.4真菌核糖体PCR扩增和克隆测序结果 采用真菌通用引物,对抽提的灰仓鼠真菌DNA进行PCR扩增,经琼脂糖凝胶电泳检测,结果获得60株真菌的核糖体基因目的片段(图略),将获得60个目的基因片段回收纯化后进行克隆,选取60个分别插入目的基因片段的阳性重组质粒进行PCR扩增、酶切鉴定和测序(图表略)。将获得的60株灰仓鼠真菌核糖体基因序列在NCBI上进行Blast在线比对分析,结果显示灰仓鼠核糖体基因序列与GenBank中已公布的相关真菌序列同源性为99%~100%。
根据分离菌株核糖体基因克隆测序结果比对分析,60株灰仓鼠真菌菌株被证明是分布在曲霉属、青霉属、丝孢酵母属、假丝酵母属、脉孢属、枝孢属。具体分布如下:黑曲霉2株3.33%(2/60)、烟曲霉5株8.33%(5/60)、焦曲霉4株6.66%(4/60)、杂色曲霉4株6.66%(4/60)、日本曲霉1株1.66%(1/60)、聚多曲霉15株25%(15/60)、黄灰青霉1株1.66%(1/60)、产黄青霉6株10%(6/60)、宛氏拟青霉12株20%(12/60))、阿萨丝孢酵母5株8.33%(5/60)、白假丝酵母1株1.66%(1/60)、好食脉孢菌1株1.66%(1/60)、间型脉孢菌2株3.33%(2/60)、芽枝状枝孢1株1.66%(1/60)。真菌核糖体基因克隆测序比对分析结果显示灰仓鼠真菌具有多样性和丰富性(表2)。
3 讨 论
到目前为止,本文是第一个对灰仓鼠真菌多样性作了报道。作者首先以沙堡氏葡萄糖琼脂、改良马丁琼脂、皮肤病原真菌鉴别琼脂、改良马丁液体培养基为灰仓鼠真菌分离培养的基础培养基和鉴别培养基,分别选择在28 ℃、35 ℃适应性培养3~14 d,获得具有不同生长活性的灰仓鼠真菌分离株60株,最终明确了各类真菌的最佳培养条件和生长状况。

表2 灰仓鼠真菌核糖体基因克隆测序
表2续1
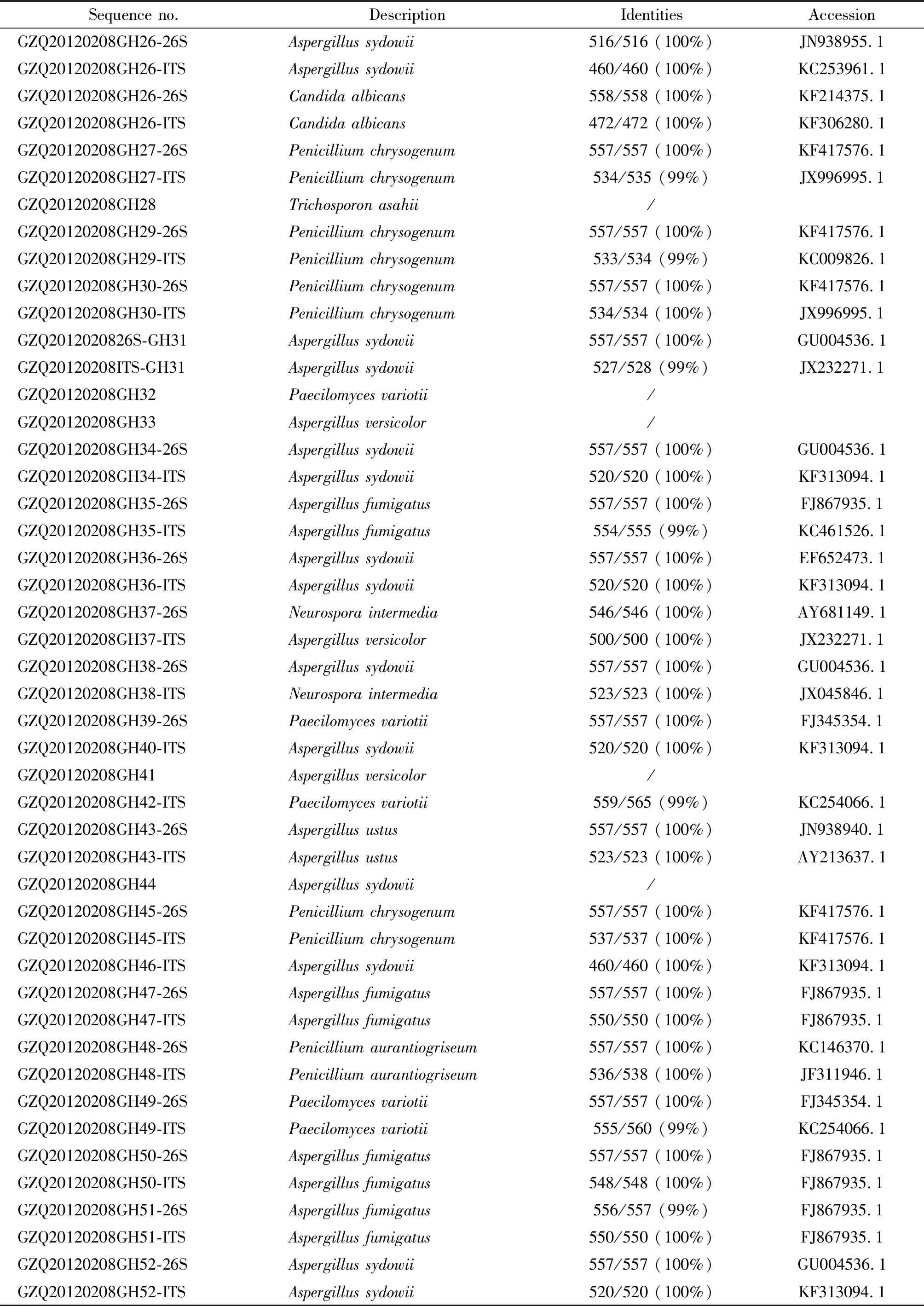
Sequence no.DescriptionIdentitiesAccessionGZQ20120208GH26-26SAspergillus sydowii516/516 (100%)JN938955.1GZQ20120208GH26-ITSAspergillus sydowii460/460 (100%)KC253961.1GZQ20120208GH26-26SCandida albicans558/558 (100%)KF214375.1GZQ20120208GH26-ITSCandida albicans472/472 (100%)KF306280.1GZQ20120208GH27-26SPenicillium chrysogenum557/557 (100%)KF417576.1GZQ20120208GH27-ITSPenicillium chrysogenum534/535 (99%)JX996995.1GZQ20120208GH28Trichosporon asahii/GZQ20120208GH29-26SPenicillium chrysogenum557/557 (100%)KF417576.1GZQ20120208GH29-ITSPenicillium chrysogenum533/534 (99%)KC009826.1GZQ20120208GH30-26SPenicillium chrysogenum557/557 (100%)KF417576.1GZQ20120208GH30-ITSPenicillium chrysogenum534/534 (100%)JX996995.1GZQ2012020826S-GH31Aspergillus sydowii557/557 (100%)GU004536.1GZQ20120208ITS-GH31Aspergillus sydowii527/528 (99%)JX232271.1GZQ20120208GH32Paecilomyces variotii/GZQ20120208GH33Aspergillus versicolor/GZQ20120208GH34-26SAspergillus sydowii557/557 (100%)GU004536.1GZQ20120208GH34-ITSAspergillus sydowii520/520 (100%)KF313094.1GZQ20120208GH35-26SAspergillus fumigatus557/557 (100%)FJ867935.1GZQ20120208GH35-ITSAspergillus fumigatus554/555 (99%)KC461526.1GZQ20120208GH36-26SAspergillus sydowii557/557 (100%)EF652473.1GZQ20120208GH36-ITSAspergillus sydowii520/520 (100%)KF313094.1GZQ20120208GH37-26SNeurospora intermedia546/546 (100%)AY681149.1GZQ20120208GH37-ITSAspergillus versicolor500/500 (100%)JX232271.1GZQ20120208GH38-26SAspergillus sydowii557/557 (100%)GU004536.1GZQ20120208GH38-ITSNeurospora intermedia523/523 (100%)JX045846.1GZQ20120208GH39-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH40-ITSAspergillus sydowii520/520 (100%)KF313094.1GZQ20120208GH41Aspergillus versicolor/GZQ20120208GH42-ITSPaecilomyces variotii559/565 (99%)KC254066.1GZQ20120208GH43-26SAspergillus ustus557/557 (100%)JN938940.1GZQ20120208GH43-ITSAspergillus ustus523/523 (100%)AY213637.1GZQ20120208GH44Aspergillus sydowii/GZQ20120208GH45-26SPenicillium chrysogenum557/557 (100%)KF417576.1GZQ20120208GH45-ITSPenicillium chrysogenum537/537 (100%)KF417576.1GZQ20120208GH46-ITSAspergillus sydowii460/460 (100%)KF313094.1GZQ20120208GH47-26SAspergillus fumigatus557/557 (100%)FJ867935.1GZQ20120208GH47-ITSAspergillus fumigatus550/550 (100%)FJ867935.1GZQ20120208GH48-26SPenicillium aurantiogriseum557/557 (100%)KC146370.1GZQ20120208GH48-ITSPenicillium aurantiogriseum536/538 (100%)JF311946.1GZQ20120208GH49-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH49-ITSPaecilomyces variotii555/560 (99%)KC254066.1GZQ20120208GH50-26SAspergillus fumigatus557/557 (100%)FJ867935.1GZQ20120208GH50-ITSAspergillus fumigatus548/548 (100%)FJ867935.1GZQ20120208GH51-26SAspergillus fumigatus556/557 (99%)FJ867935.1GZQ20120208GH51-ITSAspergillus fumigatus550/550 (100%)FJ867935.1GZQ20120208GH52-26SAspergillus sydowii557/557 (100%)GU004536.1GZQ20120208GH52-ITSAspergillus sydowii520/520 (100%)KF313094.1
表2续2

Sequence no.DescriptionIdentitiesAccessionGZQ20120208GH53-ITSAspergillus japonicus/GZQ20120208GH54-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH54-ITSPaecilomyces variotii499/500 (100%)GQ351694.1GZQ20120208GH55-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH55-ITSPaecilomyces variotii457/461 (99%)KC895544.1GZQ20120208GH56-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH56-ITSPaecilomyces variotii394/399 (99%)KC254066.1GZQ20120208GH57-26SPenicillium chrysogenum557/557 (100%)KF417576.1GZQ20120208GH57-ITSPenicillium chrysogenum556/556 (100%)JX136729.1GZQ20120208GH58-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH58-ITSPaecilomyces variotii559/565 (99%)KC254066.1GZQ20120208GH59-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH59-ITSPaecilomyces variotii559/565 (99%)GU968674.1GZQ20120208GH60-26SPaecilomyces variotii557/557 (100%)FJ345354.1GZQ20120208GH60-ITSPaecilomyces variotii504/515 (99%)GU968674.1
通过实时监测摄录,获得多种真菌在不同培养基上的生长特性表现和菌丝孢子形态学宝贵视频资料。参考文献[3]中描述的菌落特征、显微菌丝和孢子特征进行分类鉴定,对灰仓鼠真菌的归类有了初步了解。总的来说,60株真菌中曲霉属和青霉属真菌用常规方法比较容易鉴别,但丝孢酵母属、假丝酵母属、脉孢属、枝孢属却因生长不良或形态特征不典型而难以辨别。为了弥补常规方法的不足,在本研究中,作者首次应用荧光定量PCR和基因克隆测序技术,对获得的有生长活性的60株灰仓鼠真菌分离株进行了基因水平上的核实确定,为真菌菌种的快速准确鉴定提供了新的思路,对真菌的分离鉴定和菌种库的建立具有一定的指导意义。本研究通过对灰仓鼠真菌数量和真菌的主要类群的研究,为研究灰仓鼠微生物多样性提供了原始材料和数据资料,也为今后的深入研究提供研究基础。
真核物种的总数在地球上最近估计为870万,真菌占大约7%这个数字(611000种)。所有的真菌,其中大约有600种是人类病原体。本研究获得的60株灰仓鼠真菌主要为曲霉属、青霉属、丝孢酵母属、假丝酵母属、脉孢属、枝孢属的真菌。参考文献[8-11]人兽共患病病原体中100多种真菌名录,显示本研究中灰仓鼠携带的白假丝酵母、阿萨丝孢酵母、聚多曲霉、烟曲霉、焦曲霉、杂色曲霉、黑曲霉、日本曲霉、宛氏拟青霉、产黄青霉、黄灰青霉、好食脉孢菌、间型脉孢菌、芽枝状枝孢等近20种真菌是人兽共患病病原体。白假丝酵母感染可引起肺炎、肠胃炎、心内膜炎、脑膜炎、脑炎、败血症等。阿萨丝孢酵母可引起白毛结节病、皮肤及播散性丝孢酵母菌病。烟曲霉、焦曲霉、黑曲霉、杂色曲霉感染所致侵袭性肺曲霉病是致死性感染的主要原因[12-16]。目前,我国正处在对灰仓鼠进行实验动物化的驯化进程中,因此,及时准确做好新培育物种微生物监测分析工作,对预防控制相关人兽共患疫病爆发流行作用巨大。
综上所述,本研究应用TaqMan MGB探针实时荧光定量PCR、核糖体克隆测序、真菌培养鉴定技术,首次对灰仓鼠携带真菌的多样性进行了研究,获得了较为全面的结果。数据分析结果证明灰仓鼠体内生存着大量的真菌种类,具有丰富的真菌群落多样性和复杂性。今后,我们还将进一步应用宏基因组分析技术,对灰仓鼠中可能存在但用现行培养方法无法获得的微生物展开深入调查研究,获得更多更全面的关于灰仓鼠微生物多样性的数据,为我国灰仓鼠微生物学监测以及质量标准的制定提供科学参考依据,也为灰仓鼠这一具有特殊潜力、尚待实验动物化的物种新资源的开发提供有效理论依据和丰富基础研究。
参考文献:
[1]Gao ZQ, He ZM, Yue BF, et al. Identification and susceptibility test of bacteria isolated from the trachea and ileocecal junction of grey hameters which came from Xinjiang area of China[J]. Lab Anim Comp Med, 2009, 29 (2): 93-99. (in Chinese)
高正琴, 贺争鸣, 岳秉飞, 等. 中国灰仓鼠气管和回盲部细菌分离鉴定及药敏试验[J]. 实验动物与比较医学. 2009, 29(2): 93-99.
[2]Gao ZQ, Xing J, Feng YF, et al.Monitor and analysis bacterial diversity of Cricetulus migratorius by TaqMan MGB probe real-time fluorescence quantitative PCR and bacteria isolation culture[J]. Chin J Pharm Anal, 2014, 34(2):22-28. (in Chinese)
高正琴, 邢进, 冯育芳, 等. 应用TaqMan MGB探针实时荧光定量PCR结合分离培养监测分析灰仓鼠细菌多样性[J]. 药物分析杂志. 2014, 34(2): 221-227.
[3]Wei JC. The identification manual of fungi[M]. Shanghai: Shanghai Science and Technology Press: 1979. (in Chinese)
魏景超. 真菌鉴定手册[M]. 上海: 上海科技出版社出版: 1979.
[4]Espinel-Ingroff A, Canton E, Fothergill A, et al. Quality control guidelines for amphotericin B, Itraconazole, posaconazole, and voriconazole disk diffusion susceptibility tests with nonsupplemented Mueller-Hinton Agar (CLSI M51-A document) for nondermatophyte filamentous fungi[J]. J Clin Microbiol, 2011, 49(7): 2568-2571. DOI: 10.1128/JCM.00393-11.
[5]National Committee for Clincial Laboratory Standards. Method for antifugal disk diffusion susceptibility testing of yeasts: approved guideline M44-A[S]. Wayne: NCCLS, 2004.
[6]White TJ, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]. In: Innis MA, Gelfand DH, Sninsky JJ, et al., editors. PCR protocols: a guide to methods and application. New York: Academic Press Inc. 1990: 315-322.
[7]Kurtzman CP, Robnett CJ. Identification of clinically important ascomycetous yeasts based on nucleotide divergence in the 5′ end of the large-subunit (26S) ribosomal DNA gene[J]. J Clin Microbiol, 1997, 35(5): 1216-1223.
[8]Mora C, Tittensor DP, Adl S, et al. How many species are there on Earth and in the ocean? [J]. PLoS Biol, 2011, 9(8): 1-8. DOI: 10.1371/journal.pbio.1001127
[9]Taylor LH, Latham SM, Woolhouse ME. Risk factors for human disease emergence[J]. Philos Trans R Soc Lond B Biol Sci,2001, 356 (1411): 983-989. DOI: 10.1098/rstb.2001.0888
[10]Woolhouse ME, Gowtage-Sequeria S. Host range and emerging and reemerging pathogens[J]. Emerg Infect Dis,2005, 1(12): 1842-1847. DOI: 10.3201/eid1112.050997
[11]Yu ES, Huang F, Pan L, et al. Zoonotic pathogens species[J]. Chin J Zoonoses, 2006, 22 (6): 485-492. (in Chinese)
于恩庶, 黄丰, 潘亮, 等. 当今人兽共患病病原体分类[J]. 中国人兽共患病学报,2006, 22 (6): 485-492.
[12]Mayer FL, Wilson D, Hube B.Candidaalbicanspathogenicity mechanisms[J]. Virulence, 2013, 4(2): 119-128. DOI: 10.4161/viru.22913
[13]Servonnet A, Bourgault M, Trueba F, et al. DisseminatedTrichosporonasahiiinfection[J]. Ann Biol Clin, 2010, 68(3): 363-366. DOI: 10.1684/abc.2010.0444
[14]Dagenais TR, Keller NP. Pathogenesis ofAspergillusfumigatusin invasive aspergillosis[J]. Clin Microbiol Rev, 2009, 22(3): 447-465. DOI: 10.1128/CMR.00055-08
[15]Person AK, Chudgar SM, Norton BL, et al.Aspergillusniger: an unusual cause of invasive pulmonary aspergillosis[J]. J Med Microbiol, 2010, 59(7): 834-838. DOI: 10.1099/jmm.0.018309-0
[16]Charles MP, Joseph NM, Easow JM, et al. Invasive pulmonary aspergillosis caused byAspergillusversicolorin a patient on mechanical ventilation[J]. Australas Med J, 2011, 4(11): 632-634. DOI: 10.4066/AMJ.2011.905
