刚地弓形虫MIC2与醛缩酶作用位点的鉴定
2014-04-02尹志奎姚志军张海珠任红斌詹希美
郑 斌,尹志奎,姚志军,张海珠,任红斌,詹希美
刚地弓形虫(Toxoplasmagondii,Tg)为人兽共患弓形虫病(Toxoplasmosis)的病原体。虫体感染宿主时,主动入侵宿主细胞,并在细胞内发育、增殖[1]。微线体蛋白(microneme protein, MIC)是由弓形虫顶端胞器微线体分泌的一类蛋白,在虫体入侵细胞时发挥重要功能[2]。研究发现部分敲除MIC2后,虫体的粘附和入侵能力下降了78%[3]。MIC2为Ⅰ型跨膜蛋白,位于胞外的氨基端(N端)识别、粘附宿主细胞;位于胞内的羧基端(C端)和醛缩酶相互作用,由醛缩酶介导与虫体的肌动蛋白-肌球蛋白动力系统偶联[4]。本研究对弓形虫MIC2与醛缩酶的作用位点进行了探讨,旨在为揭示MIC2的生物学功能和弓形虫的入侵机制奠定基础。
1 材料与方法
1.1材料
1.1.1弓形虫虫株、质粒和主要仪器 弓形虫强毒株(RH株)和原核表达载体pGEX-4T-1由中山大学中山医学院寄生虫学研究室传代保种。蛋白电泳及电转移装置(Mini-PROTEIN 3 Cell)为Bio-Rad公司产品;核酸蛋白质分析仪(BeckmanDU640)为Beckman公司产品。
1.1.2主要试剂EcoRI 和SmaI 限制性内切酶为NEB公司产品;GST pull-down用sepharose(Glutathione sepharoseTM4B)、GST融合蛋白亲和纯化柱(GSTrap FF)购自Amersham Biosciences公司;硝酸纤维素膜(NC)为PALL公司产品;免疫印迹增强化学发光法(ECM)试剂盒(兔IgG)购自Promege公司;X感光胶片为Kodak产品;显影液和定影液购自武汉博士德公司;GST-MIC2C蛋白和抗醛缩酶多克隆抗体(anti-aldolase)为本研究室前期制备[5-6]。
1.2实验方法
1.2.1MIC2C W/A/pGEX-4T-1重组原核表达系统的构建 根据报道的弓形虫RH株MIC2的基因序列(U62660)[7],将MIC2 C端767位色氨酸(W)突变为丙氨酸(A),设计1对特异性引物并合成(上游引物:5’-GAACCCGGGAGTTACCACTACTATTTGAGCTC-3’,下游引物:5’-GGGGAAT
TCCTACTCCATCGCCATATCACTATCGTC-3’,其中CCCGGG为SmaI 酶切位点,GAATTC为EcoRI 酶切位点)。按照文献[8]的方法完成MIC2C W/A基因片段的PCR扩增及MIC2C W/A/pGEX-4T-1重组原核表达系统的构建。
1.2.2GST-MIC2C W/A突变体融合蛋白的制备 GST-MIC2C W/A突变体融合蛋白的诱导表达、纯化及蛋白浓度分析具体操作见文献[8]。
1.2.3GST pull-down实验鉴定蛋白作用位点 制备新鲜弓形虫速殖子裂解液,分别以GST-MIC2CW/A突变体蛋白和GST-MIC2C蛋白(阳性对照)作为探针蛋白与弓形虫速殖子裂解液进行pull-down实验,具体操作见文献[9],实验产物常规处理,SDS-PAGE及Western blot分析。
2 结 果
2.1弓形虫MIC2C W/A突变体基因片段的PCR扩增 以弓形虫cDNA第1链为模板,PCR扩增MIC2CW/A基因片段,1.5%琼脂糖凝胶电泳。结果显示在100~200 bp之间有一条带,与目的基因片段大小相符(图1)。

图1MIC2CW/A基因片段PCR产物
Fig.1PCRproductsofMIC2CW/Agenefragment
M: 100 bp DNA ladder;1-2: PCR products of MIC2C W/A gene fragment.
2.2GST-MIC2C W/A融合蛋白的表达 37 ℃,IPTG 1 mmol/L的条件下诱导表达GST-MIC2C W/A融合蛋白,SDS-PAGE分析(图2)。结果显示在诱导1~7 h均有目的蛋白表达(箭头示)。大量摇菌,诱导表达目的蛋白,GSTrap FF纯化融合蛋白,核酸蛋白分析仪分析GST-MIC2C W/A突变体蛋白的浓度为2.55 mg/ml。
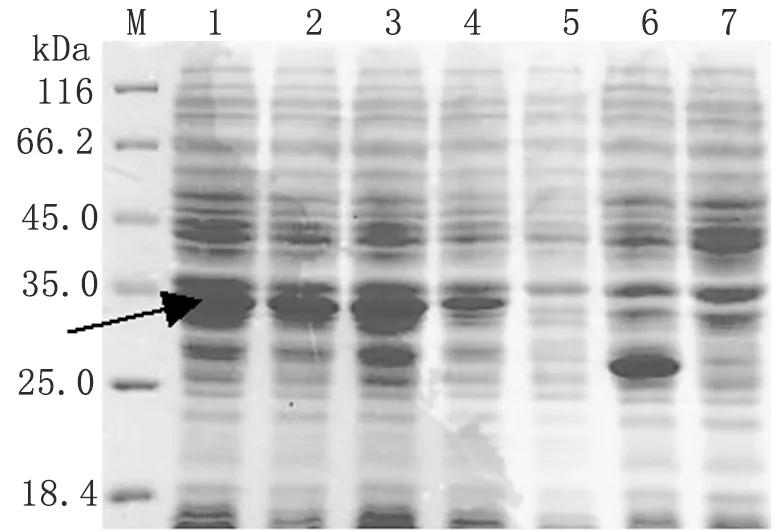
图2GST-MIC2CW/A融合蛋白表达条件的优化
Fig.2OptimumconditionfortheexpressionofGST-MIC2CW/Afusionprotein
M: Protein molecular weight marker; 1-4: MIC2C W/A/pGEX-4T-1/BL21 induced by IPTG 7, 5, 3, and 1 h respectively; 5: MIC2CW/A/pGEX-4T-1/BL21 uninduced; 6: pGEX-4T-1/BL21 induced by IPTG 7 h; 7: BL21 induced by IPTG 7 h.
2.3GST pull-down产物的SDS-PAGE及Western blot分析 以GST-MIC2C W/A蛋白为探针蛋白,与弓形虫速殖子裂解液进行pull-down实验,实验产物常规处理。以GST-MIC2C蛋白与弓形虫速殖子裂解液进行pull-down实验的产物为对照,共同进行SDS-PAGE和Western blot分析(图3)。结果表明GST-MIC2C蛋白的pull-down产物中可见一蛋白条带,可被醛缩酶抗体(anti-aldolase)识别,而GST-MIC2C W/A蛋白的pull-down产物中则未见蛋白条带。

图3GSTpull-down产物的SDS-PAGE和Westernblot分析
Fig.3SDS-PAGEandWesternblotanalysisofproductsfromGSTpull-downexperiment
M: Protein molecular weight marker; 1:T.gondiilysate; 2: The products of GST-MIC2C protein pull-down; 3: GST-MIC2C protein; 4: The products of GST-MIC2C W/A protein pull-down; 5: GST-MIC2C W/A protein.
3 讨 论
伯氏疟原虫的血小板反应蛋白相关未知蛋白(Thrombospondin-related anonymous proteins, TRAP)和环子孢子蛋白TRAP相关蛋白(CS protein-TRAP-ralated protein, CTRP)C端的色氨酸(W)对应密码子的碱基突变后,疟原虫的子孢子和动合子则不能运动,而且失去入侵宿主细胞的能力[10-12]。Clustalw对比分析疟原虫TRAP、CTRP和弓形虫MIC2的C端序列,结果提示蛋白C端的色氨酸(W)为保守氨基酸(图4),由此推测弓形虫MIC2 C端的W可能为其关键氨基酸位点。

图4弓形虫MIC2、恶性疟原虫CTRP和TRAP蛋白序列的对比分析
Fig.4ProteinsequencealignmentofTgMIC2,PfCTRPandPfTRAP
体外定点突变技术是研究基因和蛋白质结构、功能的重要技术[13-14]。利用该技术,弓形虫致密颗粒蛋白(dense granule proteins,GRAs)在蛋白切割中的作用及抑制蛋白(profilin)β-hairpin的功能得以揭示[15-16]。常用的定点突变方法有盒式突变、寡核苷酸引物介导的定点突变及PCR 介导的定点突变等。定点突变技术多用于单个或几个核苷酸的变异,若需要变异多个核苷酸或对基因组进行编辑、修饰等,则采用锌指核酸酶(Zinc-finger nuclease, ZFN)、类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease, TALEN)和成簇的规律间隔的短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)等技术[17]。已经运用TALENs对线虫的基因组进行了定点编辑,弓形虫基因组的编辑、修饰还未见报道[18]。本研究采用核苷酸引物介导的突变方法将MIC2的W突变为A。用制备的GST-MIC2C W/A突变体蛋白作为探针蛋白与弓形虫裂解液进行GST pull-down实验,GST-MIC2C蛋白为对照,结果显示GST-MIC2C W/A突变体蛋白不能沉降弓形虫裂解液中的醛缩酶蛋白,即当W变为A时,MIC2C与醛缩酶之间的相互作用消失,从而证明W为两蛋白的相互作用位点。
参考文献:
[1]Amerizadeh A, Khoo BY, Teh AY, et al. Identification and real-time expression analysis of selectedToxoplasmagondiiin-vivo induced antigens recognized by IgG and IgM in sera of acute toxoplasmosis patients[J]. BMC Infect Dis, 2013, 13(1): 287. DOI: 10.1186/1471-2334-13-287
[2]Saouros S, Dou Z, Henry M, et al. Microneme protein 5 regulates the activity ofToxoplasmasubtilisin 1 by mimicking a subtilisin prodomain[J]. J Biol Chem, 2012, 287(43): 36029-36040. DOI: 10.1074/jbc.M112.389825
[3]Jewett TJ, Sibley LD. Aldolase forms a bridge between cell surface adhesins and the actin cytoskeleton in apicomplexan parasites[J]. Mol Cell, 2003, 11(4): 885-894. DOI: 10.1016/S1097-2765(03)00113-8
[4]Huynh MH, Carruthers VB.ToxoplasmaMIC2 is a major determinant of invasion and virulence[J]. PLoS Pathog, 2006, 2(8): e84. DOI: 10.1371/journal.ppat.0020084
[5]Yin ZK, Zheng B, Zhan XM. Preparation of the cytosolic tail domain ofToxoplasmagondiimicroneme protein 2 and its polyclonal antibody[J]. Biotechnology, 2013, 23(1): 45-48. (in Chinese)
尹志奎,郑斌,詹希美. 弓形虫MIC2胞质尾蛋白及其多克隆抗体的制备[J]. 生物技术,2013,23(1):45-48.
[6]Yin ZK, Deng ZJ, Zheng B. Expression of aldolase ofToxoplasmagondiiand preparation of the polyclonal antibodies against this protein[J]. Chin J Cell Mol Immunol, 2011, 27(10): 1114-1116. (in Chinese)
尹志奎,邓智建,郑斌. 刚地弓形虫醛缩酶蛋白的表达及其多克隆抗体的纯化[J]. 细胞与分子免疫学杂志,2011,27(10):1114-1116.
[7]Wan KL, Carruthers VB, Sibley LD, et al. Molecular characterisation of an expressed sequence tag locus ofToxoplasmagondiiencoding the micronemal protein MIC2[J]. Mol Biochem Parasitol, 1997, 84(2): 203-214.
[8]Zheng B, He A, Li ZY, et al. Production of the carboxyl terminal fragment ofToxoplasmagondiimicroneme protein 6 (TgMIC6C) and its polyclonal antibody[J]. Chin J Zoonoses, 2009, 25(9): 870-874. (in Chinese)
郑斌,何蔼,李卓雅,等. 弓形虫MIC6羧基端蛋白片段的表达及其多克隆抗体的制备[J]. 中国人兽共患病学报,2009,25(9):870-874.
[9]Zheng B, Yin ZK, He A, et al. Screening the protein interacts with C terminal of MIC6 ofToxoplasmagondii[J]. Chin J Zoonoses, 2011, 27 (11): 970-974. (in Chinese)
郑斌, 尹志奎, 何蔼, 等. 弓形虫MIC6羧基端相互作用蛋白的筛选[J]. 中国人兽共患病学报, 2011,27 (11):970-974.
[10]Dessens JT, Beetsma AL, Dimopoulos G, et al. CTRP is essential for mosquito infection by malaria ookinetes[J]. EMBO J, 1999, 18(22): 6221-6227.
[11]Sultan AA, Thathy V, Frevert U, et al. TRAP is necessary for gliding motility and infectivity ofplasmodiumsporozoites[J]. Cell, 1997, 90(3): 511-522.
[12]Yuda M, Sakaida H, Chinzei Y. Targeted disruption of thePlasmodiumbergheiCTRP gene reveals its essential role in malaria infection of the vector mosquito[J]. J Exp Med, 1999, 190(11): 1711-1716.
[13]Adachi Y, Fukuhara C. TA strategy for rapid and efficient site-directed mutagenesis[J]. Anal Biochem, 2012, 431(1): 66-68. DOI: 10.1016/j.ab.2012.08.030
[14]Wan H, Li Y, Fan Y, et al. A site-directed mutagenesis method particularly useful for creating otherwise difficult-to-make mutants and alanine scanning[J]. Anal Biochem, 2012, 420(2): 163-170. DOI: 10.1016/j.ab.2011.09.019
[15]Hsiao CH, Luisa Hiller N, Haldar K, et al. A HT/PEXEL motif inToxoplasmadense granule proteins is a signal for protein cleavage but not export into the host cell[J]. Traffic, 2013, 14(5): 519-531. DOI: 10.1111/tra.12049
[16]Kucera K, Koblansky AA, Saunders LP, et al. Structure-based analysis ofToxoplasmagondiiprofilin: a parasite-specific motif is required for recognition by Toll-like receptor 11[J]. J Mol Biol, 2010, 403(4): 616-629. DOI: 10.1016/j.jmb.2010.09.022
[17]Gaj T, Gersbach CA, Barbas CF 3rd. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering[J]. Trends Biotechnol, 2013, 31(7): 397-405. DOI: 10.1016/j.tibtech.2013.04.004
[18]Wood AJ, Lo TW, Zeitler B, et al. Targeted genome editing across species using ZFNs and TALENs[J]. Science, 2011, 333(6040): 307. DOI: 10.1126/science.1207773
