Sjcb2 DNA疫苗在血吸虫感染小鼠中的保护性作用研究
2014-04-02冯安贵高勇强张愉快王可耕陈姗姗肖建华
冯安贵,高勇强,梁 瑜,吴 媛,陈 鹄,张愉快,王可耕,陈姗姗,肖建华
日本血吸虫病是一种严重危害人体健康的人兽共患病,目前尚无有效的疫苗控制疾病的传播,研制有效的疫苗及寻找有效的疫苗候选分子成为血吸虫病研究的重点与热点[1-2]。随着现代分子生物学及免疫学的发展, 血吸虫病疫苗已由灭活疫苗、减毒活疫苗和基因工程重组蛋白疫苗发展到核酸疫苗[3-4]。核酸疫苗是快速发展起来的新型疫苗,包括DNA疫苗和cDNA疫苗,是由编码抗原基因或基因片段插入质粒载体中构成重组质粒,接种后能被机体组织细胞摄取和在细胞内表达,表达的目的抗原分子能刺激机体免疫系统,诱导细胞免疫和体液免疫,达到抗感染的目的[5]。日本血吸虫在其寄生生活中,需要不断地从宿主体内摄取营养以满足其生长、发育和生存的需要。我们前期在对日本血吸虫基因组的研究中发现了一新基因—组织蛋白酶 B 肽链内切酶B2(Schistosomajaponicumcathepsin B peptide enzyme 2,Sjcb2),其基因登录号为AY226984,研究显示Sjcb2能降解宿主血红蛋白,为血吸虫生长发育提供必需的营养,同时也是一个重要的致病因子[6-7]。为了进一步研究Sjcb2能否作为疫苗候选抗原分子,我们通过构建Sjcb2核酸疫苗,免疫动物,检测其抗血吸虫感染作用,以便为日本血吸虫疫苗研究提供新的候选分子。
1 材料与方法
1.1实验材料 pcDNA3.1(+)Sjcb2 质粒由本研究所保存;噻唑蓝(MTT)购于Sigma公司;RNA酶、DNA酶购于 Promega 公司;一抗:鼠抗日本血吸虫免疫血清,本实验室制备,二抗:生物素标记的羊抗鼠抗抗体,辣根过氧化物酶(HRP)标记的羊抗鼠 IgG 购于北京中山生物公司;BALB /c小鼠由南华大学实验动物部提供;含尾蚴的阳性钉螺购自湖南省岳阳市血吸虫病防治研究所。
1.2方法
1.2.1pcDNA3.1(+) /Sjcb2核酸疫苗的免疫接种 105只雌性BALB /c小鼠随机分为3组,每组20只,即DNA疫苗组(pcDNA3.1/Sjcb2)、pcDNA3.1组和生理盐水组;将提取的pcDNA3.1(+) /Sjcb2重组质粒和pcDNA3.1(+)空质粒DNA分别用灭菌双蒸水稀释至1 μg/μL。 pcDNA3.1(+)/Sjcb2重组质粒组与pcDNA3.1质粒组每只小鼠股四头肌接种质粒DNA 100 μg /次,生理盐水组接种生理盐水100 μL /次,每2周免疫1次,共免疫3次。
1.2.2PCR法检测Sjcb2基因在小鼠肌细胞内的稳定性 第1次免疫后1、3、7、10、14及第2次免疫后14 d,第3次免疫后14 d和28 d,每组取小鼠 3只,麻醉后断颈法处死小鼠,取腿部肌肉提取总DNA,使用Sjcb2特异性引物,扩增Sjcb2基因。
1.2.3免疫组化法检测Sjcb2基因在小鼠肌细胞内的表达 在末次免疫后14 d,每组取3只小鼠,其股四头肌用4% 甲醛固定4 h后,常规做石蜡切片,用免疫组化检测,并置光学显微镜下观察和拍照。
1.2.4攻击感染及免疫效果测定 第3次免疫后14 d 每鼠经腹部皮肤感染40条活尾蚴,饲养42 d后麻醉处死全部小鼠;用生理盐水经门静脉灌注,收集成虫和计数,然后将肝脏取出并拍照,秤重后剪碎置于10 mL 5%KOH溶液中,37 ℃消化24 h,进行虫卵计数,根据获得的成虫和虫卵数量计算出减虫率和减卵率,并进行统计学分析。
1.2.5MTT法检测淋巴细胞体外增殖试验 尾蚴攻击感染前2周每组取5只小鼠剖杀,进行脾淋巴细胞的体外增殖试验。小鼠脾淋巴细胞的分离与小鼠脾细胞的细胞因子检测,台盼蓝染色法计数后调整细胞浓度,以每孔103~104个细胞接种于96孔培养板中,每孔体积200 μL,每组分别用培养液、可溶性成虫抗原(soluble worm antigen, SWA)10 μg/mL和PHA 进行刺激,培养板置于CO2培养箱,37 ℃培养72 h后,每孔加入MTT溶液(5 mg/mL)20 μL继续培养4 h,终止培养,800 r/min离心15 min离心弃上清,每孔加入150 μL DMSO,振荡10 min,检测每孔OD570nm值进行统计学分析。
1.2.6细胞因子测定 于尾蚴攻击感染前2周及攻击感染后10 d,每组取5只小鼠,在无菌条件麻醉后处死小鼠,分别取其脾脏进行研磨,用200目尼龙网过滤,收集细胞悬液,1 000 r/min离心5 min收集细胞,加入适量0.83% NH4Cl溶解红细胞,1 000 r/min离心5 min,细胞中加入PBS洗涤1次,1 000 r/min离心5 min收集细胞,加入含10% 小牛血清的 RPMI 1640完全培养基,台盼蓝染色法对脾细胞进行计数,活细胞数达90%以上,调整细胞浓度为6×106/mL,接种于24孔板中,1 mL /孔;每组分别用10 μg/mL 的SWA或PHA刺激,空白孔加培养液;置CO2培养箱37 ℃ 培养72 h,离心取上清,采用双抗体夹心法检测细胞因子含量。
1.2.7抗体水平的检测 分别于免疫前、第1次免疫后第1 d、3 d、7 d、10 d、14 d及第2次免疫后14 d、第3次免疫后14 d及尾蚴攻击感染后10 d采血,分离小鼠血清,-20 ℃保存备用。以Sjcb2为抗原,免疫后小鼠血清为待测血清,采用间接ELISA法检测 IgG 抗体滴度。将Sjcb2稀释至10 μg/mL,将待测血清按1∶40、1∶80、1∶160、1∶320、1∶640和1∶1 280进行稀释,每孔加入碳酸盐缓冲液稀释的Sjcb2抗原100 μL,4 ℃包被过夜(或37 ℃ 2 h),用PBST洗板3次,每次5 min;每孔加入封闭液300 μL,37 ℃温育 2 h,PBST洗板3次;每孔加入稀释后待检血清 100 μL,37℃作用 1.5 h,PBST洗板3次;每孔加入稀释后酶标二抗 100 μL,37 ℃ 作用1.5 h,PBST洗板3次;每孔加入底物 100 μL,37 ℃避光反应 30 min。终止反应后测定 OD490nm值。
2 结 果
2.1Sjcb2基因片段的体外扩增 提取 pcDNA3.1(+)/Sjcb2重组质粒DNA,以其为模板特异性扩增Sjcb2基因片段,结果显示:能特异性扩增出约1 100 bp的新条带,大小与Sjcb2基因片段相符(见图1)。

图1PCR扩增Sjcb2基因
Fig.1AmplificationofSjcb2genebyPCR
1:pcDNA3.1(+)/Sjcb2为模板(pcDNA3.1 (+)/Sjcb2 as a template); 2: pcDNA3.1为模板(pcDNA3.1 as a template); M: DNA Marker
2.2pcDNA3.1(+)/Sjcb2重组质粒的酶切鉴定 将pcDNA3.1(+)/Sjcb2重组质粒进行序列测定确认后,用EcoRⅠ和XbaⅠ双酶切鉴定,结果显示:重组质粒经双酶切后可见大小为1 100 bp条带,与Sjcb2基因片段大小相符(见图2)。

图2pcDNA3.1(+)/Sjcb2双酶切鉴定
Fig.2IdentificationofpcDNA3.1(+)/Sjcb2bydoubleenzyme
M: DNA markers; 1: 重组质粒pcDNA3.1(+)/Sjcb2 (The recombinant plasmid of pcDNA3.1 (+)/Sjcb2); 2: pcDNA3.1(+)/Sjcb2EcoRⅠ和XbaⅠ双酶切 (pcDNA3.1(+)/Sjcb2 digested byEcoRⅠandXbaⅠ);3: PCR产物(PCR products)
2.3PCR法检测 pcDNA3.1(+)/Sjcb2核酸疫苗的稳定性 在DNA疫苗免疫后的不同时间点,用PCR法检测小鼠股四头肌组织内Sjcb2基因片段,结果显示:疫苗组均能扩增出Sjcb2特异性条带,而pcDNA3.1组和生理盐水组均未扩增出条带(图3)。

图3PCR检测pcDNA3.1(+)/Sjcb2在肌肉组织内的稳定性
M:DNA Maker;1: 非免疫小鼠(None immunized group); 2: 生理盐水组(saline group); 3: pcDNA3.1(+)组(pcDNA3.1(+)group); 4: pcDNA3.1(+)/Sjcb2组(pcDNA3.1(+) /Sjcb2 group); 5: PCR产物(PCR products)
Fig.3DetectionofthestabilityofpcDNA3.1(+)/Sjcb2inthemuscletissuebyPCR
2.4免疫组化法检测Sjcb2基因在小鼠肌细胞内的表达 取小鼠后腿股四头肌组织制备切片,按SABC试剂盒说明书操作,结果显示:pcDNA3.1(+)/Sjcb2重组质粒组小鼠肌细胞区域可见棕黄色颗粒(图4)。

图4免疫组化法检测Sjcb2基因在小鼠肌细胞内的表达
Fig.4DetectionofSjcb2expressioninthemusclecellsofmicebyimmunohistochemicalstain
A: Vaccine group (10×10);
B: Control group (10×10);
C: Vaccine group (10×20);
D: Control group (10×20).
2.5MTT法体外检测淋巴细胞增殖 结果显示:疫苗组脾淋巴细胞受SWA刺激后显著增殖,OD570nm值达0.4092±0.0138,DNA疫苗组与pcDNA3.1组和生理盐水组比较,在SWA或PHA处理时,脾淋巴细胞增殖有显著性差异,P<0.05;未加刺激物处理时,无明显差异,P>0.05;pcDNA3.1组和生理盐水组比较,SWA和PHA处理均无显著性差异,P>0.05(图5)。
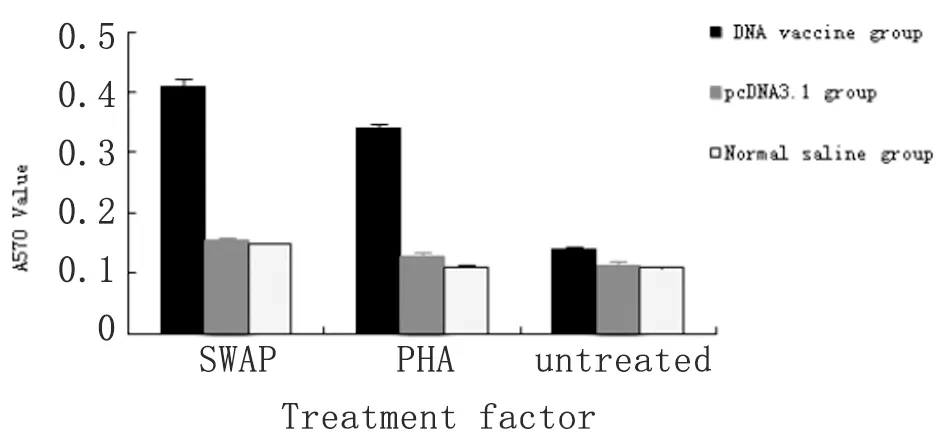
图5MTT法检测免疫后小鼠脾细胞增殖
Fig.5DeterminedproliferationrateofimmunizedmicespleencellsbyMTTmethod
2.6细胞因子检测 尾蚴攻击攻击前2周,分别取各组小鼠脾细胞加入PHA或SWA进行刺激,结果显示:DNA疫苗组分泌IFN-γ的水平显著高于pcDNA3.1组和生理盐水组,P<0.01,未加刺激物处理时,则无显著性差异,P>0.05;pcDNA3.1组和生理盐水组比较,SWAP和PHA处理均无显著性差异,P>0.05。攻击感染前分泌IL-4的水平,DNA疫苗组与pcDNA3.1组和生理盐水组相比均无显著性差异(P>0.05)。尾蚴攻击感染后10 d,脾细胞培养液中加入PHA或SWA刺激时,DNA疫苗组IFN-γ仍维持较高水平,与pcDNA3.1组和生理盐水组比较均有显著性差异(P<0.01)。攻击感染后,IL-4的水平在DNA疫苗组与pcDNA3.1组和生理盐水组相比无显著性差异(P>0.05)。攻击感染后与攻击感染前比较,DNA疫苗组、pcDNA3.1组和生理盐水组脾细胞分泌IFN-γ的水平均无显著性差异,P>0.05(图6);而分泌 IL-4的水平均在感染攻击后显著升高,P<0.05,且pcDNA3.1组和生理盐水组升高程度极为显著,P<0.01(图7)。
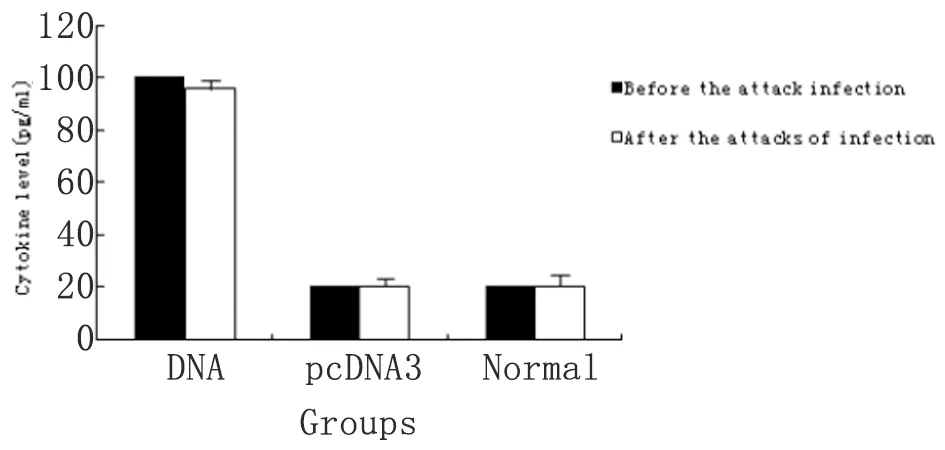
图6攻击感染前后小鼠脾细胞培养上清IFN-γ水平
Fig.6TheIFN-γlevelsofspleencellculturesupernatantofmicebeforeandafterattackinfection

图7攻击感染前后小鼠脾细胞培养上清IL-4水平
Fig.7IL-4levelsofspleencellculturesupernatantofmicebeforeandafterattackinfection
2.7抗体水平的检测 DNA疫苗组在第1次免疫后7 d可从血清中检测出抗体,之后持续升高,第14 d达高峰,IgG抗体滴度为1∶1 280;而生理盐水组和pcDNA3.1组抗体滴度无显著变化。尾蚴攻击感染后与攻击感染前比较,抗体水平在DNA疫苗组稍有下降,但无显著性变化,而在pcDNA3.1组和生理盐组则显著性增加,P<0.05(图8)。
2.8动物保护性实验
2.8.1肝脏虫卵计数及小鼠荷成虫对数 统计学分析结果显示:pcDNA3.1(+)/Sjcb2核酸疫苗组分别与pcDNA3.1(+)组和生理盐水组比较,肝脏虫卵数及小鼠荷成虫对数均有显著性减少,P<0.05,而pcDNA3.1(+)组与生理盐水组之间无显著性差异,P>0.05(表1)。
2.8.2计算减虫率和减卵率
减虫率(%)=(生理盐水组荷虫数-疫苗组荷虫数)/ 生理盐水组荷虫数×100%=36.32%
减卵率(%)=(生理盐水组虫卵数-疫苗组虫卵数)/ 生理盐水组虫卵数×100%=60.61%
3 讨 论
血吸虫感染后保护性免疫机制复杂,目前尚无令人满意的血吸虫疫苗[8]。近年来,国内外血吸虫核酸疫苗研究较多,但核酸疫苗的作用机理及确切效果尚需进一步研究和证实[9-10]。
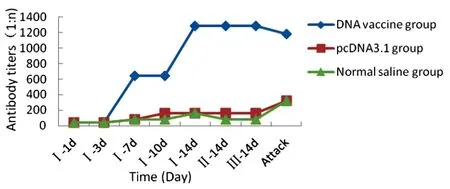
图8DNA疫苗免疫后小鼠抗体滴度变化
Fig.8AntibodytitersofmiceafterDNAvaccineimmunization
Ⅰ-1d: First day after the first immunization;
Ⅰ-3d: Third day after the first immunization;
Ⅰ-7d: Seventh day after the first immunization;
Ⅰ-10d: Tenth day after the first immunization;
Ⅰ-14d: Fourteenth day after the first immunization;
Ⅱ-14d: Fourteenth day after the second immunization;
Ⅲ-14d: Fourteenth day after the third immunization;
Attack-10d: Tenth day after cercariae attack.

表1 pcDNA3.1(+)/Sjcb2核酸疫苗免疫后小鼠荷成虫对数及肝脏虫卵数
本实验将Sjcb2作为日本血吸虫疫苗候选分子,构建核酸疫苗免疫小鼠,经PCR和免疫组化法验证pcDNA3.1(+)/Sjcb2重组质粒能在小鼠股四头肌细胞内稳定存在及高效表达,说明该核酸疫苗在动物体内具有一定稳定性和良好的表达状态,这些特性是产生保护性免疫作用的基础。抗体检测显示DNA疫苗组在免疫后一周出现抗体,第2周达高峰,Sjcb2抗体滴度可达1∶1 280,提示该核酸疫苗能够诱导小鼠产生高水平抗体及具有一定的体液免疫作用,尾蚴攻击感染后10 dSjcb2抗体滴度稍有下降,但无显著性差异,可能是其抗体与虫体产生的Sjcb2特异性结合,发挥抗虫作用,故抗体水平有所下降。但由于血吸虫感染第10 d时虫体发育尚未成熟,分泌的Sjcb2抗原有限,抗体水平下降不明显。此结果说明特异性Sjcb2抗体在抗血吸虫感染时并非在早期发挥作用,可能主要在虫体成熟及产卵时发挥作用。MTT法检测脾淋巴细胞增殖,结果显示DNA疫苗组脾淋巴细胞增殖显著,说明核酸疫苗能诱导T细胞增殖和活化,提示Sjcb2不仅能诱导体液免疫,而且可诱导细胞免疫,可能通过体液免疫和细胞免疫发挥抗感染作用。
细胞因子检测结果显示:小鼠接种Sjcb2 DNA疫苗后,IFN-γ水平显著升高,而pcDNA3.1空质粒和生理盐水则不能诱导小鼠产生IFN-γ,血吸虫尾蚴攻击感染后,也未能有效诱导小鼠分泌IFN-γ。IFN-γ主要由Th1细胞分泌,且能促进Th1型细胞免疫应答[11]。实验结果说明Sjcb2 DNA疫苗比血吸虫尾蚴感染更能有效刺激小鼠产生IFN-γ,诱导Th1型细胞保护性免疫应答。小鼠接种Sjcb2 核酸疫苗、pcDNA3.1空质粒和生理盐水后,IL-4水平与接种前比无显著差异,但血吸虫尾蚴攻击感染后,能显著性诱导各组产生高水平IL-4,其中Sjcb2核酸疫苗IL-4水平低于其它两组。说明Sjcb2 核酸疫苗不能诱导小鼠产生IL-4,但血吸虫感染可诱导小鼠分泌IL-4。IL-4主要由Th2细胞分泌,能促进Th2型细胞应答产生免疫病理反应,同时也是IgE转化因子,可促进嗜酸性粒细胞活化,发挥抗虫作用[12]。
在血吸虫感染中,T细胞应答发挥着重要作用,在小鼠Th1型细胞应答可产生有效的保护性免疫,而Th2型细胞应答则主要产生免疫病理作用,Th1/Th2细胞间失衡可导致肝脏免疫病理损伤。Th1和Th2细胞之间可通过其分泌的细胞因子相互作用,Th1型细胞可通过分泌IFN-γ抑制Th2型细胞增殖与活化,Th2型细胞通过分泌IL-4抑制Th1型细胞增殖与活化[13]。根据实验结果我们推测:Sjcb2 DNA疫苗经肌肉注射小鼠后,表达的Sjcb2分子经抗原提呈细胞处理后,能激活T细胞,诱导其产生细胞因子IFN-γ,而IFN-γ又能促进Th1细胞分化与增殖,从而发挥保护性免疫作用。血吸虫感染后,主要诱导IL-4水平升高,从而促进Th2型细胞增殖和分化,参与日本血吸虫肝肠虫卵肉芽肿形成和免疫病理损伤。
小鼠所荷成虫对数和肝脏荷虫卵数结果显示:Sjcb2 DNA疫苗组与其它两组比较,小鼠所荷成虫对数显著性减少,P<0.05;小鼠肝脏所荷虫卵数,Sjcb2 疫苗组显著性低于其它两组,P<0.05。Sjcb2 DNA疫苗组减虫率为36.32%,减卵率为60.61%,说明Sjcb2能诱导BALB/c小鼠产生一定的免疫保护性作用。
综上所述,Sjcb2在小鼠体内能诱导相应的体液免疫和细胞免疫,可作为抗日本血吸虫核酸疫苗的候选分子,能诱导以Th1型细胞为主的保护性免疫应答,减轻血吸虫感染所致的免疫病理反应和病理损伤。但由于核酸疫苗的免疫保护效果受多种因素的影响,该核酸疫苗诱导小鼠的免疫保护作用未能产生理想的预防效果。因此,采用Sjcb2与血吸虫疫苗的其它候选分子联合免疫,进一步使疫苗的保护性作用达到最佳水平,将是我们后续实验的重点。
参考文献:
[1]Ye Q, Dong HF, Grevelding CG, et al.Invitrocultivation ofSchistosomajaponicum-parasitesand cells[J]. Biotechnol Adv, 2013, 31(8): 1722-1737. DOI: 10.1016/j.biotechadv.2013.09.003
[2]Liu B, Cui X, Luo X, et al. DNA prime followed by protein boost enhances the protective efficacy againstSchistosomajaponicuminfection in mice[J]. Chin J Biotechnol, 2013, 29 (6): 814-822.
[3]Liu Y, Xiao JH, Liang L, et al. Amplification and sequencing of the gene coding for Mucin-like protein fromSchistosomajaponicum[J]. Chin J Parasitol Parasit Dis, 2004, 2(3): 167-169.(in Chinese) .
刘彦, 肖建华, 廖力,等. 日本血吸虫粘蛋白样蛋白部分基因的扩增及测序[J].中国寄生虫学与寄生虫病杂志,2004, 22 (3): 167-169.
[4]Cao Y, Shi Y, Qiao H, et al. Distribution of lethal giant larvae (Lgl) protein in the tegument and negative impact of siRNA-based gene silencing on worm surface structure and egg hatching inSchistosomajaponicum[J]. Parasitol Res, 2014, 113(1): 1-9. DOI: 10.1007/s00436-013-3620-z
[5]Tang XL,Wang LW, Yao Y, et al. Immuuoprotectin ofSjp14 DAN vaccine againstSchistosomajaponicuminfection mice[J]. Chin J Zoonoses, 2012, 28(6): 592-596. DOI: 10:3969/cjz.j.issn.1002-2694.2012.06.016 (in Chinese)
唐小牛, 汪礼文,姚勇, 等. 日本血吸虫调宁蛋白样蛋白P14基因疫苗对小鼠免疫保护作用研究[J]. 中国人兽共患病学报,2012, 28(6): 592-596.
[6]Hu YX, Xiao JH, Zeng Q, et al. Acquisition and structural and functional analysis of cathepsin B endo-peptidase gene ofSchistosomajaponicum[J]. Chin J Zoonoses, 2004, 20(9): 790-793. DOI: 10.3969/j.issn.1002-2694.2004.09.016 (in Chinese)
胡永轩, 肖建华, 曾桥, 等. 日本血吸虫组织蛋白酶B肽链内切酶基因的获得及结构与功能分析[J]. 中国人兽共患病杂志,2004 , 20(9): 790-793. DOI: 10.3969/j.issn.1002-2694.2004.09.016
[7]Hu YX, Xiao JH, Huang JF, et al. Construction ofSjcb2 DNA vaccine and its expression in eukaryotic cells[J]. China Trop Med, 2006, 6(7): 1122-1124. DOI: 10.3969/j.issn.1009-9727.2006.07.002
[8]Cao Y, Zhao B, Han Y, et al. Gene gun bombardment with DNA-coated golden particles enhanced the protective effect of a DNA vaccine based on thioredoxin glutathione reductase ofSchistosomajaponicum[J].Biomed Res Int, 2013, 2013: 952416. DOI: 10.1155/2013/952416
[9]Denis-Mize KS, Dupuis M, Singh M, et al. Mechanisms of increased immunogenicity for DNA-based vaccines adsorbed onto cationic microparticles[J]. Cell Immunol, 2003, 225(1): 12-20.
[10]Hu YX, Xiao JH, Yang QL, et al. Construction ofSjcb2 DNA vaccine and its expression in HeLa cells[J]. Chin J Parasitol Parasit Dis, 2006, 24(5): 385-386.
[11]Stavitsky AB. Regulation of granulomatous inflammation in experimental models of schistosomiasis[J]. Infect Immun, 2004, 72(1): 1-12. DOI: 10.1128/IAI.72.1.1-12.2004
[12]Seki T, Kumagai T, Kwansa-Bentum B, et al. Interleukin-4 (IL-4) and IL-13 suppress excessive neutrophil infiltration and hepatocyte damage during acute murineSchistosomiasisjaponica[J]. Infect Immun, 2012, 80(1): 159-168. DOI: 10.1128/IAI.05581-11
[13]Yi XY, Zeng XZ, Zeng XF, et al. Studies on anti-fecundity induced by cathepsin B DNA vaccine ofSchistosomajaponicum[J]. Chin J Zoonoses, 2000, 16(1): 45-47. (in Chinese)
