高强度聚焦超声治疗子宫肌瘤的有效性和影像学特征分析
2014-04-01华媛媛周敏胡建国熊正爱曾飚
华媛媛,周敏,胡建国,熊正爱,曾飚
高强度聚焦超声(high-intensity focused ultrasound,HIFU)作为一种无创治疗方法,在子宫肌瘤的治疗中逐步得到重视[1]。HIFU利用超声波的生物学效应,将体外发射的超声波聚焦于体内病变组织,使靶区内组织温度骤升,出现凝固性坏死,从而靶向破坏病变,而对邻近的正常组织影响较小[2]。HIFU相关的临床资料积累较少,治疗效果尚待进一步观察,本研究探讨了HIFU在子宫肌瘤治疗中的临床效果和影像学特征。
1 资料与方法
1.1 临床资料 纳入2010年1月-2012年12月重庆医科大学附属第二医院经病史、症状、体征、超声、MRI等诊断为子宫肌瘤的患者47例。所有患者均签署知情同意书。入选标准:年龄大于18周岁;无再生育要求;有强烈保留子宫的愿望;入院诊断(主要诊断)为子宫肌瘤或多发性子宫肌瘤(包括浆膜下肌瘤、肌壁间肌瘤);合并由子宫肌瘤导致的相应临床症状,如异常子宫出血、贫血、尿频尿急、便秘、腹痛、流产等;无实施镇静镇痛的禁忌证;同意超声消融治疗。排除标准:有下腹部瘢痕,导致明显声衰减;有放疗病史,累积剂量大于45Gy;怀疑有盆腔内组织器官粘连;宫颈肌瘤、黏膜下子宫肌瘤、带蒂的浆膜下子宫肌瘤;俯卧位时,子宫肌瘤或增大的子宫仍压迫直肠者;有未被控制的其他妇科疾病或全身疾病;治疗前3个月曾接受过其他局部治疗。
1.2 HIFU治疗 采用重庆海扶技术有限公司生产的JC型聚焦超声肿瘤治疗系统,治疗超声换能器中心组合有超声显像探头。麻醉(2010-2011年为全麻,2012年为镇静镇痛麻醉)下,在非月经期进行单次治疗。
1.3 随访指标
1.3.1 UFS-QOL调查[3]对出现子宫肌瘤相关症状的患者,在治疗前及治疗后1、3、6、12个月采用子宫肌瘤症状及健康相关生活质量的调查问卷(UFS-QOL)各进行1次评分。
1.3.2 影像学评估 在治疗前及治疗后1、3、6、12个月,对每例患者分别采用MRI和彩色多普勒超声进行评价。
计算肌瘤体积及体积缩小率:在MRI影像中,采用HIFU-3DTPS测量软件在轴位及矢状位上选定的层面勾画出所测组织的轮廓,以计算机三维测量软件自动累加所有的选定层面得出所测组织的体积。在彩色多普勒超声影像中,测量子宫肌瘤径线,按椭球形体积公式计算肌瘤体积:体积(ml)=πabc/6(a、b、c代表病灶的3条最大径线值)。体积缩小率=(治疗前体积-每次检查所测体积)/治疗前体积×100%。
彩色多普勒血流显像(CDFI)结果按Adler的半定量方法[4]进行评价。依据病灶内血流信号多少分0-Ⅲ级:0级,病灶内未见血流信号;Ⅰ级,少量血流,可见1~2处点状血流,管径<1mm;Ⅱ级,中量血流,可见一条主要血管,其长度超过病灶的半径或见几条小血管;Ⅲ级,丰富血流,可见4条以上血管或血管相互连通交织成网状。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析。症状和UFS-QOL评分结果以x±s描述,组间比较采用方差分析;以中位数表示体积变化的集中趋势;彩超与MRI所测治疗后肌瘤体积变化率的比较采用非参数两样本配对检验;四格表数据比较采用Fisher精确概率法。P<0.05为差异有统计学意义。
2 结 果
共47例患者入选并完成12个月的随访,年龄30~50岁,平均38.3岁。其中38例有子宫肌瘤相关症状。HIFU治疗均按计划顺利完成,共对47例患者53个肌瘤进行了治疗,治疗时间最长115.3min,最短24.5min,平均为62.4min。
2.1 HIFU治疗前后症状评分和UFS-QOL评分变化
38例症状性子宫肌瘤患者治疗前及治疗后1、3、6、12个月症状评分及UFS-QOL评分差异均有统计学意义(P<0.05,表1)。38例症状性子宫肌瘤患者中34例治疗后症状及生活质量得到改善。8例术前出现尿频、6例术前出现便秘者在术后3个月症状消失;20例术前经量增多、经期延长者在肌瘤缩小后月经异常的症状逐渐改善,其中1例术前伴发贫血者(血红蛋白59g/L)于术后6个月恢复正常。症状无明显缓解者中2例肌瘤无缩小,分别于随访前1~3个月行子宫肌瘤剔除术或子宫切除术。
表1 HIFU治疗前后症状评分和UFS-QOL评分(±s,n=10)Tab.1 Symptoms and UFS-QOL scores before and after HIFU treatment (±s, n=10)

表1 HIFU治疗前后症状评分和UFS-QOL评分(±s,n=10)Tab.1 Symptoms and UFS-QOL scores before and after HIFU treatment (±s, n=10)
(1)P<0.05 compared with before treatment; (2)P<0.05 compared with one month after treatment; (3)P<0.05 compared with three months after treatment
Time Scores of symptomsScores of UFS-QOL Before treatment 22.43±10.37 80.26±16.28 One month aft er treatment 14.23±7.28(1) 87.28±7.26(1)Three months aft er treatment 10.26±6.38(1)(2) 92.25±5.467(1)(2)Six months aft er treatment 7.32±5.23(1)(2)(3) 95.34±3.47(1)(2)(3)Twelve months aft er treatment 5.49±3.13(1)(2)(3) 97.22±3.23(1)(2)(3)
2.2 HIFU治疗前后肌瘤体积的影像学评估 共对53个肌瘤进行了治疗,术前通过计算机软件在MRI图像上测得子宫肌瘤体积为13.6~211.4mm3,中位体积70.5mm3;通过彩超测径线后用公式计算所得体积为11.2~163.5mm3,中位体积为40.3mm3。MRI所测体积大于B超的95%可信区间为70%~97%,B超所测体积大于MRI的95%可信区间为2%~29%,表明两种方法测量体积有差别,B超所测体积要比MRI小。
MRI随访肌瘤体积变化,术后1、3、6、12个月体积缩小率中位数分别为23.0%,38.3%,58.2%,61.3%。彩超随访肌瘤体积变化,术后1、3、6、12个月体积缩小率中位数分别为32.7%、38.1%、53.3%、56.7%。治疗后1、3、6、12个月4个时间点,上述两种测量方法检测肌瘤体积变化率的结果一致,差异无统计学意义(P>0.05)。5例术后6个月复查肌瘤明显缩小,12个月复查时肌瘤较前增大。
2.3 HIFU治疗后肌瘤体积变化与治疗前肌瘤MRI强化程度、彩超CDFI的关系 HIFU治疗前将肌瘤MRI增强扫描后分为等低信号(弱于或相当于子宫肌壁)和高信号(强于子宫肌壁),将彩超CDFI值分为0-Ⅰ级(少量血流及以下)和Ⅱ-Ⅲ级(中量及以上血流),将HIFU治疗后肌瘤体积缩小率分为>20%和≤20%,结果显示治疗前肌瘤MRI增强扫描强化信号越低,治疗后肌瘤体积缩小越显著,彩超所见瘤体内血流信号越少,治疗后肌瘤体积缩小越显著(P<0.05,表2)。

表2 HIFU治疗后肌瘤体积变化与治疗前肌瘤MRI强化程度、彩超CDFI的关系Tab.2 Relationship between the fibroid size after HIFU treatment and the signal on MRI and CDFI before treatment
2.4 HIFU治疗后无灌注区与术前肌瘤MRI强化程度、治疗中B超灰度变化的关系 53个肌瘤治疗后1个月随访MRI,45个(84.9%)肌瘤体积缩小,其中39个肌瘤内出现无灌注区;8个未缩小的肌瘤中均未出现无灌注区。无灌注区全部在瘤体内,无越过包膜到达正常子宫肌组织的情况。随访过程中,未见凝固性坏死区内有液化坏死灶形成,无灌注区体积随随访时间的延长而逐渐缩小(图1)。治疗前肌瘤MRI增强扫描信号越低,治疗后肌瘤内越容易出现无灌注区(P<0.05);治疗中实时超声监测到有灰度变化,治疗后肌瘤内也易出现无灌注区(P<0.05,表3)。
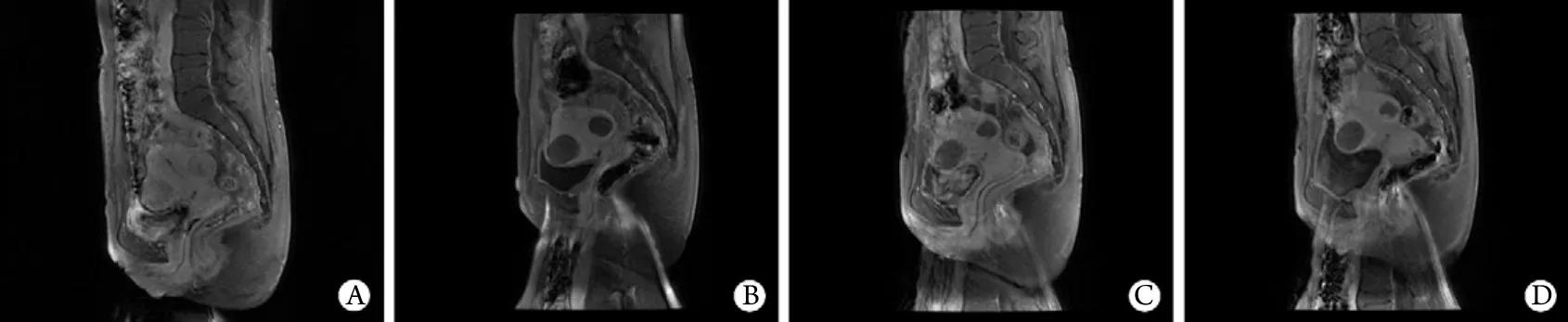
图1 不同时间点的肌瘤MRI图像Fig.1 MRI image of fibroids at different time pointA. Before treatment; B. One month after treatment, the edge of non-perfusion area was clear and the size of fibroid decreased; C. Three months after treatment, the edge of non-perfusion area was more cloudily and the fibroid decreased continuously; D. Six months after treatment, the edge of non-perfusion area was more cloudily and the size of fibroid continued to decrease

表3 HIFU治疗后无灌注区与术前肌瘤MRI强化程度、治疗中B超灰度变化的关系Tab.3 Relationship between non-perfusion area after treatment and the signal on MRI and intensity change on B ultrasound
3 讨 论
目前国内外研究均显示HIFU治疗能有效减小肌瘤体积,改善症状和生活质量[5-7]。本研究中HIFU治疗后症状评分和UFS-QOL评分与治疗前比较差异均有统计学意义,肌瘤体积缩小发生率为84.9%,该结果同样表明HIFU治疗能明显改善子宫肌瘤相关症状、提高患者生活质量。
子宫肌瘤的MRI影像学特征为:T1WI上多为等低信号,但与周围组织界限不十分清楚,T2WI上包膜与周围子宫肌组织界限清楚,肌瘤呈均匀低信号、均匀高信号、低信号病灶内夹杂斑片状高信号等不同表现形式。通过增强扫描还可以显示组织的血供情况。MRI不仅能很好地显示肌瘤的实际大小和位置,还能有效地鉴别子宫肌瘤与子宫腺肌症、实质性附件肿块,是目前对子宫肌瘤进行诊断及定位最准确的影像技术[8]。
利用MRI图像能准确计算对象的体积,本研究选择MRI测量结果作为瘤体体积变化的标准,术后1、3、6、12个月肌瘤体积缩小率中位数分别为23.0%、38.3%、58.2%、61.3%。Ren等[9]报道HIFU治疗后随访第1、3、6、12个月子宫肌瘤体积分别缩小为21.2%、29.6%、44.8%、48.7%,与本研究结果基本一致。比较MRI和彩超对同一子宫肌瘤的测量结果发现,彩超测得的体积要小于MRI,分析其原因,MRI采用的是逐层勾画组织轮廓,软件自动累加得出体积,近似于实体组织,而彩超计算体积的方法是假定肌瘤为标准的椭球体,与实际组织差距更大。虽然本研究中MRI与彩超两种方法对肌瘤缩小率的判定无统计学差异,但在临床上超声检查更为便捷、经济,使用超声随访治疗效果更具有经济学上的意义。
目前认为MRI是评价组织凝固性坏死与否的最佳影像学方法,HIFU治疗后MRI增强扫描无灌注区与组织病理学上的凝固性坏死呈对应关系[10]。Venkatesan等[11]在子宫肌瘤经HIFU辐照后的MRI图像和组织学对比观察中发现,治疗区组织发生了凝固性坏死,坏死区和周围正常组织之间分界清楚,MRI测得的损伤区大小与实际测得值较吻合。熊正爱等[12]动态观察经HIFU辐照的活体猴子宫发现:局部呈现凝固性细胞坏死,中央未发生液化,在周围正常组织释放的酶的作用下,坏死区从边缘开始向心性地缓慢分解液化,逐渐吸收并由少量纤维组织代替,这些改变在MRI图像中都能很好地显示。本研究53个肌瘤中有45个体积缩小,其中39个出现无灌注区,另8个未缩小的肌瘤中未出现无灌注区。即凡术后瘤体内出现无灌注区,都伴随有肌瘤体积缩小,但瘤体有缩小的,却不一定有无灌注区出现。这可能是因为治疗时虽然未达到典型的凝固性坏死程度,但也对肌瘤组织造成了一定程度的热损伤,肌瘤逐渐发生退变吸收,该现象的具体原因还不十分确定,有待进一步探讨。HIFU治疗后瘤体内无灌注区的体积随随访时间的延长而逐渐缩小,进一步证明凝固性坏死组织是可以吸收的。无灌注区组织没有越过包膜到达正常肌组织的情况;随访过程中,未见凝固性坏死区内有液化坏死灶形成。
本研究发现,术前肌瘤增强扫描信号越弱,治疗后越容易出现无灌注区,且肌瘤体积的缩小越明显。因为MRI增强后信号强弱主要反映血供和组织学类型,故认为HIFU治疗子宫肌瘤的疗效可能与肌瘤内血流信号及组织类型有关。研究发现有血管时HIFU聚焦区域内血管直径大小对血管周围组织的升温影响很大,随着血管直径增加,周边组织60℃以上治疗区域在减小[13]。HIFU对血管的作用受到血管管径、血流速度和超声特性的影响,直径<0.2mm的肿瘤微血管立即被破坏,但血流丰富的病灶,可将热量迅速带走,不能将血管闭塞,影响治疗效果。血流越丰富,组织内平滑肌细胞含量越多,越不容易造成凝固性坏死,影响疗效。
通过HIFU治疗实时超声监测灰度的变化,可以间接判断治疗剂量及效果。在本研究45个治疗后体积缩小的子宫肌瘤中,有39个在治疗中B超监测出现灰度变化。HIFU辐照后超声灰度增加的主要原因有:热效应使靶区瞬态达到高温产生气泡、空化效应产生大量微气泡,使声阻抗增加,这是辐照即刻出现回声增强的主要原因;随着时间延长,气泡迅速消退,靶区组织发生凝固性坏死及组织结构改变,形成新的界面,声像图显示的回声增强。但是灰度变化与凝固性坏死也不完全对应,本研究中5例有灰度变化,但MRI增强扫描后未出现无灌注区,2例无灰度变化,却在MRI增强扫描后出现了无灌注区。分析原因可能是实时超声成像对疗效的判断标准(靶区灰度变化)受到多种因素的影响,治疗时皮肤及皮下组织水肿可导致靶区组织的灰度变化减弱。有研究发现出现灰度增强的坏死组织光镜下可见胞质内大量致密空泡,而灰度变化不明显的凝固性坏死组织光镜下可见细胞固缩、核溶解,空泡罕见[14]。所以在治疗时不能单纯以超声灰度变化作为凝固性坏死的唯一指标,对没有出现灰度变化的病例可参考肌瘤体积给予相应治疗剂量,或通过超声造影帮助判断,避免治疗剂量过大而增加不良反应的风险。
本研究结果初步显示,镇静、镇痛下HIFU治疗子宫肌瘤是有效的,并明确了治疗后肌瘤局部的MRI、彩超等影像学变化。HIFU可作为子宫肌瘤的一种无创治疗方式。
[1] Yang WW, Gai LH, Li J, et al. Evaluation of the effect of ablating uterine leiomyoma with high intensity focused ultrasound in patients by MRI[J]. Med J Chin PLA, 2009, 34(5): 616-618.[杨武威, 盖绿华, 李静, 等. 高强度聚焦超声消融子宫肌瘤的MRI评价[J]. 解放军医学杂志, 2009, 34(5): 616-618.]
[2] de Melo FC, Diacoyannis L, Moll A, et al. Reduction by 98%in uterine myoma volume associated with significant symptom relief after peripheral treatment with magnetic resonance imaging-guided focused ultrasound surgery[J]. J Minim Invasive Gynecol, 2009, 16(4): 501-503.
[3] Spies JB, Coyne K, Guaou Guaou N, et al. The UFS-QOL, a new disease-specific symptom and health-related quality of life questionnaire for leiomyomata[J]. Obstet Gynecol, 2002, 99(2):290-300.
[4] Sedelaar JP, Aarnink RG, van Leenders GJ, et al. The application of three-dimensional contrast-enhanced ultrasound to measure volume of affected tissue after HIFU treatment for localized prostate cancer[J]. Eur Urol, 2000, 37(5): 559-568.
[5] Fan R, Zhu L, Gong XM, et al. Prospective study on magnetic resonance-guided focused ultrasound surgery for symptomatic uterine fibroid: short-term follow up[J]. Chin J Obstet Gynecol,2013, 48(3):183-187. [范融, 朱兰, 龚晓明, 等. MRI引导的聚焦超声术治疗症状性子宫肌瘤的前瞻性研究[J]. 中华妇产科杂志, 2013, 48(3): 183-187.]
[6] Zhang L, Chen WZ, Liu YJ, et al. Feasibility of magnetic resonance imaging-guided high intensity focused ultrasound therapy for ablating uterine fibroids in patients with bowel lies anterior to uterus[J]. Eur J Radiol, 2010, 73(2): 396-403.
[7] Hesley GK, Gorny KR, Woodrum DA. MR-guided focused ultrasound for the treatment of uterine fibroids[J]. Cardiovasc Intervent Radio, 2013, 36(1): 5-13.
[8] Morita Y, Ito N, Hikida H, et al. Non-invasive magnetic resonance imaging-guided focused ultrasound treatment for uterine fibroids - early experience[J]. Eur J Obstet Gynecol Reprod Biol, 2008, 139(2): 199-203.
[9] Ren XL, Zhou XD, Zhang J, et al. Extracorporeal ablation of uterine fibroids with high-intensity focused ultrasound: imaging and histopathlogic evaluation[J]. J Ultrasound Med, 2007,26(2): 201-212.
[10] Trumm CG, Stahl R, Peller M, et al. MRI for monitoring of high intensity focused ultrasound: current developments[J].Radiologe, 2013, 53(11):1001-1008.
[11] Venkatesan AM, Partanen A, Pulanic TK, et al. Magnetic resonance imaging-guided volumetric ablation of symptomatic leiomyomata: correlation of imaging with histology[J]. J Vasc Interv Radiol, 2012, 23(6):786-794.
[12] Xiong ZA, Du YH, Gong XB, et al. The eあ ect of MRI in the follow up after HIFU[J]. J Chonqing Medical University, 2005, 30(3):452-455. [熊正爱, 杜永洪, 龚晓波, 等. MRI在HIFU治疗后随访中的作用[J]. 重庆医科大学学报, 2005, 30(3): 452-455.]
[13] Yin JG, Wen YC, Jian XQ. Influence of hemokinesis on temperature field during high intensity focused ultrasound therapy[J]. J Clin Rehabil Tissue Eng Res, 2008, 12(48): 9493-9496. [尹军刚, 温雨春, 菅喜岐. 血流对高强度聚焦超声治疗时温度场影响的仿真实验[J]. 中国组织工程研究与临床康复, 2008, 12(48): 9493-9496.]
[14] Zou JZ, Gong XB, He XM, et al. Gray value invariance and necrosis formation in target tissue receiving HIFU irradiation[J].J Ultrasound Clin Med, 2008, 10(9): 581-583. [邹建中, 龚晓波, 贺雪梅, 等. 高强度聚焦超声辐照离体组织靶区无灰度变化有坏死现象的研究[J]. 临床超声医学杂志, 2008, 10(9):581-583.]
