胰十二指肠切除术置放胰管引流合理性的流体动力学模拟研究
2014-04-01姜凯陈照军陈永卫刘江赵向前苏明刘洋张文智董家鸿黄志强
姜凯,陈照军,陈永卫,刘江,赵向前,苏明,刘洋,张文智,董家鸿,黄志强
胰十二指肠切除术(pancreaticoduodenectomy,PDD)是壶腹部癌根治性切除治疗的经典方法。虽然胰肠吻合的方式与技术在不断改进,但胰漏发生率仍然高达5%~33%[1-4]。胰肠吻合中对主胰管与空肠黏膜进行连续完整吻合是减少PDD术后早期胰漏发生的重要手段[2,5-6],但对于直径较小的胰管,这种吻合却难以达到预期目的。为保持胰管与空肠内引流的连续性,放置硅胶内支撑管引流管是目前常用的方法[7]。一种方法是将胰管引流管直接放置于空肠襻内的胆肠吻合口远侧端,另一种是将它经空肠襻近端穿出引流至体外,以防止胰液与胆汁或肠液混合。采用上述方法,若胰液引流畅通无阻力,理论上应可降低早期胰漏的发生率,但事实并非如此[7-9]。胰液具有一定的黏稠度,在内径较小的硅胶管内的流体动力状态如何以及可能的影响因素目前尚未见文献报道。本研究利用经典伯努利(Bernoulli's equation)管内流体流动机械能衡算式,对胰液在胰管内的流动进行推导计算,探讨胰管引流过程中的影响因素,对PDD术中置放胰管引流的合理方法及安全性、可行性进行评价。
1 材料与方法
利用合理的简化模型,假设胰液在引流管内为连续流动,设胰腺界面为1-1截面,引流袋为2-2截面,按1-1与2-2截面之间实际的流体机械能数据列柏努利衡算方程。因胰液具有一定黏度,在流动时存在的流体内摩擦会使一部分机械能转化为热能,从而引起总机械能的损失,因此衡算时加入压头损失项(∑Hf),两个截面间列柏努利衡算方程得方程式(1)。

g取常数9.81;Δz. 液位差;ΔP. 头端间压力差;l. 引流管长度;μ. 流体黏度;u. 流体流度;d.引流管内径;ρ. 流体密度。
考察引流管内径、长度、液位差和胰液黏度对ΔP的影响,并通过模拟实验验证引流管内径与长度两因素的作用。目前所采用的引流原理是被动重力引流,需要一定的压力梯度以保证引流稳定有序,因此引流袋应低于胰腺部位以下一定距离。然而,由于腹壁戳口体外选位点均高于胰腺,因此,计算需要添加外加压头来补偿,压头来源于两个方面,一方面胰管内压力本身可以提供一定的压头(平均16~18mmHg),另一方面引流液出口端可以外加一负压装置来提供必要的压头克服损失。
依据临床经验和参数作以下设定,将所设定的参数依次代入公式(2)进行计算,求得系列ΔP值。推断实际应用中所需的条件分析所获数据,流体流速按2l/d计算,密度设定为1000kg/m3,集中考察决定ΔP的其他4个因素:①引流管管长依次取0.6、0.8、1.0、1.2、1.4、1.6、1.8m;②引流管内径依次取0.008、0.016、0.024、0.032m;③胰液黏度依次为0.000656、0.001、0.005、0.01、0.015、0.02Pa.s;④液位差依次为0.05、0.10、0.15m。
1.1 假设验证 如果胰腺比引流袋高0.1m,Δz=0.1m,g取9.81,胰腺内压力与引流袋的压力相等,ΔP=0,胰液分泌量为2l/d,

设定引流管长度l为1.5m,胰液黏度为体温下水的黏度,即μ=65.6×10–5Pa.s,胰液密度为水的密度,即1000kg/m3,根据公式(3),可求得引流管内径d=0.000986m,验证Re,

Re<2000,胰液流动为层流,假设成立。
1.2 材料与仪器 模拟胰液引流体系自制装置如图1,包括不同内径(0.008、0.016、0.024、0.032m)引流管,生理盐水500ml,黏度为5mPa.s的聚合物溶液500ml,U型压差计,滴液漏斗,50ml注射器,游标卡尺。
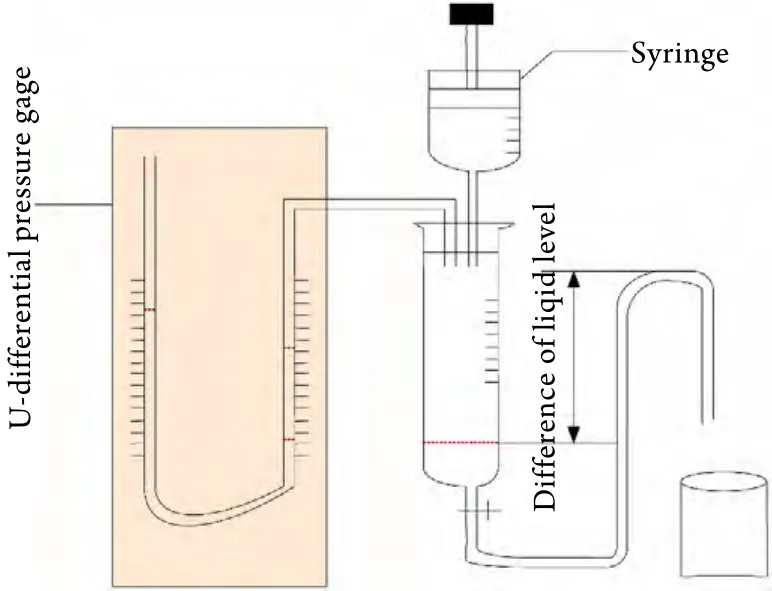
图1 胰腺引流体系模拟示意图Fig.1 Schematic diagram of simulative pancreatic drainage system
1.3 实验步骤 ①依据以上论述设计模拟引流体系装置,见图1。②室温25℃,将500ml生理盐水倒入滴液漏斗中,连接U型压差计,连接整个封闭系统,将滴液漏斗内加压至16mmHg。依次测试4种不同内径的引流管引流500ml生理盐水所需时间。③采用同样方法,测试引流500ml 5mPa.s的聚合物溶液所需时间。引流高度设定为50cm,引流管长度为1.8m,整个过程中其他变量均维持不变,始终保证整个系统的干净与通畅。④对②、③两组实验均采用重复测5次,取平均值,做好详细记录。
2 结 果
2.1 计算数据采集 观察引流管内径分别为0.008、0.016、0.024、0.032m,液位差依次为0.05、0.10、0.15m时,两因素各自对ΔP的影响,具体结果如图2A所示。观察引流管长度分别为0.6、0.8、1.0、1.2、1.4、1.6、1.8m,以及胰液黏度依次为0.000656、0.001、0.005、0.01、0.015、0.02Pa.s时,两因素各自对ΔP的影响,具体结果如图2B所示。
2.2 实验数据采集 分别采用4种不同内径和不同长度引流管引流500ml生理盐水(1mPa.s)与500ml聚合物溶液(5mPa.s),结果如图3所示。
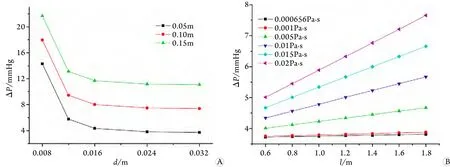
图2 引流管内径与液位差(A)以及引流管长度和胰液黏度(B)对ΔP的影响Fig.2 Impacts of diameter and liquid level difference (A), and tube's length and pancreatic juice's viscosity (B) on ΔP
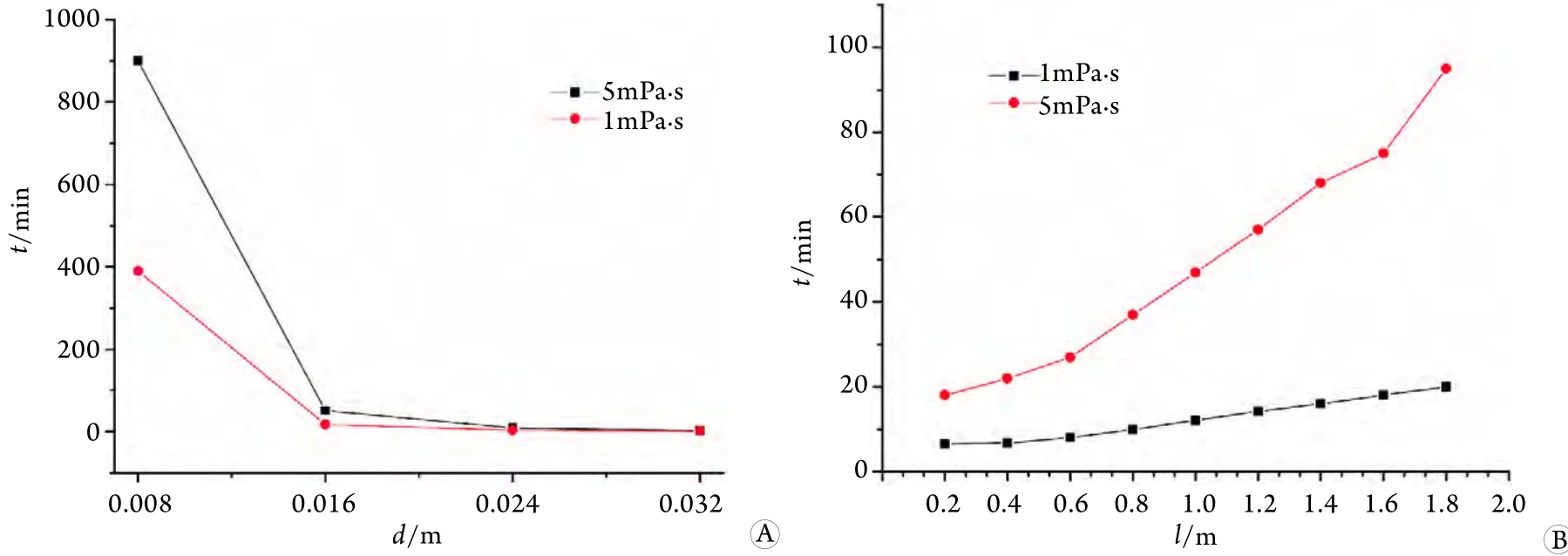
图3 不同内径(A)、不同长度(B)引流管引流生理盐水与聚合物溶液时间曲线图Fig.3 Diameter-draining time plot of tubes with different inner diameter (A) and length (B) draining 0.9% saline and polymer solution
3 讨 论
目前关于PDD术后胰管引流的体内外置放方式仍存在争议,主要依靠各自的临床经验,缺乏理论依据。文献报道主胰管直径为1.0~3.0mm,最大直径为2.0~3.0mm[4,10]。Park等[11]测量了不同黏度的液体通过不同型号引流管时的速率,管径型号6-18F(1F=0.33mm),结果发现引流速率随着管径的增加而提高,但当管径超过7F后,这种差距将逐渐变小。
目前临床上已有各种规格的引流管可供选择。根据临床实际情况恰当地选择引流管是保证引流顺利的一个关键因素。据报道大口径引流管比小口径引流管能提供更有效的引流,但是,Gobien等[12]发现引流管的型号与引流成功率之间的关联非常弱。Mueller等[13]的研究显示,就引流管留置时间而言,小号引流管比大号引流管更具优势,并且让患者更舒适。Gobien等[12]的临床研究也证实了此观点,他们通过对临床资料的回顾性分析发现,当引流管内径较小时(5-6F),容易发生反复堵管而不得不进行重新置管,而当引流管内径增加到8F以上时,患者的引流时间与引流成功率之间无明显差异,而且引流管内径越大,对患者的创伤越大,不舒适程度也越重。
从本研究可以看出,ΔP随着液位差的增加而增加,且随液位差变化的幅度较大。在实际临床应用中,液位差不同主要是由体位及个体差异造成的。当液位差超过0.1m时,ΔP已超过胰腺可以承受的压力,可显著增加胰漏的风险;而且,内径对ΔP值也有显著影响,总趋势是随着内径的增加ΔP降低,在0.016m以内时下降趋势较大,之后趋于平稳,也即当引流管内径较小时对ΔP值影响较大,0.012m以下时尤其显著,发生胰漏的可能性增加。
关于引流管长度和胰液黏度这两个因素对ΔP的影响,本研究结果显示,随着引流管长度增加,ΔP值基本无明显变化,只有在液体黏度较高时,其增加幅度才较为明显。因此,实际临床应用中引流管长度以1.4~1.6m为宜。由图2亦可看出,随黏度的增加ΔP值呈增加趋势,然而,根据人体胰液的实际黏度范围参考值,可知胰液黏度与ΔP实际无显著相关性。
本研究通过实验验证了引流管内径和长度这两个因素的影响。其中由图2A可以看出,引流管内径与ΔP的相关性较大,当其值在0.16m以上时效果较为理想,与计算结果具有较好的一致性;而图2B则证实在实际参数参考值范围内,引流管长度与ΔP无明显相关性。
通过对于影响ΔP值的4个因素的考察及相应实验验证,本研究获得了较为可靠的数据,在所设定的参数范围内,同时兼顾实际临床需要,保证ΔP低于胰腺所能承受的平均压力,推断出4个因素的适宜范围。首先对于具有较大相关性的两个因素,即引流管内径和液位差分别选择0.002m和0.1m为佳,而无明显相关性的引流管长度,兼顾实际临床需要选取1.6m为宜。
上述实验所做的假设,前提为引流管内胰液具有连续性。但在临床实际中,往往会出现较大个体差异,上述结论在刚放置引流管后具有较大的参考价值,对于连续、正常的引流,只要保持1-1截面低于2-2截面并具有一定的液位差,即可保证其畅通。为尽量避免人为造成的引流管阻断,以及不当处置引起的胰液引流受阻等问题,采用体内肠引流不失为一种理想可靠的方式。引流管内径0.002m以上,液位差小于0.1m时,可以较大程度保证引流的畅通,引流管长度以1.6m为宜。因体外引流模式所面临的实际问题,肠内引流可能是理想选择。
[1] Yeo CJ, Cameron JL, Sohn TA, et al. Six hundred fi ft y consecutive pancreaticoduodenectomy in the 1980s: pathology, complications,and outcomes[J]. Ann Surg, 1997, 226(3): 248-257.
[2] Bartoli FG, Arnone GB, Ravera G, et al. Pancreatic fistula and relative mortality in malignant disease after pancreaticoduodenectomy. Review and statistical meta-analysis regarding 15 years of literature[J]. Anticancer Res, 1991, 11(5):1831-1848.
[3] Yeo CJ, Cameron JL, Maher MM, et al. A prospective randomized trial of pancreaticogastrostomy and pancreaticojejunostomy after pancreaticoduodenectomy[J]. Ann Surg, 1995, 222(4): 580-588.
[4] Ohwada S, Tnahashi Y, Ogawa T, et al. In situ vs ex situ pancreatic duct stents of duct-to-mucosa pancreaticojejunostomy after pancreaticoduodenectomy with billroth I-type reconstrction[J].Arch Surg, 2002, 137(11): 1289-1293.
[5] Jiang K, Zhang W, Feng Y, et al. Enclosed Passive Infraversion Lavage-Drainage System (EPILDS): A novel safe technique for local management of early stage bile leakage and pancreatic fistula post pancreatoduodenectomy[J]. Cell Biochem Biophys,2013, [Epub ahead of print].
[6] Hou ZY, Zhang J, Zhang HT, et al. Application of pancreaticojejunostomy in pancreaticoduodenectomy[J]. J Logist Univ CAPF(Med Sci), 2013, 22(1): 19-21. [侯振宇, 张静, 张鸿涛, 等. 胰管空肠吻合在胰十二指肠切除术中的应用研究[J]. 武警后勤学院学报(医学版), 2013, 22(1): 19-21.]
[7] Stojadinovic A, Brooks A, Hoos A, et al. An evidence-based approach to the surgical management of resectable pancreatic adenocarcinoma[J]. J Am Coll Surg, 2003, 196(6): 954-964.
[8] Halloran CM, Ghaneh P, Bosonnet L, et al. Complications of pancreatic cancer resection[J]. Dig Surg, 1999, 19(2): 138-146.
[9] Berberat PO, Friess H, Kleeff J, et al. Prevention and treatment of complications in pancreatic cancer surgery[J]. Dig Surg, 1999,16(4): 327-336.
[10] Zhong L, Xiao SD, Stoker J, et al. Magnetic resonance cholangiopancreatography[J]. Chin J Dig Dis, 2004, 5(4):139-148.
[11] Park JK, Kraus FC, Haaga JR. Fluid flow during percutaneous drainage procedures: An in vitro study of the effects of fluid viscosity,catheter size,and adjunctive urokinase[J]. Am J Roentgenol, 1993, 160(1): 165-169.
[12] Gobien RP, Stanley JH, Soucek CD, et al. Routine preoperative biliary drainage:effect on the management of obstructive jaundice[J]. Radiology, 1984, 152(2): 353-356.
[13] Mueller PR, Sonnenberg E, Ferrucci JT. Percutaneous drainage of 250 abdominal abscesses and fluid collections. Part II: current procedural concepts[J]. Radiology, 1984, 151(2): 343-347.
