改良法对NSCLC患者癌组织及外周血K-ras基因常见突变位点的检测
2014-04-01李学琴张露萍徐燕梅彭丽娜孙建国陈正堂
李学琴,张露萍,徐燕梅,彭丽娜,孙建国,陈正堂
肺癌是当今世界发病率、死亡率最高的恶性肿瘤,其中80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)。近来基于表皮生长因子受体(epidermal growth factor receptor,EGFR)和K-ras基因检测的EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)靶向治疗为NSCLC患者带来了新的希望[1]。现已明确,K-ras基因是EGFR信号传导通路中重要的下游分子,其突变与肺癌患者对TKI的原发性耐药有关,而且97%的突变位点为外显子2的12和13位密码子[1]。因此K-ras突变是影响NSCLC患者TKI治疗效果及预后的关键因素[2],检测K-ras突变是一个必要的治疗抉择。研究发现K-ras突变为肿瘤特异性的体细胞遗传改变,正常细胞中尚未发现[3],但在癌症患者的血浆中,有少量的包含突变序列的游离DNA从原发或转移的肿瘤细胞释放入血,但由于浓度过低,很难在大量的野生型序列中将其检测出来,如传统的Sanger测序方法需要突变体DNA至少占到野生型DNA的10%~20%[4]。因此,提高突变DNA相对浓度,抽提并富集少量突变小片段DNA是技术的关键。在本研究中,我们建立了一种酶切富集突变DNA后行焦磷酸测序的方法,用于检测临床癌组织及血浆样本中的K-ras突变体。
1 资料与方法
1.1 临床资料 收集2013年1月-10月在重庆新桥医院全军肿瘤诊治研究所治疗的经组织学和(或)细胞学确诊的43例NSCLC患者的癌组织和外周血标本,所有患者TNM分期均为Ⅲ-Ⅳ期。
1.2 标本采集与DNA提取 ①患者入院后次日采集空腹外周静脉血2ml,EDTA抗凝,2h内分离血浆,采用QIAamp Mini Blood Kit提取血浆内游离DNA。②包括经皮肺穿刺和纤维支气管镜所取得的新鲜组织或4%甲醛浸泡或石蜡包埋的切片,采用QIAamp DNA FFPE Tissue Kit提取组织DNA,具体操作按说明书进行。超微量紫外分光光度计测定DNA浓度,记录编号,置于-20℃冰箱保存备用。
1.3 酶切富集PCR扩增 采用酶切富集PCR法扩增包含12与13号密码子在内的K-ras基因第2外显子。引物(表1)由上海英骏生物科技有限公司合成。
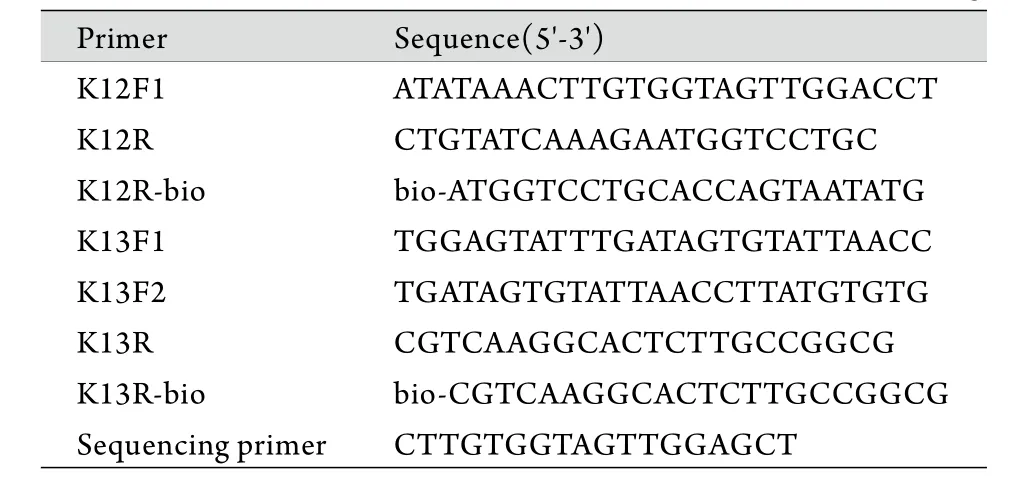
表1 酶切富集PCR扩增引物及焦磷酸测序引物Tab.1 The primer of mutant-enriched PCR and pyrosequencing
第一轮PCR反应体系为25μl。12密码子的PCR扩增条件为:94℃预变性3min;94℃变性20s、58℃退火30s、72℃延伸20s,共30个循环;72℃延伸10min。13密码子的PCR扩增条件为:94℃预变性3min;前10个循环为94℃变性20s、54℃退火30s、72℃延伸20s,后25个循环为94℃变性20s、60℃退火30s、72℃延伸20s,共35个循环;最后72℃延伸10min。
使用突变体特异的内切酶Bsto Ⅰ、Nar Ⅰ选择性地酶切第一轮PCR扩增产物中K-ras第2外显子的12、13密码子。相应孵育温度下孵育4h(12、13密码子的孵育温度分别为60℃、37℃)。
第二轮PCR反应体系为40μl。12、13密码子的PCR扩增条件为:94℃预变性3min;94℃变性20s、60℃退火30s、72℃延伸20s,共50个循环;72℃延伸10min。根据K-ras突变情况将结果分为两组,即突变组和K-ras野生组。
1.4 焦磷酸测序 ①设定程序,分析序列为:GG/T/A/CTGG/A/C/TCGTAAGGCAAG;碱基分配序列为:TACGACTCAGATCGTAG。②在96孔PCR反应板中加入磁珠3μl、结合缓冲液37μl、PCR产物40μl,室温下1400r/min充分混匀5min。③配制含0.3μmol/L测序反应液45μl。④开启真空泵吸取磁珠和PCR产物混悬液,依次浸入70%乙醇、0.2mol/L NaOH和洗脱缓冲液中洗涤5s、5s、10s。关闭真空泵,将探头上吸附的磁珠释放入测序反应液,80℃孵育2min,使测序引物与模板退火杂交,然后室温下冷却10min。⑤根据程序计算得出剂量,在试剂仓中依次加入底物混合物、酶混合物以及4种dNTP,将试剂仓和96孔测序反应板放入机箱中开始反应[5]。
1.5 灵敏度鉴定 将K-ras基因突变型(12密码子)的A549细胞与K-ras基因野生型的HCC827细胞提取基因组DNA,使其中突变型与野生型K-ras基因的比例分别为1:0、0:1、1:1、1:10、1:100、1:1000、1:5000。按上述检测12密码子突变的方法进行检测。
2 结 果
2.1 焦磷酸测序检测突变结果 43例癌组织中检测出4例突变,突变率为9.3%(4/43),外周血样本中检测出3例突变,突变率为7.0%(3/43)。以癌组织中检测到的K-ras为标准,两者突变一致性达75.0%(3/4,表2)。两种标本同时存在突变的有3例,均为12密码子突变;A1、A2,D1、D2突变类型为GGT→AGT;B1,C1、C2突变类型为GGT→GAT;B2为野生型(图1)。

表2 NSCLC患者外周血和癌组织K-ras突变一致性Tab.2 Consistency of K-ras mutation from NSCLC patients'plasma and matched cancer tissue
2.2 灵敏度测试结果 K-ras突变型与野生型细胞分别按1:0、0:1、1:1、1:10、1:100、1:1000、1:5000比例混合(图2),当突变型与野生型K-ras基因比例大于1:1000时(0.1%)时,即可见到突变的峰,表明检测阈值为0.1%(突变型/野生型基因)。
3 讨 论
ras基因家族中与人类肿瘤相关的基因有3种,即H-ras、K-ras、N-ras,其中K-ras与人类癌症关系最为密切,该基因位于人类染色体12p12.1,其编码的ras蛋白是细胞外信号向胞内传导的信号通路网络中的主要蛋白之一,可作为分子开关参与细胞增殖、分化、凋亡的调控。K-ras基因突变会导致ras蛋白异常活化,持续激活ras-raf-MEK等信号通路,导致细胞异常增生,促进肿瘤形成[6]。NSCLC患者K-ras突变主要发生于第2外显子的12、13密码子,其中12密码子的突变占87%,13密码子的突变占12%;第3外显子的61和146密码子的突变发生率低,只占K-ras突变的1%~4%。因此12、13密码子的基因突变状态越来越受到研究者们的重视。
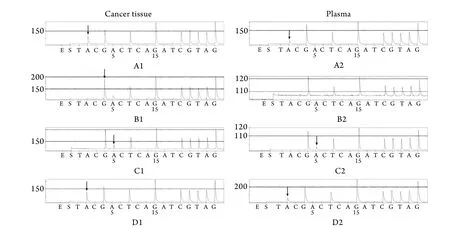
图1 NSCLC患者外周血和癌组织K-ras突变焦磷酸测序检测结果Fig.1 K-ras mutations of NSCLC patients detected by pyrosequencing1. K-ras mutation in cancer tissue; 2. K-ras mutation in plasma. The black arrow showed the point mutation G→A in codon 12

图2 改良的酶切富集PCR-焦磷酸测序技术灵敏度测试结果Fig.2 The sensitivity of the modified mutant-enriched PCR combined with pyrosequencing The ratio of mutation type/wild type was 1:0(A), 0:1(B), 1:1(C), 1:10(D), 1:100(E), 1:1000(F) and 1:5000(G)
以往认为K-ras基因突变常常发生在肿瘤恶变的早期,原发灶和转移灶的K-ras基因保持高度一致[7],且K-ras基因状态不会因治疗而发生变化[8]。然而目前已证实K-ras基因状态在转移进展过程中并不总是稳定的,在NSCLC患者的整个病程中,肿瘤细胞不断增殖分化,K-ras基因可能在转移过程中发生改变[9]。K-ras基因的转换状态可能是原发灶阴性而转移灶阳性,也可能原发灶阳性而转移灶阴性。即使只在一小部分细胞中检测到K-ras基因突变,仍然会给TKI治疗带来阻力。因此在同一患者不同时期,肿瘤对靶向治疗的适应性可能会有明显不同,建议在治疗过程中动态监测K-ras基因突变状况。
目前一般采用肿瘤组织DNA进行突变检测,常通过经皮肺穿刺、手术、纤维支气管镜等途径获得,但若动态监测组织来源的肿瘤细胞DNA突变状况,获取组织时创伤大,患者难以接受,对外周血进行检测具有创伤小、取材方便、可动态随访等特点,患者易于接受,但外周血中游离DNA量少,扩增少量突变DNA是技术上的关键。众多学者为解决这一难题,在PCR法的基础上探索出酶切富集PCR法,通过PCR扩增野生型或突变型DNA,限制性酶消化野生型基因,经消化后突变的比例相对于野生型DNA显著增加,然后再行第二轮PCR扩增突变的DNA序列。Maluf-Filho等[10]采用酶切富集PCR联合限制性片段长度多态性方法检测57例胰腺癌患者的癌组织,结果显示K-ras突变率为66.7%;Wu等[11]采用酶切富集PCR联合液态芯片分析技术检测109例非小细胞肺癌患者血清,结果显示K-ras基因突变率为31.2%;Yang等[12]采用酶切富集联合变性高效液相分析技术检测120例结直肠癌患者血浆,结果显示K-ras基因总突变率为38.3%。但这些方法分别需要应用电泳、设计镀探针的磁珠等,成本高、操作繁琐、结果主观性强。基于上述考虑,本研究探索了在酶切富集PCR的基础上,联合焦磷酸测序技术对PCR产物的突变类型进行分析。焦磷酸测序是一种新的DNA序列分析技术,其特点是操作简便、高通量、自动化,适合大样本的快速检测,但缺点为需已知突变位点,据突变位点选择特异的限制性内切酶。
本研究中,癌组织中K-ras基因突变率为9.3%,与文献报道的肺癌K-ras突变率10%~30%相比稍偏低[12],考虑可能是样本量相对较少所致。本研究的43例癌组织样本中,4例为12密码子突变,突变类型为GAT、AGT;外周血样本中,3例为12密码子突变,突变类型与癌组织一致,1例经重复检测仍未检测到突变,原因可能为:①癌细胞在转移过程中丢失了某种K-ras基因型;②癌细胞群中存在广泛的表观遗传学及细胞遗传学,或是具有特定的器官转移亲嗜性[13]。本实验的灵敏度为0.1%,是直接测序法的100倍。本技术更适合临床检测血浆和组织样本中少量突变的K-ras基因,可用于活检和循环肿瘤细胞样本的检测。
[1] Forbes S, Clements J, Dawson E, et al. COSMIC 2005[J]. Br J Cancer, 2006, 94 (2): 318-322.
[2] Massarelli E, Varella-Garcia M, Tang X, et al. KRAS mutation is an important predictor of resistance to therapy with epidermal growt factor receptor tyrosine kinase inhibitors in non-smallcell lung cancer[J]. Clin Cancer Res, 2007, 13 (10): 2890-2896.
[3] Dong Q, Huang J, Zhou Y, et al. Hematogenous dissemination of lung cancer cells during surgery: quantitative detection by flow cytometryand prognostic significance[J]. Lung Cancer, 2002, 37(3): 293-301.
[4] Moskalev EA, Stöhr R, Rieker R, et al. Increased detection rates of EGFR and KRAS mutations in NSCLC specimens with low tumour cell content by 454 deep sequencing[J]. Virchows Arch,2013, 462 (4): 409-419.
[5] Sun J, Ming H, Sun JG, et al. KRAS mutation detection by pyrosequencing in plasmaof 63 patients with advanced NSCLC[J]. Chongqing Med, 2012, 41 (11): 1062-1064. [孙洁,明华,孙建国, 等. 焦磷酸测序技术检测63例晚期NSCLC患者血浆KRAS基因突变[J]. 重庆医学, 2012, 41 (11): 1062-1064.]
[6] Siddiqui AD, Piperdi B. KRAS mutation in colon cancer: a marker of resistance to EGFR-I therapy[J]. Ann Surg Oncol,2010, 17 (4): 1168-1176.
[7] Lee JC, Wang ST, Lai MD, et al. K-ras gene mutation is a useful predictor of the survival of earl stage colorectal cancers[J].Anticancer Res, 1996, 16 (6B): 3839-3844.
[8] Jimeno A, Messersmith WA, Hirsch FR, et al. KRAS mutations and sensitivity to epidermal growth factor receptor inhibitors in colorectal cancer: practical application of patient selection[J]. J Clin Oncol, 2009, 27 (7): 1130-1136.
[9] Cortot AB, Italiano A, Burel-Vandenbos F, et al. KRAS mutation status in primary nonsmall cell lungcancer and matched metastases[J]. Cancer, 2010, 116(11): 2682-2687.
[10] Maluf-Filho F, Kumar A, Gerhardt R, et al. Kras mutation analysis of fine needle aspirate under EUS guidance facilitates risk stratification of patients with pancreatic mass[J]. J Clin Gastroenterol, 2007, 41(10): 906-910.
[11] Wu S, Zhu Z, He J, et al. A novel mutant-enriched liquidchip technology for the qualitative detectionof somatic mutations in KRAS gene from both serum and tissue samples[J]. Clin Chem Lab Med, 2010, 48(8): 1103-1106.
[12] Yang Z, Long MJ, Wang F, et al. Detection and clinical significance of EGFR and KRAS mutation in peripheral blood from tumor patients by REDE-DHPLC[J]. Chin J Lab Med,2011, 34(4): 327-332. [杨卓, 龙美娟, 王斐, 等. 酶切富集联合DHPLC检测肿瘤患者外周血EGFR和KRAS基因突变及其临床应用[J]. 中华检验医学杂志, 2011, 34(4): 327-332.]
[13] Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing[J]. N Engl J Med, 2012, 366 (10): 883-892.
