趋化素对大鼠血管平滑肌细胞生物学行为的实验研究
2014-03-30吴美善梁新剑董少红
吴美善,熊 玮,梁新剑,董少红
(深圳市人民医院心血管内科,广东 深圳 518020)
趋化素是孤独G蛋白偶联受体chemR23的内源性配体,在组织中分布广泛,主要由脂肪组织和肝脏合成分泌,具有调节骨骼的发育和代谢,维持皮肤正常生理功能等多种生物学效应。以往的研究表明,趋化素是一种脂肪因子,其表达水平与肥胖相关,并有调节脂肪细胞分化、促进脂质代谢、调节炎症和免疫反应等生物学效应,被认为是代谢综合征的标志物[1-2]。最近的研究发现,人冠状动脉周围的脂肪组织及冠状动脉病变部位的血管平滑肌细胞(vascular smooth muscle cell,VSMC)和泡沫细胞均可高表达趋化素,且冠状动脉粥样硬化病变的严重程度与趋化素的水平呈正相关[3]。因此,本研究借助RNA干扰技术沉默趋化素相关基因,研究其对大鼠VSMC生物学行为的影响,现报道如下。
1 材料与方法
1.1实验材料 无特定病原级SD大鼠购自广东省实验动物中心,杜氏培养液(dulbecco′s modified eagle medium,DMEM)、0.25%胰酶、胎牛血清(fetal calf serum,FBS)均购自Gibco公司,脂质体2000转染试剂购自Invitrogen公司,RNA提取试剂盒购自Qiagen公司,反转录反应试剂盒及染料法实时荧光定量试剂盒购自Takara公司,CCK8试剂盒购自同仁化学研究所,transwell小室购自Corning公司,双染细胞凋亡检测试剂盒购自凯基生物公司,大鼠α肌动蛋白抗体购自博士德公司,大鼠趋化素基因抑制剂及阴性对照由吉玛公司合成,大鼠趋化素聚合酶链反应(polymerase chain reaction,PCR)引物及磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)引物由生工生物工程(上海)股份有限公司合成。
1.2研究方法
1.2.1VSMC细胞培养 选取100~150 g 健康的无特定病原级雌性SD大鼠5只,断头处死,无菌条件下取出胸主动脉,剥离外膜和内膜,取出中膜组织,以1mm3大小组织块进行贴壁培养,4~6 h后翻瓶,在含20%FBS的DMEM培养液中培养VSMC,混匀后差速传代纯化1~2次,免疫荧光法鉴定VSMC α肌动蛋白。VSMC培养成功后在含10%FBS的DMEM培养液、37 ℃、5%CO2培养箱中培养。
1.2.2趋化素抑制剂转染 VSMC消化离心后以合适密度接种到培养板,24 h后细胞融合到60%~70%时按照脂质体2000说明书进行操作,分成空白对照组A、阴性对照组B及抑制组C,后两组分别转染微RNA(microRNA,miRNA)146a错义链(100 nmol/L)、趋化素抑制剂(100 nmol/L),空白对照组加入同等剂量脂质体2000及PBS,5 h后换成完全培养液,荧光显微镜观察转染效率。
1.2.3荧光定量PCR 转染48 h后按照RNA提取试剂盒说明书提取VSMC总RNA,紫外分光光度计和琼脂糖凝胶电泳测定RNA的浓度和纯度,按照Takara反转录试剂盒操作说明进行反转录反应,反应体系为5xPrimeScipt buffer 2 μL,PrimeScipt RT Enzyme Mix I 0.5 μL,Oligo dt Primer 0.5 μL,Random 6 mers 0.5 μL,总RNA5 μL及去酶水加至10 μL,反转录条件:37 ℃ 15 min,85 ℃ 5 s。取出后放置-20 ℃冰箱保存待测。
按照染料法实时荧光定量试剂盒荧光定量PCR试剂盒说明书进行PCR反应,引物序列为:趋化素上游引物5′-ATCGGTCGACGCATGAAGTGCTTGCTGATCTC-3′,下游引物5′-ATCGCTCGAGTTTGGTTCTCAGGGC-3′,GAPDH上游引物5′-TCCCTCAAGATTGTCAGCAA-3′,GAPDH下游引物5′-AGATCCACAACGGATACATT-3′。反应体系为:染料法实时荧光定量试剂盒 10 μL,上游引物0.4 μL,下游引物0.4 μL,ROX Reference Dye 0.4 μL,DNA模板2.0 μL,dH2O 6.8 μL,反应条件:95 ℃ 10s,循环1次;95 ℃ 5 s,60 ℃ 30 s,循环40次。miR-146a与GAPDH相对表达量用公式2-ΔΔCT计算。
1.2.4VSMC增殖 细胞消化离心后以每孔1×104个细胞接种到96孔板,每组设6个复孔,24 h后进行转染,5 h后换成100 μL完全培养液,分别在0、12、24和48 h加入10 μL 细胞增殖检测试剂盒染色,在37 ℃、5% CO2培养2 h后在酶联免疫检测仪下测定450 nm(参考波长650 nm)的光密度值。
1.2.5VSMC迁移 细胞转染48 h后消化离心,调整细胞浓度为1×105/mL,取100 μL细胞悬液加入transwell小室,培养板内加入200 μL含20% FBS的DMEM培养液,12 h后取出transwell小室,棉拭子刮除膜上层的细胞,4%多聚甲醛固定30min,PBS洗3遍,0.1%结晶紫染色10 min,每组随机取6个视野,在显微镜下计算每个视野下的细胞数。
1.2.6VSMC凋亡 细胞消化离心后以每孔1×105个细胞接种到6孔板,常规转染,48 h后以不含乙二胺四乙酸的0.25%胰酶消化离心,PBS洗涤细胞,先后加入500 μL的连接缓冲液、1 μL细胞凋亡检测试剂盒及5 μL 7-氨基放线菌素,在1 h内用流式细胞仪检测。
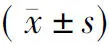
2 结 果
2.1趋化素抑制剂转染效率及PCR检测 转染趋化素抑制剂5 h后用荧光显微镜观察,在VSMC胞质内可见大量颗粒状荧光,部分荧光可呈现细胞轮廓,表明趋化素抑制剂已进入VSMC内趋化素对大鼠血管平滑肌细胞生物学行为的实验研究。为了验证是否干扰成功,应用实时PCR检测了3组细胞之间的miR-146a水平,与空白对照组A和阴性对照组B相比,抑制组C的miR-146a水平显著下降表明RNA干扰成功(表1)。
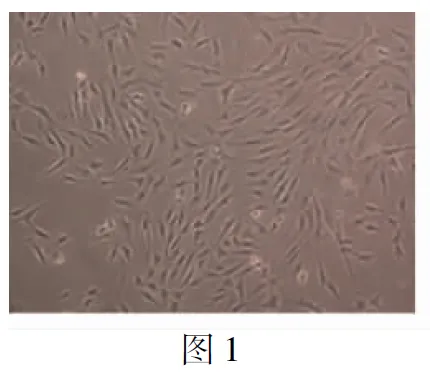
图1 原代VSMC(光镜×100)
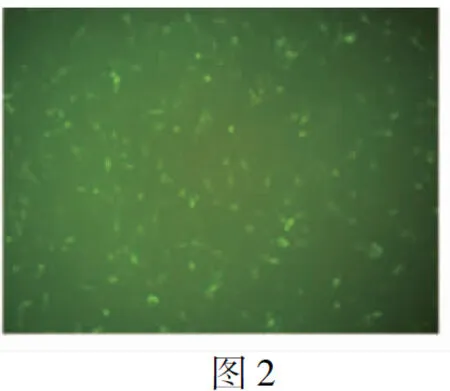
图2 趋化素抑制剂转染效率(荧光显微镜×200)
图3 趋化素抑制剂对VSMC迁移的作用(×200)
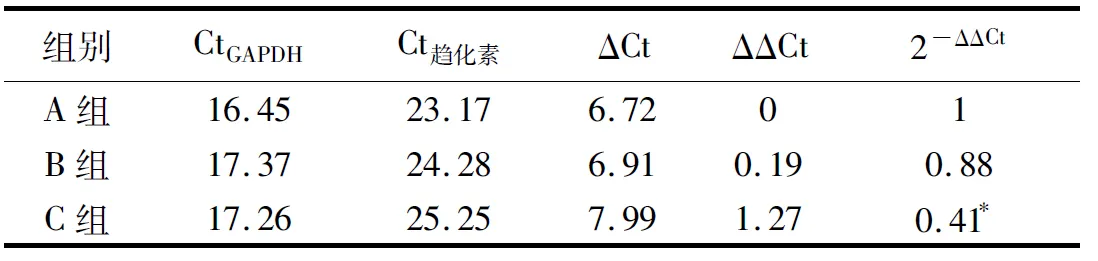
表1 各组之间趋化素mRNA荧光定量PCR结果
ΔCt=Ct趋化素-CtGAPDH;ΔΔCt=(ΔCtB组或C组-ΔCtA组) A组:空白对照组;B组:阴性对照组;C组:抑制组
2.2趋化素抑制剂抑制VSMC增殖 为了研究沉默趋化素对VSMC增殖的作用,采用CCK8法检测3组细胞在转染后0~48h的增殖率。转染前,3组细胞的光密度值相比差异无统计意义(P>0.05),12 h时抑制组C细胞的光密度出现差异,但无统计意义(P>0.05),在24 h和48 h时,抑制组C与空白对照组A、阴性对照组B之间出现差异,有统计学意义(P<0.05)(表2)。
2.3趋化素抑制剂抑制VSMC迁移 在转染趋化素抑制剂后48 h,对穿过transwell小室的细胞进行计数发现,C组的细胞数显著少于A组和B组,差异有统计学意义(P<0.01)(表3及图3,见封三),表明抑制趋化素可以降低VSMC的迁移能力。
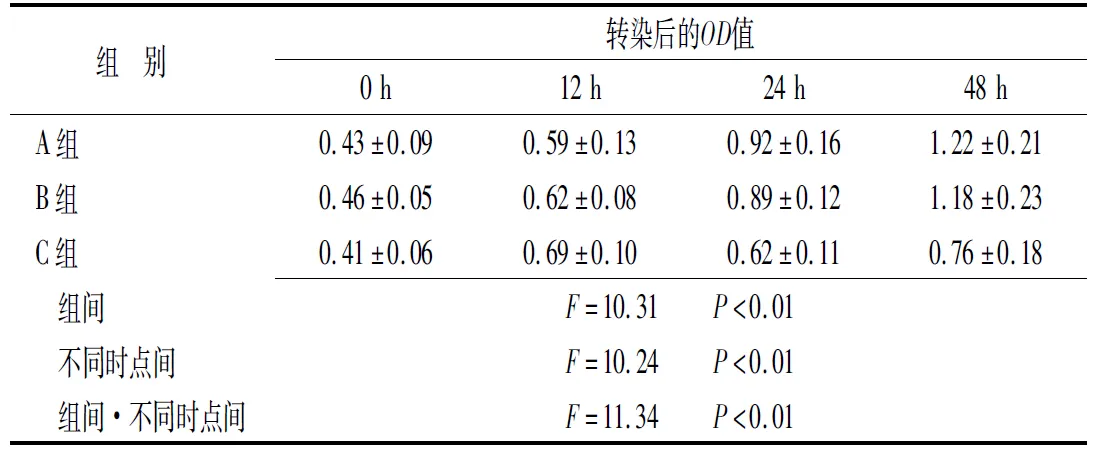
表2 趋化素抑制剂对VSMC增殖的作用
A组:空白对照组;B组:阴性对照组;C组:抑制组

表3 趋化素抑制剂对VSMC穿过transwell小室数量的影响
A组:空白对照组;B组:阴性对照组;C组:抑制组
2.4趋化素抑制剂抑制VSMC凋亡的作用 在转染趋化素抑制剂48 h后,采用双染法测定VSMC凋亡。结果显示,A组与B组VSMC的凋亡率分别为(5.5±0.7)%和(6.3±1.0)%,C组VSMC的凋亡率为(14.2±3.7)%,C组VSMC的凋亡率显著高于A组和B组,差异有统计学意义(F=14.61,P<0.05)(图4)。
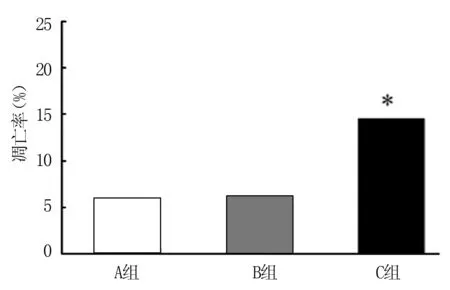
*与A组比较,P<0.05
3 讨 论
VSMC增殖、迁移以及凋亡发生改变可能受到各种因素的调控,因此阐明某一特定状态下的VSMC生物学行为是治疗血管增生性疾病的新举措。前人的研究已经初步验证了趋化素与冠状动脉粥样硬化性心脏病和急性心肌梗死的发生具有相关性[4-5],鉴于再狭窄的发生机制主要是炎症和免疫反应,与动脉粥样硬化的病理过程大致相同,因而可以假设趋化素的激活和表达也可能是促进再狭窄发生、发展的重要因素之一。所以本研究通过RNA干扰技术,以沉默VSMC中的趋化素,观察其对VSMC增殖、迁移和凋亡的影响。
本研究中,VSMC增殖的结果显示在转染趋化素抑制剂后VSMC增殖受到显著抑制,同时,检测细胞凋亡的流式结果表明受到趋化素抑制剂转染后的VSMC细胞凋亡率显著高于空白对照组A和阴性对照组B,提示沉默趋化素不仅有抑制VSMC增殖的作用,而且兼有促进VSMC凋亡的作用,这与Cui等[6]的研究结果近似。此外,关于对VSMC迁移的影响情况,本实验结果显示经趋化素抑制剂转染的VSMC迁移率显著低于其余两组,结合VSMC受到活性物质刺激时,表型可发生改变即由收缩型转变为合成型,增殖能力也增强,位置也可发生改变,由血管中膜迁移到内膜,从而使血管壁增厚,管腔变窄,导致血管壁组织发生重构的病理生理特点[7],提示其可能为行经皮腔内冠状动脉成形术患者术后再狭窄的发生机制之一。这与Asare等[8]的研究相一致。
本实验通过RNA干扰技术沉默趋化素能够显著抑制大鼠VSMC的增殖和迁移,并能提高其凋亡水平,为血管增生性疾病的防治提供了试验依据。但这些效应的具体机制尚不清楚,有待进一步研究。
[1] Ernst MC,Sinal CJ.Chemerin:at the crossroads of inflammation and obesity[J].Trends Endocrinol Metab,2010,21(11):660-667.
[2] Bondue B,Wittamer V,Parmentier M.Chemerin and its receptors in leukocyte trafficking,inflammation and metabolism[J].Cytokine Growth Factor Rev,2011,22(5/6):331-338.
[3] Spiroglou SG,Kostopoulos CG,Varakis JN,etal.Adipokines in periaortic and epicardial adipose tissue:differential expression and relation to atherosclerosis[J].J Atheroscler Thromb,2010,17(2):115-130.
[4] Lehrke M,Becker A,Greif M,etal.Chemerin is associated with markers of inflammation and components of the metabolic syndrome but does not predict coronary atherosclerosis[J].Eur J Endocrinol,2009,161(2):339-344.
[5] Hah Y,Kim N,Kim M,etal.Relationship between chemerin levels and cardiometabolic parameters and degree of coronary stenosis in Korean patients with coronary artery disease[J].Diabetes Metab J,2011,35(3):248-254.
[6] Cui X,Chopp M,Zacharek A,etal.Chemokine,vascular and therapeutic effects of combination Simvastatin and BMSC treatment of stroke[J].Neurobiol Dis,2009,36(1):35-41.
[7] 武衡,钟杨,汤显靖,等.黏着斑激酶对血小板源性生长因子刺激的血管平滑肌细胞迁移和黏附的调控[J].中华老年心脑血管病杂志,2010,12(7):648-651.
[8] Asare Y,Schmitt M,Bernhagen J.The vascular biology of macrophage migration inhibitory factor (MIF) expression and effects in inflammation,atherogenesis and angiogenesis[J].Thromb Haemost,2013,109(3):391-398.
