糖尿病患者内皮祖细胞功能的研究进展
2014-03-30孙丽娜高海娜综述陈树春审校
孙丽娜,高海娜(综述),陈树春(审校)
(1.河北医科大学研究生学院,石家庄 050017; 2.河北省人民医院内分泌一科,石家庄 050051)
目前,随着人们生活方式的改变,糖尿病已经成为世界范围内最常见的疾病。心血管并发症是糖尿病患者的主要死因,伴有心血管并发症的患者平均寿命将减少大约10年[1]。大量研究认为,糖尿病患者心血管损伤和修复之间的失衡是糖尿病相关心血管并发症发生的关键过程[2]。内皮祖细胞(endothelial progenitor cells,EPCs)具有增殖和修复能力,能够定向分化为内皮细胞,促进内皮细胞再生并参与血管新生。研究表明,糖尿病患者EPCs数量减少、功能损伤可能与心血管并发症的发生和发展密切相关[3]。该文主要探讨糖尿病患者EPCs损伤所涉及的机制以及目前改善EPCs功能的方法在预防糖尿病血管并发症中潜在的临床意义。
1 EPCs的生物学特性
Asahara等[4]在1997年首次描述了EPCs具有生成血管的特性。用于定义EPCs的表面抗体包括血管内皮生长因子受体、CD34和CD133。EPCs能够维持内皮完整性和血管稳定状态。机体血管组织损伤后,EPCs通过动员、迁移、归巢以及形成毛细血管网促进血管损伤部位内皮再生和修复。
EPCs主要存在于人体骨髓微环境中。细胞因子、胰肽酶、组织蛋白酶G和基质金属蛋白酶通过与干细胞和骨髓基质细胞相互作用诱导EPCs动员。蛋白酶能够裂解干细胞衍生因子1α(stromal-derived factor-1α,SDF-1α),该物质由基质细胞释放,它的受体是干细胞和祖细胞表面的趋化因子受体4(cxc chemokin receptor 4,CXCR-4)。干细胞动员是由于循环中SDF-1α升高逆转了骨髓屏障SDF-1α的梯度,驱使CXCR-4阳性的细胞离开骨髓[5]。而血管内皮生长因子(vascular endothelial growth factor,VEGF)、SDF-1α和胚胎生长因子诱导的EPCs动员都依赖于基质金属蛋白9发挥作用。EPCs动员的重要信号转导通路为磷脂酰肌醇-3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)通路。PI3K/Akt通路调节EPCs的募集、动员和增殖;eNOS的表达和磷酸化是EPCs存活、迁移和血管形成所必不可少的;而其下游一氧化氮(nitric oxide,NO)通过亚硝基化和上调VEGF的表达促进EPCs从骨髓动员[6]。动员后的EPCs通过复杂的信号通路到达受损的内皮部位,促进血管生成。目前研究认为EPCs促进血管新生的机制包括两方面:一方面通过自身的分化增殖形成新生血管;另一方面,EPCs本身可以分泌VEGF等细胞生长因子,通过旁分泌效应促进局部血管内皮细胞增殖[7]。
2 糖尿病患者EPCs功能紊乱的机制
大量研究表明糖尿病患者体内EPCs数量和功能下降。在高糖状态下,EPCs对刺激因素的应答反应降低。目前研究发现,许多因素参与糖尿病EPCs的功能损伤,主要包括高糖诱导的氧化应激反应、eNOS/NO通路损伤、氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)的脂毒性以及一些细胞因子产生的炎症作用,最终导致了糖尿病血管病变的发生。
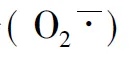
由于葡萄糖自身氧化作用,糖尿病患者体内EPCs产生超氧阴离子,增强了蛋白激酶C和烟酰胺腺嘌呤二核苷酸磷酸氧化酶的活性,导致糖尿病患者NO生物活性下降,EPCs数量减少和功能受损[6]。而NO和超氧阴离子相互作用生成的过氧亚硝基能够进一步减少EPCs数量并损伤EPCs功能[8]。细胞超氧化物歧化酶(superoxide dismutase,SOD)活性下降与血管氧化应激损伤密切相关。Hamed等[9]通过SOD保持NO的生物活性,恢复高糖培养的EPCs增殖能力,SOD能够阻断过氧亚硝基的形成,增强EPCs的增殖能力。总之,糖尿病患者在高糖状态下,机体氧化应激反应增强,抗氧化能力减弱,导致EPCs数量减少,动员、迁移、增殖等功能受损。
2.2eNOS/NO通路损伤 PI3K/Akt和eNOS/NO通路在EPCs动员、招募和归巢过程中发挥重要作用。研究发现,NO生物活性下降是糖尿病患者血管损伤发生的关键因素[6]。由于糖尿病患者体内氧化应激反应增强,eNOS的必要辅酶四氢生物蝶呤减少,导致eNOS解偶联[10],同时蛋白激酶C活性增强产生过量的超氧阴离子,从而降低NO生物活性。NO活性下降,不足以调节血管扩张刺激磷蛋白磷酸化以及肌动蛋白聚合,导致糖尿病患者EPCs迁移功能受损。此外,糖尿病患者EPCs中烟酰胺腺嘌呤二核苷酸磷酸氧化酶受到抑制后,NO生物活性和EPCs内皮化功能得到恢复[11]。
2.3oxLDL的氧化损伤 糖尿病患者体内氧化应激反应升高,产生过多oxLDL,体内oxLDL水平升高会增加2型糖尿病患者心血管并发症患病风险,同时oxLDL影响EPCs的存活和功能。oxLDL能够降低正常EPCs Akt磷酸化作用、eNOS的表达和NO的生成[12]。同时,EPCs暴露于高血糖环境后,CXCR-4的表达水平有所改变。这些细胞信号通路的改变共同导致EPCs迁移受损。所以,糖尿病患者oxLDL产生增多是糖尿病患者EPCs功能紊乱的潜在机制之一。
2.4炎症因素 糖尿病患者长期处于持续严重的炎症反应状态,炎症能够影响EPCs的数量和功能。研究发现,EPCs对炎症反应有两种不同反应,低度的炎性细胞因子能够促进EPCs向受损血管组织归巢和黏附,EPCs数量也有所升高[13]。稳定型心绞痛患者体内EPCs与C反应蛋白水平呈正相关,表明系统性炎症可能是这些患者体内EPCs动员的刺激因素[14]。但是在诸如糖尿病等持续严重的炎症状态下,EPCs动员、黏附和增殖功能受损,EPCs数量下降。在高糖刺激下,机体炎性因子肿瘤坏死因子α升高,诱导EPCs产生细胞凋亡、胰岛素抵抗以及Akt磷酸化减少,从而导致EPCs数量减少[15]。Sun等[16]研究发现,高脂诱导肥胖模型的大鼠体内EPCs数量和功能显著低于正常对照组,而内脂素水平显著高于对照组,内脂素可能通过核因子κB通路影响EPCs数量和功能。因此,目前认为炎症对于EPCs是一把“双刃剑”,低度炎症反应诱导EPCs动员,而严重的炎性反应损害EPCs功能。虽然确切的调节机制仍不明确,但大多数学者认为机体持续暴露于炎性反应导致骨髓中储存的EPCs耗竭,最终引起EPCs数量减少和功能紊乱[15]。
3 糖尿病患者EPCs功能紊乱的治疗
3.1降糖药物对EPCs的影响 毫无疑问,良好的血糖控制会给糖尿病患者大血管、微血管并发症带来良好的结局。可以说,在2型糖尿病患者中,EPCs水平和血管状态与血糖控制情况紧密相关,血糖控制满意者可以降低体内糖毒性、脂毒性和炎症反应,从而保护血管功能。格列齐特是第二代磺脲类药物,通过激活过氧化物酶体受体γ发挥抗氧化作用,增强NO调节的血管舒张功能。新诊断的2型糖尿病患者经过格列齐特治疗12周后,血流介导的血管舒张功能、外周循环中EPCs计数和SOD活性都明显改善[17]。二肽肽酶抑制剂是新一代降糖药物,它通过减少胰高血糖素样肽的降解,使胰岛素分泌增加从而提高葡萄糖耐受水平。近期一项研究表明,西格列汀通过抑制炎性反应能够改善糖尿病患者EPCs功能,进而预防糖尿病患者的血管病变[18]。目前严格控制血糖仍是预防糖尿病血管病变最有效的方法,寻找合理有效的降糖方法至关重要。
3.2血管紧张素转化酶抑制剂/血管紧张素受体阻滞剂 血管紧张素Ⅱ在糖尿病患者血管并发症的发生中发挥重要作用,血管紧张素转化酶抑制剂/血管紧张素受体阻滞剂能够预防心脏增生、动脉粥样硬化,从而降低心力衰竭患者的发病率和病死率。目前研究发现不同类型的血管紧张素受体阻滞剂对EPCs产生不同的影响。Matsuura等[19]报道,血管紧张素受体阻滞剂促进分化的脂肪细胞产生脂联素,脂联素能够改善机体胰岛素抵抗并通过PI3K/细胞分裂周期蛋白42/Ras相关的C3肉毒素底物1通路促进EPCs的迁移。替米沙坦被认为是一种过氧化物酶体受体γ的部分激动剂,通过激活过氧化物酶体受体γ诱导脂联素产生。而且替米沙坦可以通过调节PI3K/Akt通路促进EPCs动员分化[20]。血管紧张素受体阻滞剂不仅通过抑制氧化应激直接改善糖尿病患者EPCs功能,而且通过改善胰岛素敏感性和上调脂联素的产生间接影响EPCs的功能。
3.3他汀类药物 他汀类药物为羟甲戊二酰辅酶A还原酶抑制剂,是一类调脂药物,可以改善机体脂毒性。目前大量研究表明,他汀类药物通过促进PI3K/Akt和eNOS/NO通路,上调VEGF、eNOS和Akt的mRNA表达,增强NO生物活性,刺激EPCs分化和增殖,NO在他汀类药物介导的EPCs动员中发挥关键作用[21]。给予PI3K/Akt通路特异性抑制剂后,他汀类数量和功能改善作用被阻断。阿托伐他汀培养EPCs呈剂量依赖方式减少H2O2诱导的EPCs细胞凋亡[21]。他汀类药物可以修饰EPCs的氧化还原反应进而影响细胞凋亡。
3.4基因治疗 研究表明,在剔除目的基因或目的基因过表达的小鼠模型中,EPCs功能有所恢复。Di Stefano等[22]发现从p66ShcA基因剔除小鼠体内获得的EPCs能够抵抗高糖诱导的损伤作用。而在p53基因缺陷的糖尿病小鼠体内,EPCs衰老凋亡现象减弱,成管功能正常[23]。同时研究表明,过氧化物酶体增殖物激活受体α基因剔除的小鼠其EPCs动员与成管功能得到改善[24]。这为糖尿病患者血管病变的基因治疗提供了基础。
3.5细胞治疗 目前研究指出,全身或局部注射EPCs可以降低糖尿病患者的器官损害、改善血管功能[25]。Matoba等[26]将骨髓来源的CD34+的EPCs注入到有外周血管病变患者体内,发现细胞治疗能够长期改善患者缺血组织的血管形成。同时近期有报道指出对急性心肌梗死患者进行骨髓来源单个核细胞移植治疗后,梗死部位的解剖结构得到显著改善,经过长达18个月随访观察发现,与常规治疗相比,细胞治疗能够给心肌梗死患者尤其是急性心梗患者带来更好的预后[27]。但有学者担忧由于糖尿病患者体内EPCs信号通路存在异常,会对移植到体内的EPCs功能发挥产生影响[27]。同时EPCs具有免疫源性,将异源健康个体的EPCs移植到糖尿病患者体内后,可能需要应用免疫抑制药物,这会对人体产生较大影响[27]。因此,虽然细胞疗法为糖尿病血管并发症的治疗带来新的希望,但是其临床疗效仍有待更进一步评价。
4 结 语
糖尿病患者存在EPCs数量和功能受损,由于糖尿病患者体内持续高糖导致糖尿病患者机体长期处于氧化应激和炎症反应状态,干扰内皮修复过程,从而导致心血管并发症的发生。因此,在深入研究糖尿病患者EPCs损伤的基础上,寻找有效改善EPCs功能的治疗方法,阻断EPCs损伤的信号通路,提高EPCs的存活能力,使EPCs在氧化应激或炎症状态下存活,对于预防或治疗糖尿病心血管并发症有重要的临床意义。
[1] Tousoulis D,Kampoli AM,Stefanadis C.Diabetes mellitus and vascular endothelial dysfunction:current perspectives[J].Current Vascular Pharmacology,2012,10(1):19-32.
[2] Tabit CE,Chung WB,Hamburg NM,etal.Endothelial dysfunction in diabetes mellitus:molecular mechanisms and clinical implications[J].Rev Endocr Metab Disord,2010,11(1):61-74.
[3] Gallagher KA,Liu ZJ,Xiao M,etal.Diabetic impairments in no-mediated endothelial progenitor cell mobilization and homing are reversed by hyperoxia and SDF-1 alpha[J].Clin Invest,2007,117(5):1249-1259.
[4] Asahara T,Masuda H,Takahashi T,etal.Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization[J].Circ Res,1999,85(3):221-228.
[5] Shen L,Gao Y,Qian J,etal.A novel mechanism for endothelial progenitor cells homing:The SDF-1/CXCR4-Rac pathway may regulate endothelial progenitor cells homing through cellular polarization[J].Med Hypotheses,2011,76(2):256-258.
[6] Hamed S,Brenner B,Roguin A.Nitric oxide:a key factor behind the dysfunctionality of endothelial progenitor cells in diabetes mellitus type-2[J].Cardiovasc Res,2011,91(1):9-15.
[7] Fadini GP,Avogaro A.Potential manipulation of endothelial progenitor cells in diabetes and its complications[J].Diabetes Obes Metab,2010,12(7):570-583.
[8] Ohshima M,Li TS,Kubo M,etal.Antioxidant therapy attenuates diabetes-related impairment of bone marrow stem cells[J].Circ J,2009,73(1):162-166.
[9] Hamed S,Brenner B,Aharon A,etal.Nitric oxide and superoxide dismutase modulate endothelial progenitor cell function in type 2 diabetes mellitus[J].Cardiovasc Diabetol,2009,8:56.
[10] Bauersachs J,Schafer A.Tetrahydrobiopterin and eNOS dimer/monomer ratio--a clue to eNOS uncoupling in diabetes?[J].Cardiovasc Res,2005,65(4):768-769.
[11] Sorrentino SA,Bahlmann FH,Besler C,etal.Oxidant stress impairs in vivo reendothelialization capacity of endothelial progenitor cells from patients with type 2 diabetes mellitus:restoration by the peroxisome proliferator-activated receptor-gamma agonist rosiglitazone[J].Circulation,2007,116(2):163-173.
[12] Hamed S,Brenner B,Abassi Z,etal.Hyperglycemia and oxidized-LDL exert a eleterious effect on endothelial progenitor cell migration in type 2 diabetes mellitus[J].Thromb Res,2010,126(3):166-174.
[13] Tousoulis D,Andreou I,Antoniades C,etal.Role of inflammation and oxidative stress in endothelial progenitor cell function and mobilization:Therapeutic implications for cardiovascular diseases[J].Atherosclerosis,2008,201(2):236-247.
[14] Shintani S,Murohara T,Ikeda H,etal.Mobilization of endothelial progenitor cells in patients with acute myocardial infarction[J].Circulation,2001,103(23):2776-2779.
[15] Desouza CV,Hamel FG,Bidasee K,etal.Role of inflammation and insulin resistance in endothelial progenitor cell dysfunction[J].Diabetes,2011,60(4):1286-1294.
[16] Sun Y,Chen SC,Song GY,etal.Effect of visfatin on the function of endothelial progenitor cells in high-fat-fed obese rats and investigation of its mechanism of action[J].Int J Mol Med,2012,30(3):622-628.
[17] Chen LL,Yu F,Zeng TS,etal.Effects of gliclazide on endothelial function in patients with newly diagnosed type 2 diabetes[J].Eur J Pharmacol,2011,659(2/3):296-301.
[18] Matsubara J,Sugiyama S,Akiyama E,etal.Dipeptidylpeptidase-4 inhibitor,sitagliptin,improves endothelial dys-function in association with its anti-inlammatory efects in patients with coronary artery disease and uncontrolled diabetes[J].Circ J,2013,77(5):1337-1344.
[19] Matsuura K,Hagiwara N.The pleiotropic effects of ARB in vascular endothelial progenitor cells[J].Curr Vasc Pharmacol,2011,9(2):153-157.
[20] Honda A,Matsuura K,Fukushima N,etal.Telmisartan induces proliferation of human endothelial progenitor cells via PPARgamma-dependent PI3K/Akt pathway[J].Atherosclerosis,2009,205(2):376-384.
[21] Liu Y,Wei J,Hu S,etal.Beneficial effects of statins on endothelial progenitor cells[J].Am J Med Sci,2012,344(3):220-226.
[22] Di Stefano V,Cencioni C,Zaccagnini G,etal.P66ShcA modulates oxidative stress and survival of endothelial progenitor cells in response to high glucose[J].Cardiovasc Res,2009,82(3):421-429.
[23] Rosso A,Balsamo A,Gambino R,etal.p53 mediates the accelerated onset of senescence of endothelial progenitor cells in diabetes[J].J Biol Chem,2006,281(7):4339-4347.
[24] Benameur T,Tual-Chalot S,Andriantsitohaina R,etal.PPAR alpha is essential for microparticle-induced differentiation of mouse bone marrow-derived endothelial progenitor cells and angiogenesis[J].PLoS One,2010,5(8):e12392.
[25] Gili M,Orsello A,Gallo S,etal.Diabetes-associated macrovascular complications:cell-based therapy a new tool[J].Endocrine,2013,44(3):557-575.
[26] Matoba S,Tatsumi T,Murohara T,etal.Long-term clinical outcome after intramuscular implantation of bone marrow mononuclear cells (Therapeutic Angiogenesis by Cell Transplantation [TACT]trial) in patients with chronic limb ischemia[J].Am Heart J,2008,156(5):1010-1018.
[27] Yamaguchi T,Kanayasu-Toyoda T,Uchida E.Angiogenic cell therapy for severe ischemic diseases[J].Biol Pharm Bull,2013,36(2):176-181.
