不同碳氮源对苹果树腐烂病菌胞外果胶酶活性的影响
2014-03-26何媛媛王海英黄丽丽
何媛媛,于 哲,王海英,黄丽丽,王 惠
(西北农林科技大学 a 理学院,b 旱区作物逆境生物学国家重点实验室,c 植物保护学院,陕西 杨凌 712100)
1 材料与方法
1.1 材 料
供试菌种:苹果树腐烂病菌(Valsamalivar.mali)野生型菌株03-8、致病力增强突变体X907(由03-8经农杆菌介导转化获得)、致病力丧失突变体T1(由03-8经PEG介导转化获得),均由西北农林科技大学植物病害综合治理实验室提供。
试剂:果胶(Pectin)、D-半乳糖醛酸为Sigma公司提供的分析纯试剂;葡萄糖、麦芽糖、根皮苷、果胶、可溶性淀粉、硫酸铵、牛肉膏、蛋白胨、酵母膏、L-天门冬酰胺、KH2PO4、MgSO4·7H2O、ZnSO4·7H2O、Fe(NO3)3·H2O、MnSO4·5H2O、生物素(VH)、VB1、NaOH、C4H4KNaO6·4H2O、无水亚硫酸钠、3,5-二硝基水杨酸(DNS),均为国产分析纯试剂。
Spectrum 756PC紫外分光光度计,由上海光谱仪器有限公司生产。
1.2 试剂的配制
DNS试剂 (3 g/L):称取3.0 g 3,5-二硝基水杨酸,溶解于500 mL蒸馏水中,再逐步加入10.4 g NaOH、90.0 g C4H4KNaO6·4H2O、2.5 g苯酚和2.5 g无水亚硫酸钠,温水浴(不超过48 ℃)中不断搅拌,直至溶液清澈透明。冷却后用蒸馏水定容至1 000 mL,保存于棕色瓶中。
pH 4.8柠檬酸缓冲液:取0.2 mol/L的Na2HPO4-2H2O溶液493 mL,加入0.1 mol/L柠檬酸溶液507 mL,即得1 000 mL的pH 4.8柠檬酸缓冲液。
果胶底物(5 g/L):称取0.5 g果胶,用pH 4.8柠檬酸缓冲液溶解,充分搅拌后,用缓冲液定容至100 mL,置于2~5 ℃冰箱内冷藏。
基础培养基(MS液体培养基)参考Okuno等[11]的方法配制。每1 000 mL培养基含可溶性淀粉10 g,L-天门冬酰胺2 g,KH2PO41 g,MgSO4·7H2O 0.5 g,ZnSO4·7H2O 0.88 g,Fe(NO3)3·H2O 1.5 mg,MnSO4·5H2O 0.44 mg,生物素(VH)5 μg,VB10.1 mg。
1.3 方 法
1.3.1 不同致病力的苹果树腐烂病菌胞外果胶酶活性的测定 将菌株03-8、X907和T1分别在PDA平板培养基上于25 ℃黑暗培养3 d,用打孔器取直径7 mm的菌饼7块,放入200 mL基础培养基中,25 ℃自然光照下静置培养,每天人工振摇2次,设3个重复。分别在5,10,15和20 d于无菌条件下取5 mL培养液,4 ℃、12 000 r/min离心5 min,取上清液即为粗酶液。用粗酶液进行果胶酶活性测定,探讨3种菌株致病力与胞外果胶酶活性的关系。
通过物理斜面模型与岩质边坡受力分析,发现高中物理模型受力分析与岩质边坡受力特征非常相似;尤其是边坡滑动时,物理斜面模型与岩质边坡受力特征一致,斜面摩擦力与岩质边坡下滑粘结力计算方法一致,所以岩质边坡受力特征可以用物理斜面模型代替;
1.3.2 不同碳源培养基中菌株03-8胞外果胶酶活性的测定 03-8菌株的培养、菌饼的采取及培养后菌液的采集和处理同1.3.1节,试验所用培养基为以葡萄糖、麦芽糖、根皮苷、果胶、可溶性淀粉为碳源的基础培养基(氮源为L-天门冬酰胺)。探讨不同碳源对胞外果胶酶活性的影响。
1.3.3 不同氮源培养基中菌株03-8胞外果胶酶活性的测定 03-8菌株的培养、菌饼的采取及培养后菌液的采集和处理同1.3.1节,试验所用培养基为以硫酸铵、牛肉膏、蛋白胨、酵母膏、L-天门冬酰胺为氮源的基础培养基(以可溶性淀粉为碳源)。探讨不同氮源与胞外果胶酶活性的关系。
1.3.4 果胶酶活性的测定 (1)D-半乳糖醛酸标准曲线的制作。果胶酶活性的测定参考文献[12]的方法。首先配制 2 mg/mL 的D-半乳糖醛酸标准溶液100 mL,分别取标准溶液0,0.2,0.4,0.6,0.8,1.0 mL于10 mL具塞试管中,用蒸馏水补足到1 mL,然后再分别加入0.5 mL pH 4.8的柠檬酸缓冲液,再分别加入3.0 mL DNS试剂,沸水浴中反应5 min,用流动水冷却至室温,用蒸馏水定容到10 mL。以D-半乳糖醛酸含量为0的试管为对照,测定其余各管在 540 nm波长下的吸光值(A540)。以A540为纵坐标,D-半乳糖醛酸含量为横坐标,绘制标准曲线。
(2)果胶酶活性的测定。取1 mL粗酶液于试管中,在50 ℃水浴中平衡5 min,加入预平衡至50 ℃的果胶底物0.5 mL,50 ℃保温30 min,加入3.0 mL DNS终止反应后,沸水浴5 min,用流动水冷却至室温,最后加蒸馏水定容到10 mL,测定A540,以煮沸10 min灭活的粗酶液为对照。根据建立的标准曲线计算D-半乳糖醛酸含量。酶活力单位(U):1 mL酶在50 ℃、pH 4.8的条件下,1 h分解果胶产生1 mg D-半乳糖醛酸为一个酶活力单位。
2 结果与分析
2.1 D-半乳糖醛酸标准曲线的建立
D-半乳糖醛酸标准曲线见图1,求得的回归方程为:y=0.642x-0.037,R2=0.997。
2.2 不同致病力苹果树腐烂病菌胞外果胶酶活性的比较
3种苹果树腐烂病菌所产胞外果胶酶活性如图2所示。

图1 D-半乳糖醛酸标准曲线
由图2可以看出,3种苹果树腐烂病菌在不同发酵时间产生的胞外果胶酶活性明显不同,但均在第10天达到最高。其中致病力增强的突变体X907发酵液中果胶酶活性,在任何时段均高于其他菌株,尤其在5~10 d内果胶酶活性急剧增强。比较发酵第10天培养滤液中果胶酶的活性发现,03-8产生的果胶酶活性(1.436 U)明显低于X907(2.482 U),但高于致病力丧失突变体T1(1.165 U),X907产生的酶活性是T1产生酶活的2.13倍。由此可以推测,苹果树腐烂病菌在发酵10 d时滤液中产生的胞外果胶酶活性与其致病力呈正相关关系。进一步推测,苹果树腐烂病菌分泌的胞外果胶酶可能是其致病力的重要因素。
2.3 不同碳源对菌株03-8产生的胞外果胶酶活性的影响
由图3可以看出,在以葡萄糖、麦芽糖、根皮苷、果胶、可溶性淀粉为碳源时,培养滤液中03-8产生的胞外果胶酶活性均在第10天达最高值。就发酵第10天的胞外果胶酶活性而言,果胶、可溶性淀粉为最佳碳源,以葡萄糖、麦芽糖、根皮苷为碳源的培养基发酵产生的胞外果胶酶活性均低于以果胶和可溶性淀粉为碳源的培养基。表明复杂碳源(多糖)比简单碳源(双糖或单糖)更易于产酶。由于以果胶和可溶性淀粉为碳源时,胞外果胶酶活性没有显著性差异,从经济性考虑,宜选廉价易得的可溶性淀粉为碳源。
在以不同含量可溶性淀粉为碳源的培养基中培养03-8菌株,在第10天取样检测其胞外果胶酶活性,结果见图4。由图4可以看出,可溶性淀粉含量为0.50%时胞外果胶酶活性最高。
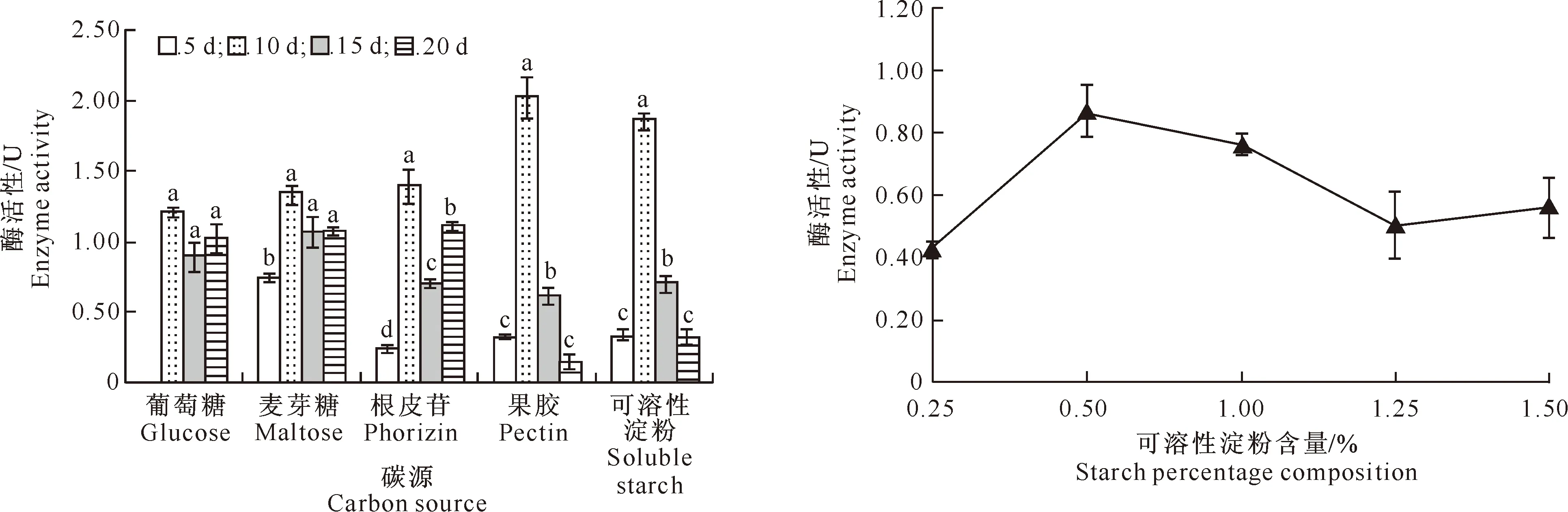
图3 不同碳源对苹果树腐烂病菌03-8株产生胞外果胶酶活性的影响
2.4 不同氮源对菌株03-8产生的胞外果胶酶活性的影响
由图5可以看出,以蛋白胨为氮源时,整个培养过程中果胶酶的活性明显高于其他氮源,其中以第10天果胶酶活性最高;以天门冬酰胺和牛肉膏为氮源时果胶酶活性仍以第10天最高;以酵母膏为氮源时,果胶酶活性与上述3种氮源变化趋势不同,其在第20天时酶活性最高;以硫酸铵为氮源时,在整个培养过程中胞外果胶酶的活性变化不明显。因此确定蛋白胨为最佳氮源。
以不同含量蛋白胨为氮源培养03-8菌株,在第10天对胞外果胶酶活性进行检测,结果见图6。由图6可以看出,蛋白胨含量为0.25%时果胶酶活性最高。
综合以上结果可以看出,以0.50%的可溶性淀粉为碳源,0.25%蛋白胨为氮源培养03-8菌株,第10天培养滤液中果胶酶活性最高。
3 讨 论
3.1 苹果腐烂病菌发酵产生的胞外果胶酶与其致病力的关系
本试验以3种不同致病力的苹果树腐烂病菌03-8、X907和T1为材料,在相同的MS培养基中培养发现,致病力与发酵第10天发酵液中胞外果胶酶的活性呈正相关。臧睿[4]发现,果胶酶与苹果树腐烂病的病疤扩展有关;韦洁玲等[13]研究发现,将苹果腐烂病菌接入烫伤苹果枝条10 d后,树条发病明显。结合本试验结果分析可初步确定,苹果腐烂病菌的致病过程与果胶酶的产生有直接关系。进一步推测,苹果树腐烂病菌的致病过程可能为在侵入的过程中产生果胶酶,待果胶酶活性达到最高时(10 d左右),对寄主产生明显损伤(降解果胶),寄主表现出明显病斑。

图5 不同氮源对苹果树腐烂病菌03-8株产生的胞外果胶酶活性的影响
3.2 碳源对苹果树腐烂病菌产生的胞外果胶酶活性的影响
本研究发现,以可溶性淀粉和果胶为碳源,苹果树腐烂病菌产生的果胶酶的活性高于以单糖或双糖为碳源时的酶活,分析认为,苹果树腐烂病菌对多糖碳源的利用不是先水解后利用。Maldonada等[14]研究发现,葡萄糖能够抑制黑曲霉果胶酶的产生,本研究中将MS培养基的淀粉碳源换为葡萄糖时,产生的果胶酶活性下降,表明葡萄糖对苹果树腐烂病菌产胞外果胶酶也有一定的抑制作用。关于该菌对多糖碳源的利用机制还有待进一步研究。
3.3 氮源对苹果树腐烂病菌产生的胞外果胶酶活性的影响
本试验发现,苹果腐烂病菌产生胞外果胶酶活性受碳源影响相对较小,而受氮源影响相对较大。试验中不同氮源在第10天时产生胞外果胶酶活性在0.48~2.06 U,比碳源改变时的酶活变化(1.08~2.02 U)幅度大。利用硫酸铵(无机氮源)作氮源时,发酵过程中胞外果胶酶的活性几乎没有变化,利用蛋白胨(有机氮源)作氮源时,发酵液酶活在第5~10天急剧增加,第10天其活性是以硫酸铵为氮源时的4.29倍。Baract-pereira[15]研究发现,酵母膏对青霉产果胶酶有促进作用,但酵母膏等有机氮源对黑盘菌产酶无影响,而无机氮中的硫酸铵和磷酸氢铵却对黑盘菌产酶有促进作用。由此推测,不同菌对氮源的利用途径可能不同,故在苹果树生长期间氮肥的使用需要谨慎。
[参考文献]
[1] Wang X L,Wei J L,Huang L L,et al.Re-evaluation of pathogens causingValsacanker on apple in China [J].Mycologia,2011,103(2):317-324.
[2] 刘福昌,李美娜,王永全.苹果树腐烂病菌的致病因素: 果胶酶的初步探讨 [J].中国果树,1980(4):45-48.
Liu F C,Li M N,Wang Y Q.Apple tree canker’s pathogenic factors:Preliminary discuss to pectinase [J].China Fruits,1980(4):45-48.(in Chinese)
[3] 王 娟,马 强,庄 霞,等.苹果树腐烂病原菌分泌物中果胶酶的测定 [J].内蒙古农业科技,2009(4):39-40.
Wang J,Ma Q,Zhuang X,et al.Determination of pectinase in fungi secretion of apple tree canker [J].Inner Mongolia Agricultural Science and Technology,2009(4):39-40.(in Chinese)
[4] 臧 睿.陕西省苹果树腐烂病菌不同分离株生物学特性及致病性研究 [D].陕西杨凌.西北农林科技大学,2006.
Zang R.Study on biological characters and pathogenicity of different isolates of cytospora isolated from apple tree [D].Yangling,Shaanxi:Northwest A&F University,2006.(in Chinese)
[5] Ke X W,Huang L L,Han Q M,et al.Histological and cytological investigations of the infection and colonization of apple bark byValsamalivar.mali[J].Australasian Plant Pathol,2013,42:85-93.
[6] Oeser B,Heidrich P M,Muller U,et al.Polygalacturonase is a pathogenicity factor in theClavicepspurpurelryeainteraction [J].Fungal Genetics and Biology,2002,36:176-186.
[7] Claudia M,Giuliano D,Giulia D,et al.Isolation,heterologous expression and characterization of an endo-polygalacturonase produced by the phytopathogenBurkholderiacepacia[J].Protein Expression and Purification,2007,54(2):300-308.
[8] Temple B,Bernier L,Hintz W E.Characterisation of the polygalacturonase gene of theDutchelmdisease pathogenOphiostomanovo-ulmi[J].New Zealand Journal of Forestry Science,2009,39:29-37.
[9] Carneiro J S,de la Bastide P Y,Chabot M,et al.Suppression of polygalacturonase gene expression in the phytopathogenic fungusOphiostomanovo-ulmi by RNA interference [J].Fungal Genetics and Biology,2010,47(5):399-405.
[10] Yamazaki Y,Tojo M,Hoshino T,et al.Characterization of Trichoderma polysporum from Spitsbergen,Svalbardarchipelago,Norway,with species identity,pathogenicity to moss,and polygalacturonase activity [J].Fungal Ecology,2011,4(1):15-21.
[11] Okuno T,Oikawa S,Goro T,et al.Structures and phytotoxicity of metabolites fromValsaceratosperma[J].Agricultural and Biological Chemistry,1986,50(4):997-1001.
[12] 王晓敏,吴文龙,闾连飞,等.分光光度计法测定果胶酶活力的方法研究 [J].食品工业科技,2007(5):227-229.
Wang X M,Wu W L,Lü L F,et al.Iinvestigated pectinase activity analysis by spectrophotometry [J].Science and Technology of Food Industry,2007(5): 227-229.(in Chinese)
[13] 韦洁玲,黄丽丽,郜佐鹏,等.苹果树腐烂病室内快速评价方法的研究 [J].植物病理学,2010,40(1):14-20.
Wei J L,Huang L L,Gao Z P,et al Laboratory evaluation methods of appleValsacanker disease caused byValsaceratospermasensukobayashi [J].Acta Phytopathologica Sinica,2010,40(1):14-20.(in Chinese)
[14] Maldonado M C,Saad M S,Danley C.Catabolite repression of the synthesis of inducible polygalacturonase and pectinesterase byAspergillusnigersp [J].Current Microbiology,1989,18(5):303-306.
[15] Baract-pereira.Production of pectinlyase byPenicilliumgris-eoroseumculture on sucrise and yeast extract for degumming of natural fibres [J].Lett Appl Microbiol,1994,18(3):127-129.
