葡萄风信子MaMYB1基因的克隆及表达分析
2014-03-27刘雅莉焦淑珍权永辉
姜 玲,刘雅莉,娄 倩,焦淑珍,权永辉
(西北农林科技大学 a旱区作物逆境生物学国家重点实验室,b林学院,c园艺学院,陕西 杨凌 712100)
葡萄风信子(Muscaribotryoides)是天门冬科葡萄风信子属的一种多年生草本观花地被植物,其因开较为稀少的蓝紫色花而深受人们喜爱。植物的花色是多种因子共同作用的结果,但绝大多数植物的花色是由细胞中的特定花色素而决定。花色素的合成主要受2类基因的调控,一类是结构基因,负责编码花色素生物合成的催化酶;另一类是调节基因,其编码的转录因子可应答外界刺激,调控基因时空表达[1]。在调控色素合成的因子中,以对MYB转录因子的研究最为广泛,目前报道的几乎所有的花色素合成途径都受到MYB转录因子的调控[2]。
MYB转录因子是植物中最大的转录因子家族之一,它广泛参与植物色素合成、细胞分化与发育、信号转导以及抗逆抗病等次生代谢过程的调控[3]。根据DNA结合功能域中不完全重复序列数目的不同,MYB转录因子可分为3个亚族(1R、2R和3R)[3-4]:有1个重复的MYB类似蛋白被称为MYB1R,有2个重复的为R2R3-MYB,有3个重复的为MYB3R[2]。在MYB转录因子中,R2R3-MYB转录因子在植物的调控中起着重要的作用。自Paz-Ares等[5]从植物中分离到第1个MYB转录因子以来,大量 MYB 类因子被分离和鉴定[6]。近年来,科研人员在苹果[7-8]、龙胆[9]、百合[10]等植物中也克隆和鉴定出色素合成相关的R2R3-MYB转录因子,而关于葡萄风信子色素合成的调节基因及其功能的研究还未见报道。本研究从葡萄风信子中克隆出1个MYB转录因子基因,并对其进行生物信息学和表达模式分析,以期为明确该基因在葡萄风信子花发育过程中的调控作用奠定基础。
1 材料与方法
1.1 材料与试剂
以开蓝色花的葡萄风信子品种‘亚美尼亚’(Muscariarmeniacum)为试验材料,试验种球采自西安植物园,种植于西北农林科技大学人工气候室。将葡萄风信子花发育过程分为4个时期(S1.未着色,S2.开始着色,S3.完全着色未开放,S4.完全着色开放),并分别采集这4个时期的花及根、茎、叶组织,用液氮冷冻处理后,于-80 ℃冰箱中保存备用。
PrimeScript RT reagent kit 试剂盒、SMARTerTMRACE cDNA扩增试剂盒、实时定量PCR试剂盒SYBR Premix ExTaqTMⅡ和克隆载体pMD19-T vector均购于大连TaKaRa公司;RNA快速提取试剂盒购于北京百泰克公司;DNA回收试剂盒购于TIANGEN公司;Matchmaker System 3酵母杂交试剂盒购于Clontech公司。PCR扩增引物的合成与扩增产物序列测定由北京奥科生物技术有限公司完成。
1.2 方 法
1.2.1 植物各组织总RNA的提取 根据RNA快速提取试剂盒说明书提取葡萄风信子不同组织的RNA,用1%琼脂糖凝胶电泳检测其质量,于-80 ℃冰箱中保存,以备后期RACE扩增和实时定量分析用。
1.2.2 葡萄风信子MYB基因全长序列的克隆 前期,本课题组对葡萄风信子转录组进行了测序,目的是通过筛选获得与葡萄风信子花发育相关的转录因子基因。根据转录组测序结果,将筛选出的葡萄风信子MYB基因暂命名为MaMYB1。为了获得MaMYB1基因全长,用该基因的已知序列(转录组测序获得)设计特异性引物(表1),参考SMARTerTMRACE cDNA扩增试剂盒说明书,准备3′-RACE-Ready cDNA和5′-RACE-Ready cDNA进行PCR反应。3′RACE的反应体系为25 μL,其中PCR-Grade water 17.25 μL,10×Advantage 2 PCR Buffer 2.5 μL,dNTP Mix 0.5 μL,50×Advantage 2 Polymerase Mix 0.5 μL,将其混合液涡旋混匀,瞬时离心;在混合液中加入3′-RACE-Ready cDNA 1.25 μL,GSP引物(MaMYB1-3′RACE) 0.5 μL以及UPM引物2.5 μL。5′ RACE末端的扩增体系同3′ RACE端扩增体系,模板为5′-RACE-Ready cDNA,GSP引物为MaMYB1-5′ RACE。5′ RACE和3′ RACE扩增程序均为94 ℃变性30 s,67 ℃ 退火30 s,72 ℃ 延伸2 min,25个循环。对3′ RACE和5′ RACE的扩增产物进行1%琼脂糖凝胶电泳后回收测序。用seqman软件将得到的序列与已知的EST序列(转录组测序获得)进行拼接,查找拼接后序列的开放读码框,在开放阅读框两端设计引物(MaMYB1-F-S和MaMYB1-F-A),PCR扩增MaMYB1基因cDNA的全长。PCR反应体系为:10×Buffer 2.5 μL,dNTP(2.5 mmol/L) 2 μL,MaMYB1-F-S 1 μL,MaMYB1-F-A 1 μL,Taq酶 0.25 μL,ddH2O 17.25 μL。扩增程序为:94 ℃ 3 min;94 ℃ 30 s,58 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃ 10 min。对扩增产物进行1%的琼脂糖凝胶电泳后回收测序。

表1 MaMYB1基因克隆及表达分析所用引物
1.2.3MaMYB1基因序列分析 用ORFfinder在线分析MaMYB1基因的开放阅读框,并推测该基因所编码的氨基酸序列,分析蛋白质分子质量大小及等电点;用Mega 5.0软件对其进行系统进化分析;利用DNAman软件对MaMYB1蛋白序列与已知的部分MYB蛋白序列进行比对分析。用Blastp(http://blast.ncbi.nlm.nih.gov/Blast.cgi)将推测的蛋白序列与NCBI上的同源序列进行比对。
1.2.4MaMYB1基因的转录激活活性分析 用带有酶切位点的引物pGBKT7-M-S和pGBKT7-M-A(表1)将MaMYB1克隆进pGBKT7载体中,构建pGBKT7-MaMYB1载体;同时扩增GAL4基因,克隆到pGBKT7载体中作阳性对照。将上述重组质粒和空载体PGBKT7转化酵母AH109感受态细胞,然后涂布于一缺培养基(SD/-Trp)上,30 ℃培养3 d。将于SD/-Trp培养基上生长的转化子划线接种于含有X-α-gal的三缺培养基(SD/-Trp-His-Ade)中,通过显色情况检测其转录激活活性。
1.2.5MaMYB1基因的表达特性分析 以葡萄风信子Actin基因为内参基因,设计其特异引物Actin-S和Actin-A(表1)。根据MaMYB1序列设计定量引物MaMYB1-RT-S 和MaMYB1-RT-A(表1)。参照PrimeScript RT reagent kit操作说明,将葡萄风信子‘亚美尼亚’的根、茎、叶以及不同发育时期(S1,S2,S3,S4)花的RNA反转录为cDNA,反应体系为:5×PrimeScript Buffer 4 μL,PrimeScript RT Enzyme 1 μL,Oligo dT Prime 1 μL,Random 6 mers 1 μL,加入1 000 ng 的RNA,然后加入Rnase Free dH2O至总体积为20 μL。反应条件为:37 ℃ 15 min,85 ℃ 5 s。以反转录后的cDNA为模板,参考SYBR Premix ExTaqTMⅡ操作说明,在BIO-RAD Cycler IQ5荧光定量PCR仪上进行实时荧光定量PCR。其反应体系为:SYBR Premix ExTaq10 μL,上、下游引物各0.8 μL,模板cDNA 1 μL,加水至总体积为20 μL。反应程序为94 ℃ 30 s;94 ℃ 15 s,58 ℃ 30 s,45个循环,每个反应重复3次。
2 结果与分析
2.1 MaMYB1全长序列的获得
3′ RACE结果在约 1 kb处有一条带(图1-A),而5′ RACE在约2 kb和500 bp各有一条带(图1-B),其中2 kb处的条带为非特异扩增产物。将1 kb和500 bp处的片段与原有的EST序列拼接在一起,获得一条长953 bp的序列,利用ORF finder软析分析其开放阅读框,根据开放阅读框两端序列设计引物,经PCR扩增获得一条长约750 bp的序列(图1-C)。
2.2 MaMYB1基因编码蛋白的生物信息学分析
利用ORFfinder软件对MaMYB1基因序列进行分析,发现其开放阅读框长750 bp,编码249个氨基酸,其蛋白分子质量约为27.7 ku,等电点为9.3。推测该基因编码的部分氨基酸序列如图2所示。MaMYB1与部分已知的R2R3-MYB蛋白氨基酸序列的比对结果(图2)表明,在该序列N端有2个典型的MYB结构域(R2和R3),该结构域与部分已报道的MYB转录因子结构域有很高的相似性,在R2结构域中,从推测的第17个氨基酸开始每隔19个氨基酸就有1个色氨酸残基;在R3结构域中,第1个色氨酸被苯丙氨酸取代,之后每隔18个氨基酸就有1个色氨酸残基;在此R3结构域内,还存在1个与BHLH蛋白结合的结构域[D/E]Lx2[R/K]x3Lx6Lx3R,而在与原花青素和花青素合成相关的MYB转录因子中该结构域是一常见特征[11-15]。因此可以推断克隆的转录因子为典型的R2R3-MYB转录因子。将序列提交NCBI Blastp 发现,其蛋白序列与可可树(Theobromacacao)MYB蛋白的相似性为63%,与苹果(Malusdomestica)和黄瓜(Cucumissativus)MYB蛋白的相似性均为64%。将MaMYB1与其他物种的MYB蛋白进行进化分析,结果(图3)表明,MaMYB1与玉米的ZmP1 以及拟南芥的MYB12关系较近。

图1 葡萄风信子MYB基因的RACE-PCR以及CDNA全长电泳结果

图2 MaMYB1蛋白部分序列与其他已知MYB序列的比对
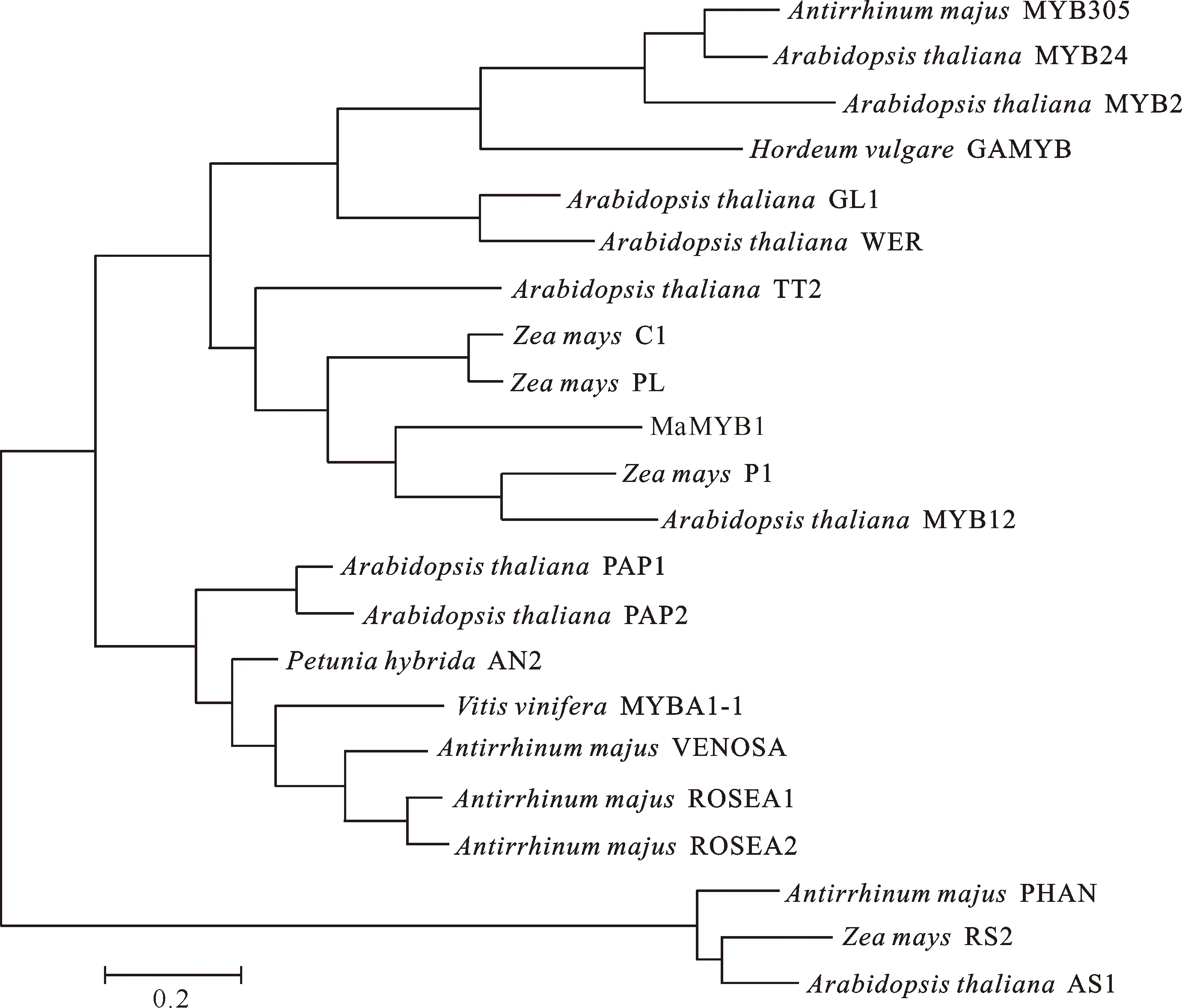
图3 MaMYB1与 其他MYB蛋白的系统分析
2.3 MaMYB1的转录激活活性分析
将筛选的转化子在一缺培养基和三缺培养基上培养,结果(图4)显示,阴性对照只能在一缺培养基(SD/-Trp)上生长,不能在三缺培养基(SD/-Trp-His-Ade)上生长,说明其无转录激活活性; 而pGBKT7-MaMYB1转化子同阳性对照在一缺和三缺培养基上都能生长,并能使转化子在X-α-gal存在的情况下显色变蓝。此结果证明,MaMYB1转录因子具有转录激活活性。
2.4 MaMYB1在葡萄风信子中的组织表达谱
利用实时定量PCR对MaMYB1在不同组织中的表达情况进行分析,结果(图5)表明,在葡萄风信子根、茎、叶以及花组织中都检测到MaMYB1的表达,其中以花中的表达量较高。MaMYB1的表达量随花发育过程的推进呈现先升高后降低的变化趋势,在刚开始着色(S2)表达量最高;从S1到S2期,MaMYB1的表达量显著增加,S2期表达量约是S1期表达量的9倍。可见MaMYB1在花组织中高表达,且在花的不同发育时期表达量差异显著,推测该基因可能在花中起调控作用。
3 讨 论
转录因子也称反式作用因子,是能够与基因启动子区域中的顺式作用元件发生特异性作用的DNA结合蛋白,它们之间以及与其他相关蛋白之间的相互作用可激活或抑制某些基因的转录[16]。其中R2R3-MYB型转录因子作为MYB蛋白最大的一类,主要参与植物花青苷的代谢调节[17]。

图4 MaMYB1的转录激活活性分析
本研究结果表明,MaMYB1基因与已知的R2R3-MYB有很高的同源性。此外,有报道指示,调节花色素生物合成的R2R3-MYB转录因子与BHLH转录因子密切相关[18-19],如玉米的ZmC1和BHLH[20],矮牵牛的AN2 MYB与AN1/JAF13 BHLHs[21],以及金鱼草的ROSEA1、 ROSEA2与VENOSA MYBs等[22]。这些MYB转录因子都需要与BHLH形成二聚体的形式来发挥其调节功能。而MaMYB1基因的R3结构域内也存在着1个与BHLH蛋白结合的结构域,由此可推断,MaMYB1在起调控功能的时候,可能需要与BHLH蛋白结合,才能更好地起到转录调节的作用,但该转录因子是否与花色素的合成调控有关,还有待进一步研究。
此外,学者们在对R2R3-MYB结构的研究中发现,在R2R3区域外存在1个与调节花色素相关的结构域KPRPR[S/T][F/L][2,23]。但是从单子叶植物中克隆到的R2R3-MYB转录因子,如文心兰的OgMYB1[24]、蝴蝶兰的PsUMYB6[25]以及玉米的ZmC1都未发现该结构域,表明在单子叶和双子叶植物中,与色素调节相关的MYB转录因子存在着一定的差异[26]。本研究结果显示,在MaMYB1氨基酸序列中未发现KPRPR[S/T]结构域。
调节类黄酮合成的R2R3-MYB转录因子有不同的亚族,如矮牵牛的AN2、拟南芥的PAP1、PAP2和TT2,它们在花、果实、种子和内果皮的花色素和原花色素的生物合成中起着重要作用。玉米的ZmC1、P1以及拟南芥的MYB11、MYB12 和MYB111基因有着相似的功能,它们与幼苗和内果皮的黄酮醇和鞣红物质的合成有关[9]。 本研究结果表明, MaMYB1与玉米P1 和拟南芥MYB12的关系较近,说明MaMYB1对类黄酮的合成可能有调节作用。
实时定量PCR分析结果表明,MaMYB1基因在花中的表达量高于其他组织,且在花发育过程中表达量有显著变化,因此可以推测,MaMYB1主要在花中发挥表达调控功能。
根据本研究结果,笔者推测MaMYB1基因可能在葡萄风信子的花中发挥调控功能,且有可能与类黄酮的合成相关。下一步的研究是构建该基因的表达载体,通过转化模式植物,进一步探究其在生物体中的调控功能。
[参考文献]
[1] 马春雷,姚明哲,王新超,等.茶树2个MYB转录因子基因的克隆与表达分析 [J].林业科学,2012,48(3):31-37.
Ma C L,Yao M Z,Wang X C,et al.Cloning and expression of two MYB transcription factors in tea plant (Camelliasinensis) [J].Scientia Silvae Sinicae,2012,48(3):31-37.(in Chinese)
[2] Stracke R,Werber M,Weisshaar B.The R2R3-MYB gene family inArabidopsisthaliana[J].Curr Opin Plant Biol,2001,4:447-456.
[3] Jin H,Martin C.Multifunctionality and diversity within the pl-antMYB-gene family [J].Plant Mol Biol,1999,41:577-585.
[4] Rosinski J A,Atchley W R.Molecular evolution of the Myb family of transcription factors:Evidence for polyphyletic origin [J].J Mol Evol,1998,46:74-83.
[5] Paz-Ares J,Ghosal D,Wienand U,et al.The regulatory c1 locus of encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators [J].EM-BO J,1987,6(12):3553-3558.
[6] Loguerico L L,Zhang J Q,Wilkins T A.Differential regulation of six novel MYB-domain genes defines two distinct expression patterns in allotetraploid cotton (GossypiumhirsutumL.) [J].Mol Gen Genet,1999,261(4/5):660-671.
[7] Ban Y,Honda C,Hatsuyama Y,et al.Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin [J].Plant and Cell Physiology,2007,48:958-970.
[8] Espley R V,Hellens R P,Putterill J,et al.Red colouration in apple fruit is due to the activity of the MYB transcription factor,MdMYB10 [J].The Plant Journal,2007,49:414-427.
[9] Nakatsuka T,Haruta K S,Pitaksutheepong C,et al.Identification and characterization of R2R3-MYB and bHLH transcription factors regulating anthocyanin biosynthesis in gentian flowers [J].Plant and Cell Physiology,2008,49:1818-1829.
[10] Yamagishi M,Shimoyamada Y,Nakatsuka T,et al.Two R2R3-MYB genes,homologs of petunia AN2,regulate anthocyanin biosyntheses in flower tepals,tepal spots and leaves of asiatic hybrid Lily [J].Plant and Cell Physiology,2010,51:463-474.
[11] Grotewold E,Sainz M B,Tagliani L,et al.Identiflcation of the residues in the Myb domain of maize C1 that specify the interaction with the bHLH cofactor R [J].Proc Natl Acad Sci USA,2000,97:13579-13584.
[12] Baudry A,Heim M A,Dubreucq B,et al.TT2,TT8,and TTG1 synergistically specify the expression of BANYULS and proanthocyanidin biosynthesis inArabidopsisthaliana[J].Plant J,2004,39:366-380.
[13] Zimmermann I M,Heim M A,Weisshaar B,et al.Comprehensive identiflcation ofArabidopsisthalianaMYB transcription factors interacting with R/B-like bHLH proteins [J].Plant J,2004,40:22-34.
[14] Dubos C,Stracke R,Grotewold E,et al.MYB transcription factors inArabidopsis[J].Trends Plant Sci,2010,15:573-581.
[15] Hichri I,Barrieu F,Bogs J,et al.Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway [J].J Exp Bot,2011,62:2465-2483.
[16] 张椿雨,龙 艳,冯 吉,等.植物基因在转录水平上的调控及其生物学意义 [J].遗传,2007,29(7):793-799.
Zhang C Y,Long Y,Feng J,et al.Transcriptional regulation of plant genes and its significance in biology [J].Heredites(Beijing),2007,29(7):793-799.(in Chinese)
[17] 许志茹,李春雷,崔国新,等.植物花青素合成中的MYB蛋白 [J].植物生理学通讯,2008,44(3):597-604.
Xu Z R,Li C L,Cui G X,et al.MYB protein of anthocyanin biosynthesis in plant [J].Plant Physiology Communications,2008,44(3):597-604.(in Chinese)
[18] Mol J J,Schafer E,Weiss D.Signal perception,transduction,and gene expression involved in anthocyanin bio-synthesis [J].Crit Rev Plant Sci,1996,15:525-557.
[19] Winkel-Shirley B.Flavonoid biosynthesis:A colourful model for genetics,biochemistry,cell biology,and biotechnology [J].Plant Physiol,2001,126:485-493.
[20] Goff S A,Cone K C,Chandler V L.Functional analysis of the transcriptional activator encoded by the maize B gene:Evidence for a direct functional interaction between two classes of regulatory proteins [J].Genes Dev,1992,6:864-875.
[21] Goodrich J,Carpenter R,Coen E S.A common gene regulates pigmentation pattern in diverse plant species [J].Cell,1992,68:955-964.
[22] Mol J,Grotewold E,Koes R.How genes paint flowers and seeds [J].Trends Plant Sci,1998,3:212-217.
[23] Peel G J,Pang Y,Modolo L V,et al.The LAP1 MYB transcription factor orchestrates anthocyanidin biosynthesis and glycosylation in Medicago [J].Plant J,2009,59:136-149.
[24] Chiou C Y,Yeh K W.Differential expression of MYB gene (OgMYB1) determines color patterning in floral tissue of Oncidium Gower Ramsey [J].Plant Mol Biol,2008,66:379-388.
[25] Ma H,Pooler M,Griesbach R.Anthocyanin regulatory/structural gene expression in Phalaenopsis [J].J Am Soc Hortic Sci,2009,134:88-96.
[26] Albert N W,Arathoon S,Collette V E,et al.Activation of anthocyanin synthesis inCymbidiumorchids:Variability between known regulators [J].Plant Cell,Tissue and Organ Culture,2009,100:355-360.
