苹果蠹蛾β-actin基因cDNA的克隆、序列分析及mRNA表达稳定性检测
2014-03-27杨雪清张雅林
杨雪清,张雅林
(1 西北农林科技大学 植保资源利用与病虫害防治教育部重点实验室,陕西 杨凌712100;2 沈阳农业大学 植物保护学院,辽宁 沈阳 110866)
苹果蠹蛾(Cydiapomonella(L.))是对全世界温带地区的苹果(MalusdomeaticaBorkhausern (Rosaceae))和梨(PyruscommunisL. (Rosaceae))危害最严重的害虫之一[1-5],也是我国重要的检疫性入侵生物。苹果蠹蛾幼虫蛀食果肉和果心,并取食种子,严重时蛀果率可达80%以上。同时,它将黑褐色的虫粪沿着蛀道排出至果子表皮,影响果品品质,严重时造成落果,对果品产业造成巨大损失[6-7]。
目前,国内外对苹果蠹蛾的防治仍主要采用化学药剂,伴随而来的是十分严重的抗药性问题[1-5]。国内外对苹果蠹蛾的研究主要集中在杀虫剂的田间、室内毒力以及对解毒酶活性的影响等方面[1-5],而有关杀虫剂对苹果蠹蛾解毒酶基因mRNA表达水平影响的研究甚少,对于内参基因的选择更是无明确的标准。激动蛋白(actin) 是真核细胞中最丰富的蛋白质,β-actin因其稳定表达的特点,在分子生物学研究中常被作为内参基因。然而,近年来的许多研究表明,目前使用较多的内参基因均存在不稳定性,在生物体不同发育阶段、体外不同处理条件下,其表达量变化较大[8-10]。本研究以苹果蠹蛾为试虫,通过RT-PCR及RACE技术克隆得到β-actin基因的cDNA全长,并采用实时定量PCR和半定量PCR方法,对苹果蠹蛾不同发育阶段以及杀虫剂处理后β-actin基因mRNA的表达情况进行了探讨,以明确β-actin基因是否可以作为内参基因应用于苹果蠹蛾抗药性分子机制的研究中。
1 材料与方法
1.1 材 料
1.1.1 试 虫 苹果蠹蛾幼虫采自新疆喀什疏勒县(东经76.05°,北纬 39.24°)苹果园,在新疆塔里木大学农业部阿拉尔作物有害生物科学观测试验站室内以人工饲料饲养至第5代,饲养温度为(25±1) ℃,相对湿度为(40±5)%,光周期为16 h光照/8 h黑暗。
1.1.2 药 剂 毒死蜱和高效氯氟氰菊酯标准品,购自阿拉丁试剂(Aladdin,上海)公司,将其分别溶于丙酮配制成200和1.56 mg/mL的母液,备用。
1.2 试虫处理
取苹果蠹蛾1~5龄幼虫、蛹、成虫(蛹和成虫区别雌雄)于液氮中迅速冷冻,-80 ℃保存备用;4龄幼虫饥饿10 h后,分别点滴1 μL 12.5 mg/mL毒死蜱和 0.195 mg/mL高效氯氟氰菊酯于前胸背部,并以相同方法点滴丙酮作为对照,放入人工饲料饲养,于处理后12,24,36,48,60 h分别取样,液氮冷冻,-80 ℃保存备用。
1.3 苹果蠹蛾总RNA的提取及cDNA第一链的合成
参照RNAiso Plus试剂盒(Takara,大连)说明,提取苹果蠹蛾总RNA,用凝胶电泳及多功能酶标仪M200 PRO(Switzerland,Tecan) 检测总RNA的纯度和浓度。按照反转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit (Fermentas,加拿大)的说明,将RNA反转录合成用于扩增β-actin基因保守区和全长的cDNA模板。
5′RACE和3′RACE模板分别按Clontech (Takara)公司SMARTTMRACE cDNA Amplification Kit反转录试剂盒说明书的操作步骤合成。 Real-Time PCR模板选用Takara公司的PrimeScript®RT reagent Kit with gDNA Eraser(perfect Real Time)试剂盒合成。
1.4 β-actin基因的克隆与测序
试验所用引物见表1,由上海桑尼生物科技有限公司合成。根据GenBank数据库中粘虫(Mythimnaseparate(Walker),登录号GQ856238.1)、粉纹夜蛾(Trichoplusiani,登录号JF303662.1)、烟草天蛾(Manducasexta,登录号AJ519536.1) 和家蚕(Bombyxmori,登录号NM00112625.4)等物种的β-actin氨基酸序列,利用在线工具CODEHOP[11]设计1对兼并引物CpActinS和CpActinAS(表1),用于扩增β-actin基因保守区。PCR 反应在C100 型PCR仪 (Bio-rad,美国)上进行,反应体系为25 μL: 2×TaqMasterMix(康为世纪,北京)12.5 μL、上下游引物(10 μmol/L)各1 μL、cDNA模板2 μL、ddH2O 8.5 μL。PCR反应条件为:94 ℃预变性3 min;然后94 ℃ 变性50 s,55 ℃退火50 s,72℃延伸1 min,循环35次;最后72℃ 延伸7 min。将PCR扩增产物在1% 琼脂糖凝胶电泳中分离,回收约1 000 bp的单一条带,TA克隆至pMD 19-T 载体(Takara),转化大肠杆菌DH5α,涂布于含100 μg/mL氨苄青霉素的LB平板上筛选,挑取阳性克隆送至上海桑尼生物科技有限公司测序。
根据苹果蠹蛾β-actin基因保守区序列,分别设计特异性3′ RACE 引物(CpActin3F1和CpActin3F2)及5′ RACE引物(CpActin5R1和CpActin5R2),与试剂盒提供的引物UPM(表1)配对,分别用于扩增β-actin基因3′和5′非编码区(3′-UTR,5′-UTR)。3′ RACE和5′ RACE扩增均采用巢式PCR进行,反应体系为25 μL:2×TaqMasterMix 12.5 μL、上下游引物(10 μmol/L) 各1 μL、cDNA模板2 μL、ddH2O 8.5 μL。第1轮PCR反应条件为:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共35个循环;最后72 ℃ 延伸7 min。将第1轮PCR产物稀释10倍用作第2轮扩增的模板,第2轮扩增反应条件为:94 ℃预变性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;最后72 ℃ 反应7 min。PCR产物的电泳、回收、克隆及测序同上。
将测序所得保守区、3′-UTR和5′-UTR 3个片段的序列用DNAstar 7.1 中的Seqman软件拼接后获得苹果蠹蛾β-actin基因全长cDNA序列。根据拼接所得序列设计引物F和R(表1),用于苹果蠹蛾β-actin基因全长的扩增。以cDNA为模板,PCR扩增苹果蠹蛾β-actin基因全长cDNA,反应体系为:2×TaqMasterMix 12.5 μL、上下游引物(10 μmol/L) 各1 μL、cDNA模板2 μL、ddH2O 8.5 μL。反应程序为:94 ℃预变性3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 90 s,35个循环;最后72 ℃ 反应7 min。PCR产物的电泳、回收、克隆及测序同上。

表1 试验中用到的引物
1.5 生物信息学分析
采用NCBI (The National Center for Biotechnology Information)在线工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行β-actin核酸和蛋白质序列同源性分析;通过http://pfam.janelia.org/服务器对蛋白质的功能基序进行预测;运用ProtParam软件在线工具(http://expasy.org/tools/protparam.html)预测蛋白质中氨基酸的组成、分子质量和等电点;跨膜区分析采用TMPRED在线工具(http://www.ch.embnet.org/software/TMPRED_form.html);运用SignalP 3.0[12]预测蛋白质中可能存在的信号肽;采用PredictProtein服务器上的SABLE在线工具(https://www.predictprotein.org/)预测蛋白二级结构。
1.6 不同发育阶段及杀虫剂处理后苹果蠹蛾β-actin基因mRNA表达的检测
1.6.1 半定量PCR 反应体系为20 μL:cDNA (稀释5倍)0.6 μL,上、下游引物(10 μmol/L)各0.2 μL,2×TaqMasterMix 10 μL,ddH2O 9 μL。反应条件为:95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 25 s,共29个循环。每个样品设置3个平行重复,以不加cDNA模板作为阴性对照。
1.6.2 实时定量PCR 首先构建β-actin基因扩增标准曲线,以5倍等比稀释5~6个浓度梯度的cDNA为模板进行实时定量PCR(Real-Time quantitative PCR,RT-qPCR),理想的标准曲线的R2应接近1,扩增效率90%~105%。基于此,试验最终确立的反应体系为20 μL: cDNA (稀释5倍) 0.6 μL,上、下游引物(10 μmol/L)各0.2 μL,2×UltraSYBR Mixture 10 μL(康为世纪),ddH2O 9 μL。反应条件为:95 ℃预变性10 min,以实现热启动酶的活化;接着进行40个循环两步法反应,程序为:95 ℃ 15 s,55 ℃ 1 min;扩增反应结束后为溶解曲线部分,程序为以0.5 ℃/s的速度从55 ℃升温至95 ℃。每个样品设置3个平行重复,以不加cDNA模板作为阴性对照。试验数据采用IBM的SPSS Statistics 12软件进行显著性分析。
2 结果与分析
2.1 苹果蠹蛾β-actin基因的克隆
根据苹果蠹蛾近缘种的β-actin 氨基酸序列设计的兼并引物PCR扩增得到长度978 bp的保守区序列A(图1),Blast比对表明,该片段与NCBI数据库中大多数昆虫的β-actin序列一致性高达96%以上,可以确定所得序列为苹果蠹蛾β-actincDNA片段。根据所得保守区片段序列设计5′ RACE 和3′ RACE特异性引物,扩增分别获得长度为253 bp的5′-UTR和368 bp的3′-UTR片段(图1)。
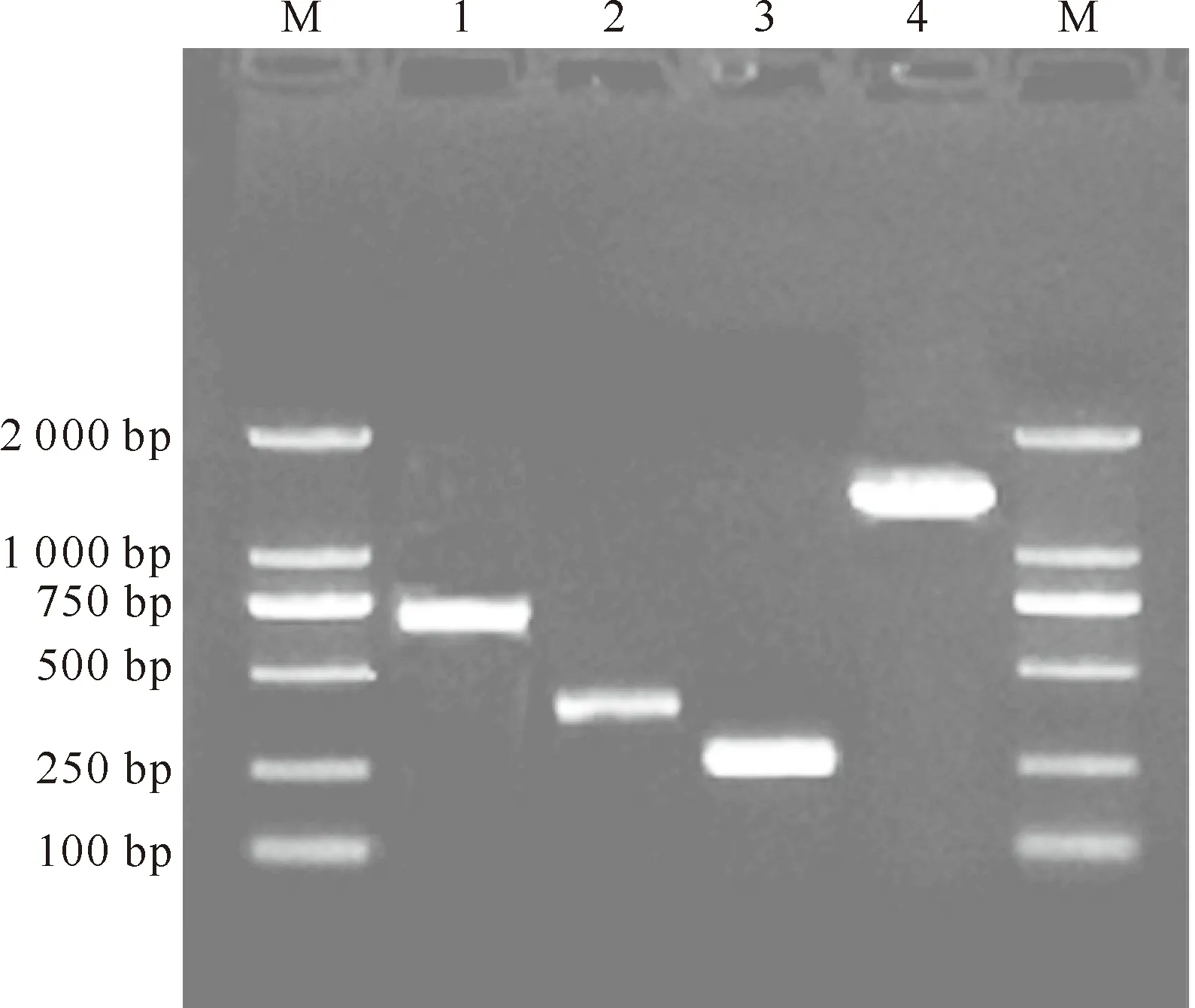
图1 苹果蠹蛾β-actin基因PCR产物的电泳结果
通过Seqman软件将分段克隆获得的保守区、5′-UTR、3′-UTR 3个片段序列拼接,得到1 466 bp的苹果蠹蛾β-actin基因cDNA全长。在此基础上设计引物,进行β-actin基因全长PCR扩增,结果获得了1 466 bp的苹果蠹蛾β-actin全长基因(图1)。对其测序后,将序列提交至GenBank,获得的登录号为KC832921。
2.2 苹果蠹蛾β-actin基因的生物信息学分析
开放阅读框在线预测工具(ORF Finder,http://www.ncbi.nlm.nih.gov/gorf/gorf.html) 预测的β-actin基因ORF全长为1 131 bp,起始密码子位于第102~104位核苷酸,终止密码子TAA位于第1 230~1 232位核苷酸,共编码376个氨基酸残基组成的β-actin蛋白质(图2)。该基因5′-UTR的长度为67 bp,3′-UTR的长度为268 bp。3′-UTR中存在典型的加尾信号AATAAA,以及Poly A尾巴。将推导的氨基酸序列在NCBI数据库中用在线工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,结果表明,苹果蠹蛾与绝大多数昆虫β-actin氨基酸同源性均在99%以上,而与斑点钝眼蜱(登录号:AAS55945.1)、蝇蛹金小蜂(登录号:NP-001157191.1) 等昆虫的氨基酸一致性可达100%,说明β-actin基因在昆虫中高度保守。同时可以确定该序列为苹果蠹蛾cDNA全长序列,编码1个完整的β-actin 蛋白质。
用ProtParam软件在线工具对推导蛋白质中氨基酸的组成、分子质量和等电点进行预测,结果表明,该蛋白质由376个氨基酸残基组成(图2),分子质量为41.793 7 ku,分子式为C1852H2906N492O562S23,等电点为5.29。使用TMPRED在线工具预测跨膜区,结果表明,该蛋白有2个跨膜区,分别位于第131~147位和338~356位(图2)。该预测结果与前人的结果[10,13]一致。SignalP 3.0预测发现,该蛋白质中无信号肽。通过PredictProtein服务器上的SABLE对该蛋白质中的功能位点进行预测,结果表明,该蛋白具有Actin蛋白家族的典型识别特征(图2),分别为54~64位的YVGDEAQSKRG,357~364位的WISKQEYD,105~117位的LLTEAPLNPKANR。另外,该蛋白还存在6种类型特定功能位点(图2),包括1个N-糖基化位点(13~16:NGSG),1个依赖cAMP和cGMP的蛋白激酶磷酸化位点(336~339:RKYS),5个蛋白激酶C磷酸化位点(61~63:SKR,67~69:TLK,146~148:SGR,195~197:TER,325~327:TMK),4个酪蛋白激酶Ⅱ磷酸化位点(78~81:TNWD,203~205:TTAE,235~237:SSLE,359~362:SKQE),2个酪蛋白激酶磷酸化位点(192~199:KILTERGY,211~219:RDIKEKLCY),8个N-豆蔻酰化位点(14~19:GSGMCK,43~48:GVMVGM,49~54:GQKDSY,75~80:GIVTNW,159~164:GVSHTV,246~251:GQVITI,269~274:GMEACG,344~349:GSILAS)。预测的蛋白质二级结构中,α-螺旋占30.9%,β-折叠占18.6%,无规则卷曲占50.5%。
2.3 苹果蠹蛾不同发育阶段及杀虫剂处理后β-actin的表达量分析
通过引物QS和QAS,半定量PCR检测在不同发育阶段苹果蠹蛾的cDNA模板中均扩增到约150 bp的单一片段 (图3-A)。琼脂糖凝胶电泳条带的亮度表明,β-actinmRNA表达水平在不同发育阶段苹果蠹蛾体内均相对恒定,无明显差异。
以QS和QAS为引物进行Real-Time PCR反应,得到的标准曲线相关系数R2为0.995,扩增效率达95%,表明所使用的引物具有较好的特异性,反应体系和条件良好,可以准确地用于定量检测。Real-Time PCR结果表明,苹果蠹蛾不同发育阶段 (图3-B)以及杀虫剂毒死蜱和高效氯氟氰菊酯(图4)处理后,β-actin基因的mRNA表达相对稳定,Ct值无显著性差异 (P>0.05)。

图3 不同发育阶段苹果蠹蛾β-actin基因mRNA的表达量
3 讨 论
本研究克隆得到了1 466 bp的苹果蠹蛾β-actin基因的cDNA全长,其中包括67 bp的5′-UTR,268 bp的3′-UTR,1 131 bp的ORF,编码376个氨基酸,这与其他物种的β-actinORF大小一致。理想的内参基因在生物体不同组织及不同发育时期的表达量应当在恒定的水平内,且不会受试验处理的影响[14]。
半定量PCR和qPCR是基因表达研究的重要技术。然而,qPCR由于仪器及技术的原因,往往存在一些非预见性的问题,半定量PCR的结果则更为直观、稳定[15]。本研究中,半定量PCR与qPCR结果表现出高度的一致性,因为二者的基本原理是一致的。本研究采用实时定量PCR和半定量PCR 2种技术对苹果蠹蛾不同发育阶段β-actin基因mRNA的表达情况进行了探讨,结果表明,不同发育阶段间β-actin基因mRNA的表达水平无明显差异,说明苹果蠹蛾β-actin基因在发育过程中具有较好的稳定表达性。为了进一步评估苹果蠹蛾β-actin作为内参基因的可能性,本研究用点滴法处理4龄幼虫,分析了杀虫剂处理对苹果蠹蛾幼虫β-actin基因mRNA表达水平的影响,结果表明,2种杀虫剂处理12~60 h后,β-actin的表达水平均相对稳定,无明显改变,说明苹果蠹蛾β-actin可以作为可靠的内参基因应用,为今后研究苹果蠹蛾抗药性的分子机制,以及以β-actin作为内参基因检测苹果蠹蛾其他靶基因mRNA表达水平的研究奠定了基础。
[参考文献]
[1] Rodríguez M A,Marques T,Bosch D,et al.Assessment of insecticide resistance in eggs and neonate larvae ofCydiapomonella(Lepidoptera:Tortricidae) [J].Pesticide Biochemistry and Physiology,2011,100:151-159.
[2] Reyes M,Collange B,Rault M,et al.Combined detoxification mechanisms and target mutation fail to confer a high level of resistance to organophosphates inCydiapomonella(L.) (Lepidoptera:Tortricidae) [J].Pesticide Biochemistry and Physiology,2011,99:25-32.
[3] Voudouris C C,Sauphanor B,Frank P,et al.Insecticide resistance status of the codling mothCydiapomonella(Lepidoptera:Tortricidae) from Greece [J].Pesticide Biochemistry and Physiology,2011,100:229-238.
[4] Reuveny H,Cohen E.Evaluation of mechanism of azinphos-methyl resistance in the codling mothCydiapomonella(L.) [J].Archives of Insect Biochemistry and Physiology,2001,57:92-100.
[5] Rodríguez M A,Bosch D,Sauphanor B,et al.Susceptibility to organophosphate insecticides and activity of detoxifying enzymes in Spanish populations ofCydiapomonella(Lepidoptera:Tortricidae) [J].Journal of Economic Entomology,2010,103:482-491.
[6] 张学祖.苹果蠹蛾在我国的新发现 [J].昆虫学报,1957,7(4):467-472.
Zhang X Z.Cydiapomonellanew finding in China [J].Acta Entomologica Sinica,1957,7(4):467-472.(in Chinese)
[7] 杨 瑞.苹果蠹蛾(Cydiapomonella(L.))在中国的适生性研究 [D].陕西杨凌:西北农林科技大学,2008.
Yang R.Study on habitat suitability ofCydiapomonella(L) in China [D].Yangling,Shaanxi:Northwest A&F University,2008.(in Chinese)
[8] Bustin S A.Quantification of mRNA using real-time revers transcription PCR (RT-PCR):Trends and problems [J].Molecular Endocrinology,2002,1:23-39.
[9] Radonic A,Thulkes,Mackay I M,et al.Guildeline to reference gene selection for quantitative real-time PCR [J].Biochemical Biophysical Research Communications,2004,313:856-862.
[10] 霍 棠,姜 鸣,吕淑敏,等.中华豆芫菁β-actin基因cDNA的克隆、序列分析及表达量检测 [J].西北农林科技大学学报:自然科学版,2012,40(11):1-7.
Huo T,Jiang M,Lü S M,et al.Molecular cloning,sequence analysis and expression detection of β-actin gene in the blister beetleEpicautachinensisLaporte [J].Journal of Northwest A&F University:Nat Sci Ed,2012,40(11):1-7.(in Chinese)
[11] Rose T M,Henikoff J G,Henikoff S.CODEHOP (Consensus-Degenerate Hybrid Oligonucleotide Primer) PCR primer design [J].Nucleic Acids Research,2003,31:3763-3766.
[12] Bendtsen J D,Nielsen H,Heijne G,et al.Improved prediction of signal peptides:SignalP 3.0 [J].Journal of Molecular Biology,2004, 340:783-795.
[13] 李 珂,阴 环,奚耕思,等.粘虫β-actin基因cDNA的克隆、序列分析及表达量检测 [J].昆虫知识,2010,47(6):1089-1094.
Li K,Yin H,Xi G S,et al.Molecular cloning,sequence analysis and expression detection ofβ-actingene in the oriental armyworm,Mythimnaseparata[J].Chinese Bulletin of Entomology,2010,47(6):1089-1094.(in Chinese)
[14] Giulietti A,Overbergh L,Valckx D,et al.An overview of real-time quantitative PCR:Applications to quantify cytokine gene expression [J].Methods,2012,5:386-401.
[15] 杨 光,曹 雪,房经贵,等.葡萄花发育基因的亚细胞定位和表达分析 [J].中国农业科学,2011,44(3):641-650.
Yang G,Cao X,Fang J G,et al.Sub-cellular localization and expression analysis of genes involved in grapevine floral development [J].Scientia Agricultura Sinica,2011,44(3):641-650.(in Chinese)
