利用工业轻烧粉合成碱式氯化镁晶须的方法
2014-03-25王婉婷王国胜
梁 海, 王婉婷, 王国胜
(沈阳化工大学 化学工程学院, 辽宁 沈阳 110142)
碱式镁盐由于其具有晶须[1-5]、纳米线[6-7]、纳米棒[8-10]、纳米带[11]的一维形貌,在很多领域具有较好的应用[12-14],也可以做为Mg(OH)2[15-16]和MgO[9]的前驱体.碱式氯化镁晶须作为一种一维的纳米材料,其分子式为xMg(OH)2·yMgCl2·zH2O (x,y,z=1,2,3…)[17],最早由Sorel[18]发现,存在于水泥中.其被用于水泥、纸张、橡胶等材料的添加剂、增强剂[19-23].
关于碱式氯化镁的制备,已经有文献进行了报道.Fan Weiliu[6]以MgO和MgCl2为原料,采用水热法合成了碱式氯化镁晶须.Wei Q[8]采用水溶液法以MgO和MgCl2为原料合成了碱式氯化镁晶须.Wu Jiansong[17]等人以MgCl2和NaOH为原料合成了碱式氯化镁晶须.本文采用轻烧粉及盐酸为原料的合成方法未见报道.
本文介绍一种一步法,由工业轻烧粉制备碱式氯化镁,解决了轻烧粉的除杂问题.将过量的轻烧粉加入到盐酸中,一部分轻烧粉将与盐酸发生酸碱中和反应生成氯化镁,另一部分轻烧粉中的MgO与得到的MgCl2反应,过滤去杂质得到镁液,静置得到碱式氯化镁.实现了一步由工业轻烧粉和盐酸合成碱式氯化镁,其工艺简单,操作容易,产品纯度高.
1 实验部分
1.1 实验原料与仪器
工业轻烧粉 (表1),浓盐酸37 %(质量分数,AR),聚乙二醇10000 (AR),NaOH (AR).

表1 轻烧粉的组成
高低真空扫描电子显微镜 (SEM) (JEOL JSM-6360LV),能谱仪 (Quest Level Ⅱ),X射线衍射仪 (XRD) (Bruker D8 Advance),红外光谱仪 (IR).
1.2 实验方法
将轻烧粉缓慢加入到200 mL HCl溶液m(HCl)∶m(H2O)中,轻烧粉中的MgO与盐酸的摩尔比为0.75∶1、0.7∶1、0.65∶1、0.6∶1、0.55∶1、0.5∶1,加入少量聚乙二醇分散剂,反应温度50 ℃,反应时间2 h.将整个溶液过滤,滤液在室温下静置2 d,过滤得到碱式氯化镁沉淀.分别用水和乙醇洗涤数次,在真空干燥箱内50 ℃干燥4 h,得到白色的碱式氯化镁粉体.
2 结果与讨论
2.1 实验表征结果
对实验用工业轻烧粉进行能谱分析,得其组成见表1.图1为原料轻烧粉的能谱图,其主要元素是Mg,并含有少量的Ca、Fe、Si等杂质.图2是轻烧粉的SEM图,从图2中可以看出轻烧粉的形貌为1 μm左右的颗粒.

图1 原料轻烧粉的能谱图

图2 原料轻烧粉的SEM图
图3 为轻烧粉中的MgO与盐酸不同摩尔比的碱式氯化镁的XRD图谱,与标准PDF卡片对比,样品均与碱式氯化镁的标准卡片(JCPDS 07—0412)吻合,没有其他杂质的衍射峰,证明得到了纯度较高的碱式氯化镁,其分子式为Mg2(OH)3Cl·4H2O.
图4是相应的碱式氯化镁的SEM图,从图4中可以看出:碱式氯化镁都具有很好的纤维结构,分散均匀.随着轻烧粉中的MgO量的减少,制得的碱式氯化镁晶须的直径也随之变小,当轻烧粉中的MgO与盐酸的摩尔比为0.75∶1时,碱式氯化镁的直径约为500 nm,减小到0.5∶1时,碱式氯化镁的直径约为200 nm.原料配比在0.75∶1~0.5∶1时能够得到碱式氯化镁晶须,在原料配比为0.65∶1时,碱式氯化镁的产量最高(如图5所示).当轻烧粉中的MgO与盐酸的摩尔比大于0.75∶1时,由于加入轻烧粉过多,溶液变为糊状无法过滤,当轻烧粉中的MgO与盐酸的摩尔比小于0.5∶1时,没有得到碱式氯化镁沉淀,最佳反应配比为0.65∶1.
图6为原料摩尔配比为0.65∶1的碱式氯化镁的IR谱图,3 434.04cm-1附近的吸收峰为O—H伸缩振动频率,在3 608.25 cm-1和3 656.21 cm-1处是结晶水的吸收峰,在1 631.71 cm-1附近是碱式氯化镁结晶水的H—O—H变形振动产生的吸收峰,1 154.02 cm-1处是OH-与Mg配位形成的振动峰.
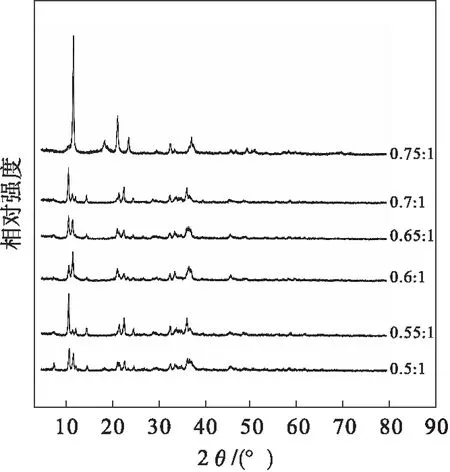
图3 碱式氯化镁的XRD图谱

图4 轻烧粉与盐酸不同摩尔比的碱式氯化镁SEM图
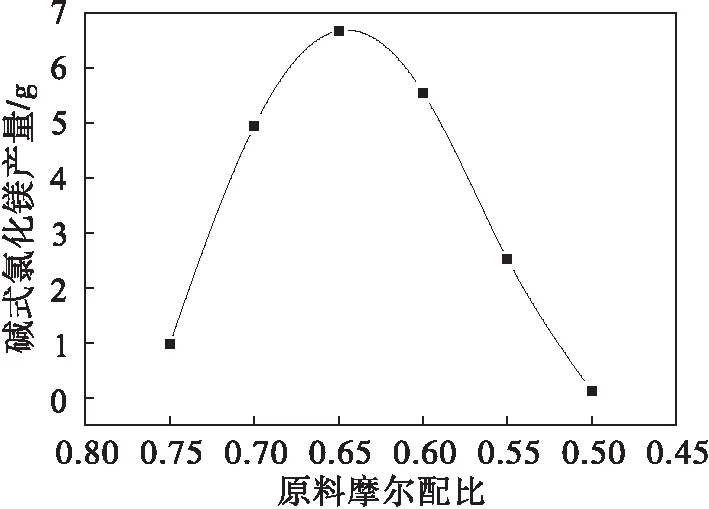
图5 碱式氯化镁的产量变化曲线
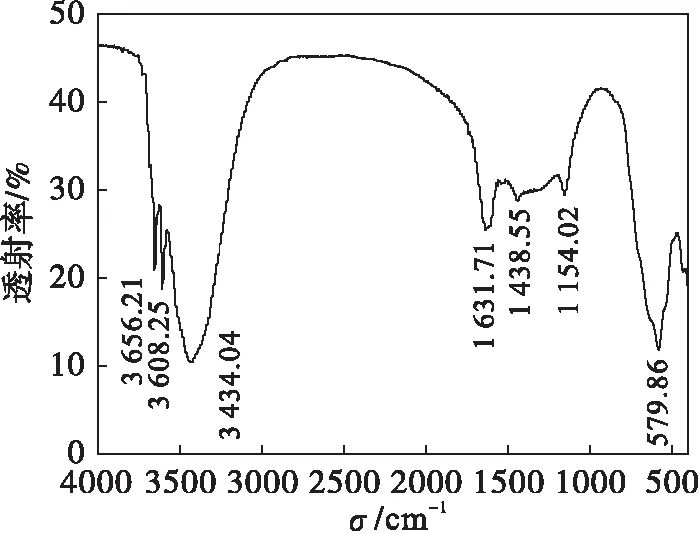
图6 碱式氯化镁的IR图谱
2.2 反应机理的研究
轻烧粉首先与盐酸发生反应,其中MgO、Ca和Fe等元素与盐酸反应生成含有MgCl2、CaCl2和FeCl3等溶质的溶液,过量轻烧粉中的MgO再与溶液中的MgCl2反应.MgO首先发生水解反应生成Mg(OH)2,溶解的Mg(OH)2电离为Mg2+和OH-,然后溶液中的Mg2+作为中心离子分别与Cl-和OH-配位体配位形成离子配合物[Mg—(OH)4]2-和[Mg—Cl4]2-[10],促进Mg(OH)2的溶解,[Mg—(OH)4]2-和[Mg—Cl4]2-再与溶液中的Mg2+和11个H2O反应得到分子式为Mg2(OH)3Cl·4H2O的碱式氯化镁.
主要总反应方程式:
MgO+2HCl→MgCl2+H2O
3MgO+MgCl2+11H2O→
2Mg2(OH)3Cl·4H2O
反应机理方程式如下:
MgO+H2O→Mg(OH)2→Mg2++OH-
Mg2++4(OH)-→[Mg—(OH)4]2-
Mg2++4Cl-→[Mg—Cl4]2-
3[Mg—(OH)4]2-+[Mg—Cl4]2-+
4Mg2++16H2O→4Mg2(OH)3Cl·4H2O
轻烧粉中的MgO之所以会溶解在生成的MgCl2溶液中,是因为MgO与MgCl2发生了上述配位反应,待MgO溶解完全后就可以进行第一次过滤,将一部分不溶物杂质去除.但Mg与其他金属相比配位能力较低,所以,在MgO“溶于”氯化镁溶液之后过滤得到的重镁水中含有的离子配位体浓度低,反应速度慢,反应时间较长,须静置2 d才能得到碱式氯化镁.第二次过滤则是将水溶液中的杂质过滤掉,经过反复洗涤后得到纯度较高的碱式氯化镁晶须.
3 结 论
以工业轻烧粉为原料合成了碱式氯化镁晶须.反应温度50 ℃,反应时间2 h时,轻烧粉中的氧化镁与盐酸摩尔比在0.75∶1~0.5∶1时,都可以得到碱式氯化镁,最适宜的摩尔配比为0.65∶1.随着MgO量的减少,碱式氯化镁的产量降低,直径也随之减小.并从配位化学的角度合理地解释了此方法的反应机理.
参考文献:
[1] Ding Yi,Zhang Guangtao,Zhang Shuyuan,et al.Preparation and Characterization of Magnesium Hydroxide Sulfate Hydrate Whiskers[J].Chemical Materials,2000,12(10):2845-2852.
[2] Gao Chuanhui,Li Xianguo,Feng Lijuan,et al.Preparation and Thermal Decomposition of 5Mg(OH)2·MgSO4·2H2O Nanowhiskers[J].Chemical Engineering Journal,2009,150(2):551-554.
[3] Yan Xiaoxing,Xu Dongli,Xue Dongfeng.Ions Direct the One-dimensional Growth of 5Mg(OH)2·MgSO4·2H2O[J].Acta Materialia,2007,55(17):5747-5757.
[4] Xiang L,Liu F,Li J,et al.Hydrothermal Formation and Characterization of Magnesium Oxysulfate Whiskers[J].Materials Chemistry and Physics,2004,87(2):424-429.
[5] Gao Chuanhui,Li Xianguo,Feng Lijuan,et al.Surface Modification and Characterization of Magnesium Hydroxide Sulfate Hydrate Nanowhiskers[J].Applied Surface Science,2010,256(10):3234-3239.
[6] Fan Weiliu,Song Xinyu,Sun Sixiu.Hydrothermal Formation and Characterization of Magnesium Hydroxide Chloride Hydrate Nanowires[J].Journal of Crystal Growth,2007,305(1):167-174.
[7] Sun X T,Xiang L,Zhu W C,et al.Influence of Solvents on the Hydrothermal Formation of One-dimensional Magnesium Hydroxide[J].Crystal Research and Technology,2008,43(10):1057-1061.
[8] Wei Q,Lieber C M.Solution-based Synthesis of Magnesium Oxide Nanorods[J].MRS Proceedings,1999,581:3-8.
[9] Cheng Wenting,Li Zhibao,George P Demopoulos.Effects of Temperature on the Preparation of Magnesium Carbonate Hydrates by Reaction of MgCl2with Na2CO3[J].Chinese Journal of Chemical Engineering,2009,17(4):661-666.
[10] Hao Zhihua,Du Fanglin.Synthesis of Basic Magnesium Carbonate Microrods with a “House of Cards” Surface Structure Using Rod-like Particle Template[J].Journal of Physics and Chemistry of Solids,2009,70(2):401-404.
[11] Zhou Zhengzhi,Sun Qunhui,Hu Zeshan,et al.Nanobelt Formation of Magnesium Hydroxide Sulfate Hydrate Via a Soft Chemistry Process[J].The Journal of Physical Chemistry B,2006,110(27):13387-13392.
[12] Zhou Zhengzhi,Deng Yulin.Solution Synthesis of Magnesium Hydroxide Sulfate Hydrate Nanobelts Using Sparingly Soluble Carbonate Salts as Supersaturation Control Agents[J].Journal of Colloid and Interface Science,2007,316(1):183-188.
[13] Ding Yi,Zhao Huazhang,Sun Yugang.Superstructured Magnesium Hydroxide Sulfate Hydrate Fibres:Photoluminescence Study[J].International Journal of Inorganic Materials,2001,3(2):151-156.
[14] Lu Hongdian,Hu Yuan,Yang Ling.Study of the Fire Performance of Magnesium Hydroxide Sulfate Hydrate Whisker Flame Retardant Polyethylene[J].Macromolecular Materials and Engineering,2004,289(11):984-989.
[15] Fan Weiliu,Sun Sixiu,You Liping.Solvothermal Synthesis of Mg (OH)2Nanotubes Using Mg10(OH)18Cl2·5H2O Nanowires as Precursors[J].Journal of Materials Chemistry,2003,13(12):3062-3065.
[16] Sun Xiaotao,Xiang Lan.Hydrothermal Conversion of Magnesium Oxysulfate Whiskers to Magnesium Hydroxide Nanobelts[J].Materials Chemistry and Physics,2008,109(2):381-385.
[17] Wu Jiansong,Xiao Yingkai,Su Jingyun.The Growth Mechanism of the Basic Magnesium Chloride Whisker[J].Science China Technological Sciences,2011,54(3):682-690.
[18] Sorel S.On a New Magnesium Cement[J].CR Acad Sc,1867,65:102-104.
[19] Paterson J H.Magnesium Oxychloride Cement[J].Journal of the Society of Chemical Industry,1924,43(9):215-218.
[20] Matkovic.B,Young J F.Microstructure of Magnesium Oxychloride Cements[J].Nature,1973,246(153):79-80.
[21] Tooper B,Cartz L.Structure and Formation of Magensium Oxychloride Sorel Cements[J].Nature,1966,211 (5044):64-66.
[22] Misra A K,Mathur R.Magnesium Oxychloride Cement Concrete[J].Bulletin of Materials Science,2007,30(3):239-246.
[23] Sorell C A,Armstrong C R.Reaction and Equilibria in Magnesium Oxychloride Cement[J].J Am Ceram Soc,1976,59(1/2):51-54.
