硒对氧化应激小白鼠肝脏酶活的影响
2014-03-25李丽娟
李丽娟
(山西农业大学 信息学院,山西 太谷 030801)
氧化应激是指机体在遭受各种有害刺激时体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,导致组织损伤。线粒体呼吸链复合体利用电子传递生产ATP,是ROS的主要来源[1],肝脏含有丰富的线粒体,因此也是ROS攻击的主要器官。D-半乳糖分子式C6H12O7,分子量196.16。可从乙醇中重结晶。属于糖酸类型,性质与葡萄糖酸类似,能被过量氧化剂(如HIO4)氧化,分解成甲醛、乙醛酸。半乳糖是动物体内的正常代谢产物。哺乳动物从乳糖中获得半乳糖,乳糖在体内水解生成葡萄糖和半乳糖,而半乳糖则在肝脏中迅速被酶解成葡萄糖。半乳糖代谢异常会引起动物生理功能显著变化。过量D-半乳糖的给予导致了机体代谢率的提高,由此产生了由于自由基的增加而引起的一系列与氧化应激相关的病理生理学变化。本研究以D-半乳糖为氧化剂,研究氧化应激对肝脏几种酶活的影响,为动物肝脏疾病的发病机制及诊断提供理论依据。
1 材料与方法
1.1 试验材料
随机选取45日龄36只昆明品系雄性小鼠,按体重相近原则将36只小白鼠分为3组,每组4个重复,每个重复3只小白鼠。每组小白鼠在试验开始时分别进行处理:1组为对照组,硒水平0.3 mg·kg-1W,腹腔注射10 mg·kg-1W的生理盐水;2组为低硒应激组,硒的水平0.3 mg·kg-1W,腹腔注射D-半乳糖150 mg·kg-1W,连续4周;3组高硒应激组,硒的水平0.6 mg·kg-1W,腹腔注射D-半乳糖150 mg·kg-1W,连续4周。试验结束时,摘除眼球采血,然后屠宰所有试验小白鼠,迅速剖开腹腔,分离出肝脏,放入冰冻的生理盐水中冲洗干净,滤纸吸干,迅速液氮冷冻,-80℃保存用于检测酶活。
1.2 肝脏氧化还原状态检测
GSH-PX活性测定:DTNB法;总抗氧化能力(T-AOV)测定、丙二醛(MDA):硫代巴比妥酸法。具体方法参照南京建成生物工程研究所的试剂盒说明书。
1.3 血清肝功能指标酶活测定
1.3.1 乳酸脱氢酶测定[2]
按表1顺序操作。
混匀后,室温静置5 min后440 nm比色,以蒸馏水调零点,读取两管A,求出LDH活力。
1.3.2 谷丙转氨酶(ALT)[3]
按表2顺序加入反应物。
表1乳酸脱氢酶活性的测定
Table1 The determination of lactate dehydrogenase activity/mL
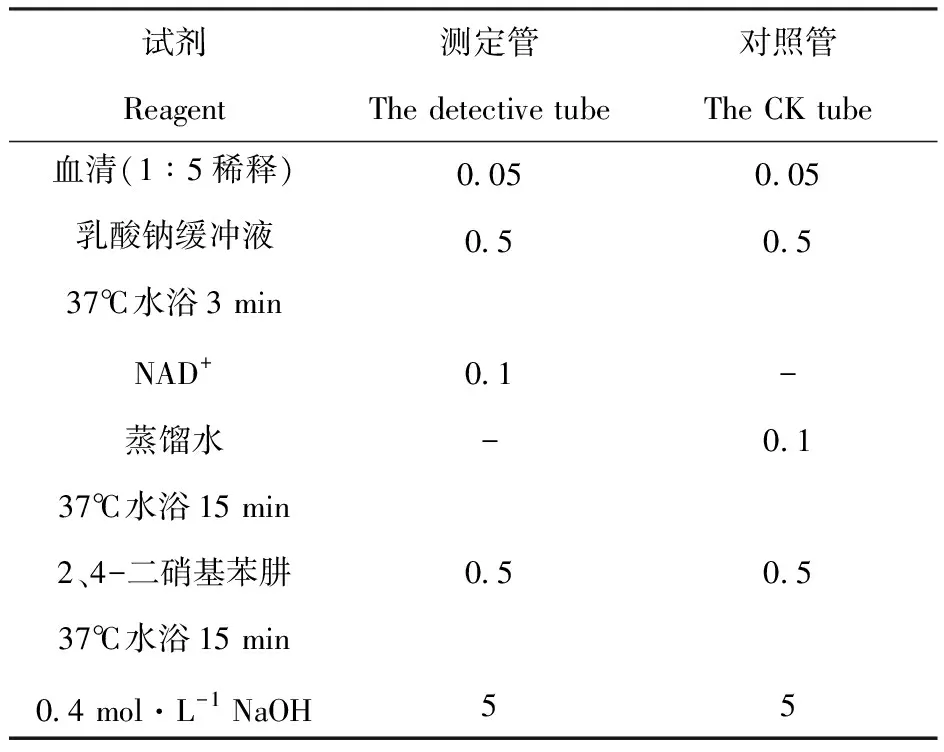
试剂Reagent测定管The detective tube对照管The CK tube血清(1∶5稀释)乳酸钠缓冲液37℃水浴3 minNAD+蒸馏水37℃水浴15 min2、4-二硝基苯肼37℃水浴15 min0.4 mol·L-1 NaOH0.050.50.1-0.550.050.5-0.10.55
表2谷丙转氨酶测定
Table2 The determination of Alanine transaminase activity/mL
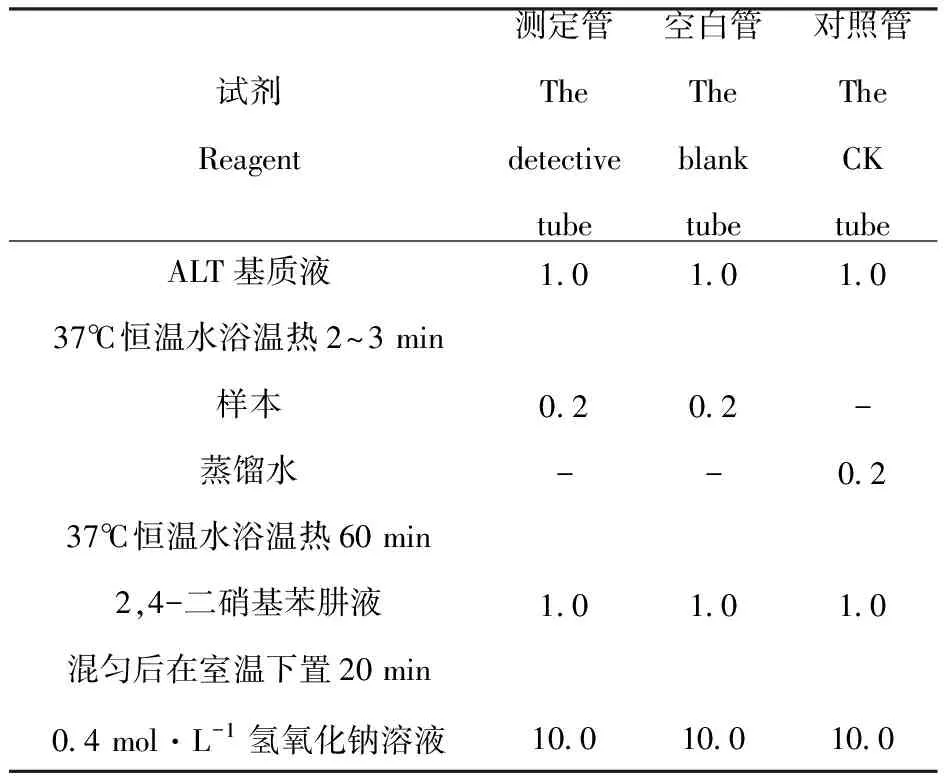
试剂Reagent测定管Thedetectivetube空白管Theblanktube对照管The CKtubeALT基质液37℃恒温水浴温热2~3 min样本蒸馏水37℃恒温水浴温热60 min2,4-二硝基苯肼液混匀后在室温下置20 min0.4 mol·L-1氢氧化钠溶液1.00.2-1.010.01.00.2-1.010.01.0-0.21.010.0
混匀后在室温下静置5 min,用蒸馏水调零点,在520 nm波长处测定光密度。在标准曲线上查取各自的ALT含量。
1.3.3 碱性磷酸酶(ALP)[3]
按表3顺序加入反应物。
立即混匀。用510 nm波长比色,以蒸馏水调零点,读取各管吸光度。计算出ALP含量。
1.4 统计分析
所有数据均经SPSS 17.0.0 one-way ANOVA For Windows数据分析软件处理。所有数据以平均数±标准差表示,Duncan法进行多重比较。
表3碱性磷酸酶测定
Table3 The determination of Alkaline phosphatase activity/mL
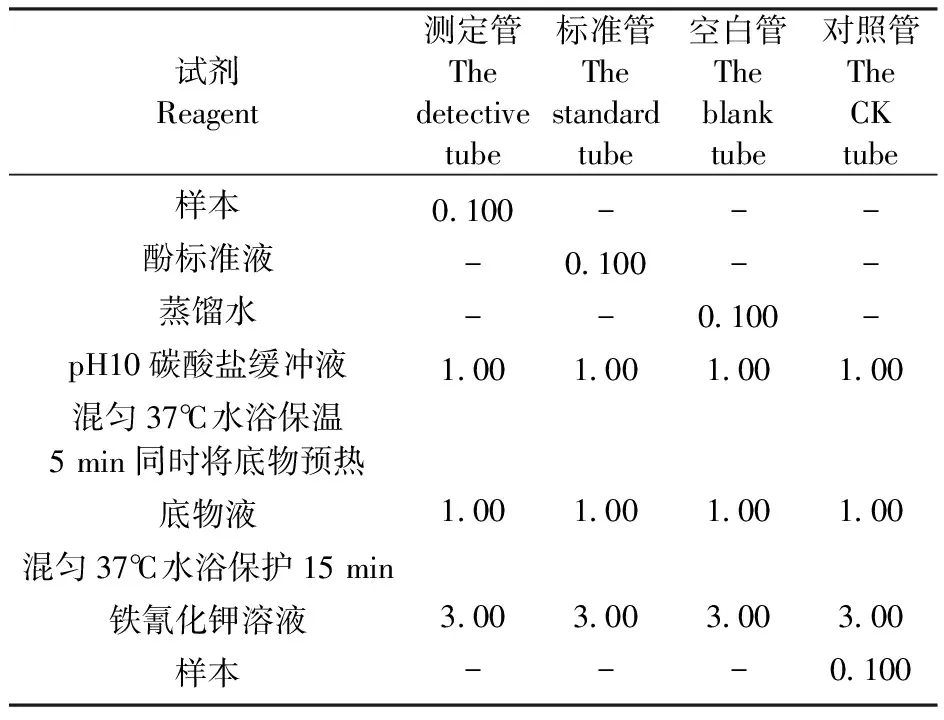
试剂Reagent测定管Thedetectivetube标准管Thestandardtube空白管Theblanktube对照管TheCKtube样本酚标准液蒸馏水pH10碳酸盐缓冲液混匀37℃水浴保温5 min同时将底物预热底物液混匀37℃水浴保护15 min铁氰化钾溶液样本0.100--1.001.003.00--0.100-1.001.003.00---0.1001.001.003.00----1.001.003.000.100
2 结果与分析
2.1 肝脏氧化还原状态
肝脏氧化应激状态的指标变化如表4。从表4可以看出,与对照组相比,低硒应激组GSH-PX活性、T-AOC含量极显著降低,MDA浓度极显著升高;高硒应激组GSH-PX活性、T-AOC水平和MDA浓度与对照组差异不显著。从表4的结果分析,腹腔注射D-半乳糖150 mg·kg-1W,可以使小白鼠处于氧化应激状态,0.3 mg·kg-1W硒水平抗应激效果效果显著,0.6 mg·kg-1W硒水平的抗应激效果显著。

表4 不同处理肝脏氧化还原指标的影响
注: 同列不同行数据不同肩注小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。表5同。
Note: The data different shoulder within the same column note lowercase letters mean significant difference (P<0.05), and different capital letters showed extremely significant difference (P<0.01).The same as table 5.
2.2 氧化应激对肝脏酶活的影响
由表5可见,与对照组相比,低硒组LDH活性极显著降低,高硒组LDH活性差异不显著,低硒组与高硒组差异显著。与对照组相比,低硒应激组ALT活性极显著下降,ALP活性极显著升高;高硒应激组ALT和ALP活性与对照组差异不显著。综合LDH、ALT和ALP活性分析结果,氧化应激引起了小白鼠肝脏的损伤,0.3 mg·kg-1W硒水平改善肝脏的氧化损伤效果不明显。0.6 mg·kg-1W硒水平具有良好的改善肝脏损伤的效果。
表5氧化应激对肝脏酶活的影响
Table5 The effect of oxidative stress on the activity of the enzymes in liver
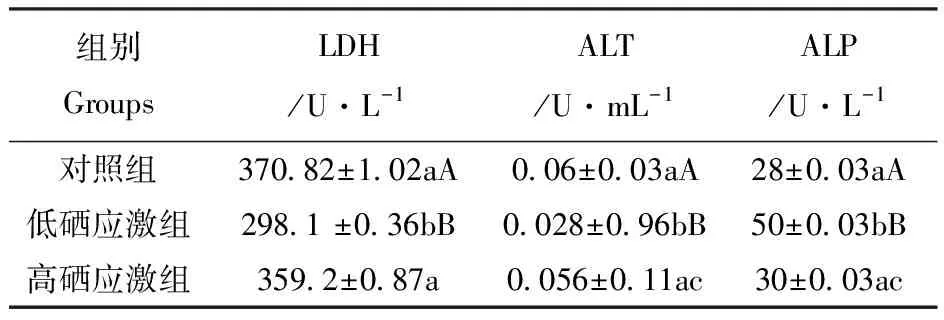
组别GroupsLDH/U·L-1ALT/U·mL-1ALP/U·L-1对照组低硒应激组高硒应激组370.82±1.02aA298.1 ±0.36bB 359.2±0.87a 0.06±0.03aA0.028±0.96bB0.056±0.11ac28±0.03aA50±0.03bB30±0.03ac
3 结论与讨论
3.1 氧化还原状态的评价
T-AOC是反映机体抗氧化水平高低的重要指标,MDA是脂质过氧化过程产生的羰基类物质,其含量高低反映了机体的脂质过氧化水平,MDA具有细胞毒性,能引发机体的多种疾病。吴伶艳研究表明氧化酪蛋白是小鼠组织和血液中的T-AOC和GSH-PX活性显著下降,MDA含量显著升高[4]。施用晖等研究报道高脂饮食使小鼠肠道的MDA含量显著升高,T-AOC活性显著下降[5]。
硒在生物体内的抗氧化作用分为酶和非酶2类。谷胱甘肽过氧化物酶(GSH-PX)是哺乳动物体内最重要的一种含硒酶,GSH-PX能分解体内不饱和脂质氧化所产生的过氧化物,从而防止对细胞膜、细胞结构及细胞功能的过度氧化造成损害[6]。本试验结果表明:与对照组相比,低硒应激组GSH-PX活性、T-AOC活性极显著下降,MDA浓度极显著升高,高硒应激组差异不显著,与付青姐、张斌等报道的结果一致[7,8]。
3.2 硒对氧化应激小鼠肝脏酶活的影响
乳酸脱氢酶是无氧酵解和糖异生的重要酶系之一,在体内能量代谢过程中发挥重要作用,几乎存在于所有组织中,任何原因引起的肝细胞损伤均可因乳酸脱氢酶逸出,引起乳酸脱氢酶浓度增加[9]。研究表明,乳酸脱氢酶浓度可以反映肝脏损伤情况,乳酸脱氢酶增加,细胞周期减慢,细胞增殖活性降低[10]。本研究结果表明,与对照组相比,低硒应激组乳酸脱氢酶活性极显著的增高,高硒应激组差异不显著,说明0.6 mg·kg-1W的硒水平具有较好的抗氧化功能。
ALT主要存在于肝细胞浆内,其细胞内浓度高于血清中1000~3000倍。只要有1%的肝细胞坏死,就可以使血清酶增高一倍。因此,ALT被世界卫生组织推荐为肝功能损害最敏感的检测指标。本研究结果表明:与对照组相比,低硒应激组乳酸脱氢酶活性极显著的增高,高硒应激组差异不显著,说明0.6 mg·kg-1W的硒水平具有较好的抗氧化功能,与杨晓军等研究结果一致[11]。
碱性磷酸酶是一种广泛分布的含锌膜结合糖蛋白,为基质小泡和质膜的标记酶[12]。当肝脏受到损伤或者障碍时经淋巴道和肝窦进入血液,而引起血清碱性磷酸酶明显升高。本文的研究结果与康绍乐等研究结果一致[13]。
参 考 文 献
[1]光吉博则,谷仁烨.氧化应激胡病理生理作用[J].日本医学介绍,2007,28:150-152.
[2]邱茜,张芳,齐志红,等.乳酸脱氢酶(LDH)37℃参考方法的建立及其临床应用[J].现代检验医学杂志,2010,25(3):19-21.
[3]刘维全.动物生物化学实验指导书(第三版)[M].北京:中国农业出版社,2010:20-25.
[4]吴伶艳.氧化酪蛋白对小鼠氧化还原状态机记忆能力的影响[D].江南大学,2011:10-12.
[5]李武,施用晖,杨瑞丽,等.硫辛酸对高脂饮食小鼠肠道氧化还原状态及消化道吸收功能的影响[J].中国病理生理杂志,2009,25(5):577-580.
[6]张建军,施卫忠,张贻传,等.微量元素硒的生物学功能及其在养猪生产上的应用影响[J].饲养饲料,2010,2:54-56.
[7]尹学哲,许惠仙,赵文玺,等.草苁蓉水萃取物对脂多糖与D-氨基半乳糖所致小鼠肝脏氧化应激和细胞凋亡的影响[J].食品与生物技术学报,2013,32(5):10-15.
[8]张斌,夏作理.百花丹参对D-半乳糖致小鼠氧化应激的影响[J].中国微循环,2007,11(4):105-107.
[9]王丽娜,宋艳荣,石峻.羟丁酸脱氢酶/乳酸脱氢酶在心肌损伤与肝脏损伤中的鉴别诊断价值[J].中国综合临床,2006,22(2):128-129.
[10]Pires VS,Gaboriau F,Guillon J,et al.Modulation of cell proliferation in rat liver cell cultures by new calixarenes[J].J Enzyme Inhib Med Chem,2006,21(3):261-270.
[11]杨晓军.甲硫达嗪致大鼠肝组织的损伤与氧化应激的关系[D].河北医科大学,2009:12.
[12]王俊丽,李金亭,傅山岗,等.小鼠成长过程中肾、肝、小肠碱性磷酸酶活性变化及细胞定位[J].四川动物,2008,27(5):788-789.
[13]康绍乐,杜启艳,王萍,等.饥饿应激对泥鳅3种组织糖原、ACP和ALP的影响[J].河南师范大学学报,2008,36(6):158-160.
