香鱼TGF-β1基因的克隆及其表达与鳗利斯顿氏菌感染的相关性
2014-03-23史雨红
程 娜, 史雨红, 陈 炯
(宁波大学 应用海洋生物技术教育部重点实验室, 浙江 宁波315211)
转化生长因子(transforming growth factor-β, TGF-β)因其具有“转化”大鼠纤维母细胞的作用而得名,几乎在所有的细胞中表达,主要在T细胞的子集中表达[1]。TGF-β蛋白在结构上进化较保守,具有调节细胞增殖、分化、粘附、形态形成及一些其他生理过程的作用[2]。除了它的生长调节功能,TGF-β还有潜在的免疫调节功能,对免疫系统的细胞成分具有刺激和抑制作用[3]。在免疫系统中TGF-β1是主要的表达产物,在哺乳动物免疫调节中发挥关键作用。在TGF-β1基因敲除小鼠实验中,只有40%的小鼠存活,而60%的小鼠死在子宫内,且存活下来的小鼠在多个组织中出现多病灶炎症性疾病,结合主要组织相容性复合蛋白I类和II类的过度表达及淋巴细胞中免疫球蛋白的分泌过剩,表明TGF-β1基因的敲除引起了小鼠的自身免疫性疾病[4]。Galdiero等[5]用重组TGF-β1蛋白处理鼠伤寒沙门氏菌感染的小鼠,结果表明TGF-β1在免疫应答中的作用可能涉及到复杂的作用机制,在特定胞内微生物的感染中发挥着关键作用,它调节细胞因子产物以及细胞对细胞因子刺激的应答。TGF-β1在免疫应答激活阶段是巨噬细胞、单核细胞、中性粒细胞和白细胞的一个潜在的化学引诱剂[6-7]。另外TGF-β1被认为提供部分或者不完整的免疫球蛋白A(IgA)开关信号,并和白介素-2 (interleukin-2, IL-2)、IL-5一起,通过激活B淋巴细胞来提高IgA的分泌[8-10]。此外,TGF-β有助于提升免疫系统,但在某些情况下,又能抑制免疫系统。它调节粘附分子的表达,为白细胞和参与炎症应答的其它细胞提供一个趋化梯度,然而一旦它们激活后又会抑制这些细胞的趋化[12-13]。
相关研究表明鱼类感染细菌后TGF-β1基因表达变化可能与免疫调节有关。例如,感染鲁氏耶尔森菌(Yersiniaruckeri)的虹鳟,与对照组相比,脾组织中TGF-β1基因mRNA表达变化显著;表明TGF-β1可能参与到鲁氏耶尔森菌引起的鱼类机体适应性应答[14]。Orieux等[15]筛选了自然条件下感染嗜冷黄杆菌(Flavobacteriumpsychrophilum)虹鳟,TGF-β1作为免疫标志基因之一表达量下降,表明病鱼的免疫系统变弱。Harms等[16]研究发现条纹鲈鱼感染分枝杆菌(Mycobacteriummarinum),9 d后脾单核细胞中TGF-β基因mRNA水平显著低于对照组,表明TGF-β基因mRNA表达下调可能导致炎症反应调节异常,从而引起分枝杆菌敏感性鱼类器官损伤。
香鱼(Plecoglossusaltivelis, sweetfish)属鲑形目、胡瓜亚目、香鱼科、香鱼属,是一种小型经济鱼类。香鱼一直被亚洲人视为“鱼中珍品”。近年来,香鱼的人工养殖规模在逐年扩大。与此同时,香鱼病害问题也在制约着香鱼养殖业的繁荣,鳗利斯顿氏菌(Listonellaanguillarum)是养殖香鱼的主要病原菌之一[17]。另外,大量使用抗生素类,产生增强细菌耐药性、残留危害健康等弊端。因此,进一步研究香鱼免疫相关基因,有助于健康绿色防治香鱼病害,对香鱼养殖业具有重要意义。
本文利用转录组测序的方法,获得了香鱼TGF-β1基因序列,通过多序列比对和系统进化树的构建,对序列和其进化关系进行分析,利用荧光定量PCR检测TGF-β1基因mRNA在各组织的表达量,通过原核表达体系表达TGF-β1成熟肽,并用成熟肽免疫小鼠制备了抗血清。以上研究初步探讨了TGF-β1基因在香鱼侵染细菌急性期的免疫调节作用,有助于进一步研究TGF-β1基因对鱼类的免疫调节作用机制。
1 材料与方法
1.1 实验材料与试剂
27尾健康香鱼(约20~25 g) ,购自宁海凫溪香鱼养殖场;ICR小鼠,购自宁波大学医学院实验动物中心;Gel Extraction Kit购自Omega公司;1 kb DNA Ladder Marker、RNAiso、ExTaqDNA聚合酶、AMV逆转录酶、pMD19-T Simple Vector、NdeI、XhoI和SYBRPremixExTaq等试剂盒购自Takara公司;SDS-PAGE低分子量标准蛋白,购自上海生物化学与细胞生物学研究所;二抗(辣根酶标记山羊抗小鼠IgG),购自北京中山金桥生物技术有限公司;显影定影试剂盒、ECL化学发光试剂盒、柯达X-OMAT BT胶片和压片暗盒,购自碧云天生物技术研究所;引物合成及序列测定,由上海英骏生物工程公司完成。鳗利斯顿氏菌菌株ayu-H080701,大肠杆菌TG1、BL21 pLys E和载体pET-28a均来自本实验室。
1.2 香鱼组织样品制备
健康香鱼3尾,用于香鱼组织样品制备,保存于液氮中[18]。其它香鱼随机平均分配,通过显微镜计数鳗利斯顿氏菌,用PBS稀释到1.0×105CFU/mL,腹腔注射实验组(100μL/尾),对照组注射等量的无菌PBS,并在注射后4、8、16、24 h取样,具体方法见文献[19]。
1.3 香鱼TGF-β1基因序列获得及序列分析
通过转录组测序的方法获得香鱼TGF-β1基因序列,利用在线软件SignalP3.0(http://www.cbs.dtu.dk/services/ SignalP/)对TGF-β1基因序列进行信号肽预测,Scanprosite (http://www.expasy.org/tools/scanprosite/和Motifscan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)对其结构特征进行分析,通过软件MEGA4.0完成多重序列比对和系统进化树的构建[20]。
1.4 香鱼TGF-β1基因在健康香鱼各组织中的表达

图1 不同物种TGF-β1基因氨基酸序列的多重比对Fig 1 Multiple alignment of the TGF-β1 amino acid sequences of different species黑色阴影表示氨基酸100%保守区域,“◆”表示TGF-β1成熟肽中,保守的脯氨酸(Pro36)和甘氨酸(Gly46),“▼”表示9个保守的半胱氨酸残基(组成的典型的“cysteine knot”结构)。各物种登录号分别为:香鱼(JP742920), 虹鳟鱼(CBL93216.1), 斑马鱼(NP_878293.1), 条纹鲈鱼(AAD46997.1), 金头鲷(AAN03842.1), 石斑鱼(ACV96791.1), 大西洋鲑(ACN11294.1), 金娃娃(CAG12751.1), 罗非鱼(XP_003459502.1), 真鲷(XP_003459502.1), 草鱼(ABU84814.1), 人(NP_000651.3), 小鼠(NP_035707.1)。
香鱼各组织RNA的提取和cDNA的合成方法,参考文献[21]。设计TGF-β1基因实时荧光定量(RT-qPCR)检测引物,TGF-β1(+):5′-CTGGAATGCCGAGAACAAAT-3′和TGF-β1(-):5′-GATCCAGAACCTGAGGGACA-3′。内参β-actin扩增引物pActin2(+):5′-TCGTGCGTGACATCAAGGAG-3′和pActin2(-):5′-CGCACTTCATGATGCTGTTG-3′。RT-qPCR检测TGF-β1基因mRNA在健康香鱼各组织中的表达特征,以及感染后在各组织中的表达变化,每个样品做3个重复,具体方法见文献[18]。定量结果采用2-ΔΔCt法进行分析[22]。
1.5 香鱼TGF-β1成熟肽的表达和抗血清制备及Western blot验证
香鱼TGF-β1基因的原核表达引物:TGF(+):5′-CCATATGACCGCAACGGAGACACCT-3′;TGF(-):5′-CCTCGAGCTAGCTACACTTGCA GGACCT-3′(下划线为NdeI和XhoI酶切位点)。 以香鱼肝组织cDNA为模板,PCR扩增香鱼TGF-β1基因的成熟肽,预期大小为336 bp,用2% (w/v)琼脂糖凝胶电泳检测PCR产物,试剂盒回收产物。用NdeI和XhoI酶切回收产物,酶切产物连接到pET-28a载体中,原核表达重组质粒,用18%的SDS-PAGE验证表达的蛋白。切胶纯化后免疫小鼠,3周后取其血清,并通过Western blot实验验证抗血清,具体方法参照文献[20]。
1.6 数据分析
采用单因素方差分析(One-way ANOVA),对实时荧光定量结果进行数据分析,P<0.05为显著差异。
2 结果
2.1 香鱼TGF-β1基因序列分析
香鱼TGF-β1基因完整的开放阅读框,由1134个核苷酸组成,编码377个氨基酸、分子量为43 kDa的前体蛋白。前体蛋白N端前19个氨基酸为信号肽序列,在线软件NetNGlyc1.0 Server预测前体蛋白中存在4个潜在的糖基化位点,分别在73、111、122、254氨基酸位点,等电点为8.72。成熟肽由C末端112个氨基酸组成,分子量大小为12.5 kDa。多重序列比对发现,鱼类和哺乳类TGF-β1的氨基酸序列具有较高的保守性,特别是C末端的成熟肽区域(图1)。前体蛋白含有一个KEX-Furin样蛋白酶识别位点(RKRR)和一个整合素结合位点(RGD),相关研究表明,KEX-Furin样蛋白酶,可以在RKRR位点把前体蛋白切割为前导肽和成熟肽;RGD位点能够特异性结合整合素,例如有报道表明RGD位点与αvβ6特异结合,从而活化TGF-β1[23]。成熟肽中含有一个典型的“cysteine knot”结构,由9个半胱氨酸组成。其中的8个半胱氨酸形成4对链内二硫键,并和第9个半胱氨酸结合,形成链间二硫键,从而构成TGF-β1二聚体[24]。另外,成熟肽中还含有一个保守的脯氨酸(Pro36)和一个保守的甘氨酸(Gly46)以及一个“CXC”结构,这些保守的位点被认为是TGF-β家族分子的共同特征[25]。
通过氨基酸多序列比对,揭示香鱼TGF-β1成熟肽与虹鳟的同一性最高为93%;与其它已知鱼类TGF-β1成熟肽的同一性在73%以上;与哺乳动物TGF-β1成熟肽的同一性在62%~70%之间。通过分析系统进化树的结果,揭示香鱼TGF-β1基因与虹鳟的进化关系最近,和哺乳动物TGF-β1基因分别成簇(图2)。
2.2 香鱼TGF-β1基因组织表达特征
RT-qPCR检测香鱼TGF-β1基因mRNA在各组织中的表达量。以香鱼TGF-β1在肝组织中的表达量为对照,其他各组织的相对表达量如下图所示:在免疫相关的肾组织中表达量最高,肝、脾组织中表达量次之(图3)。
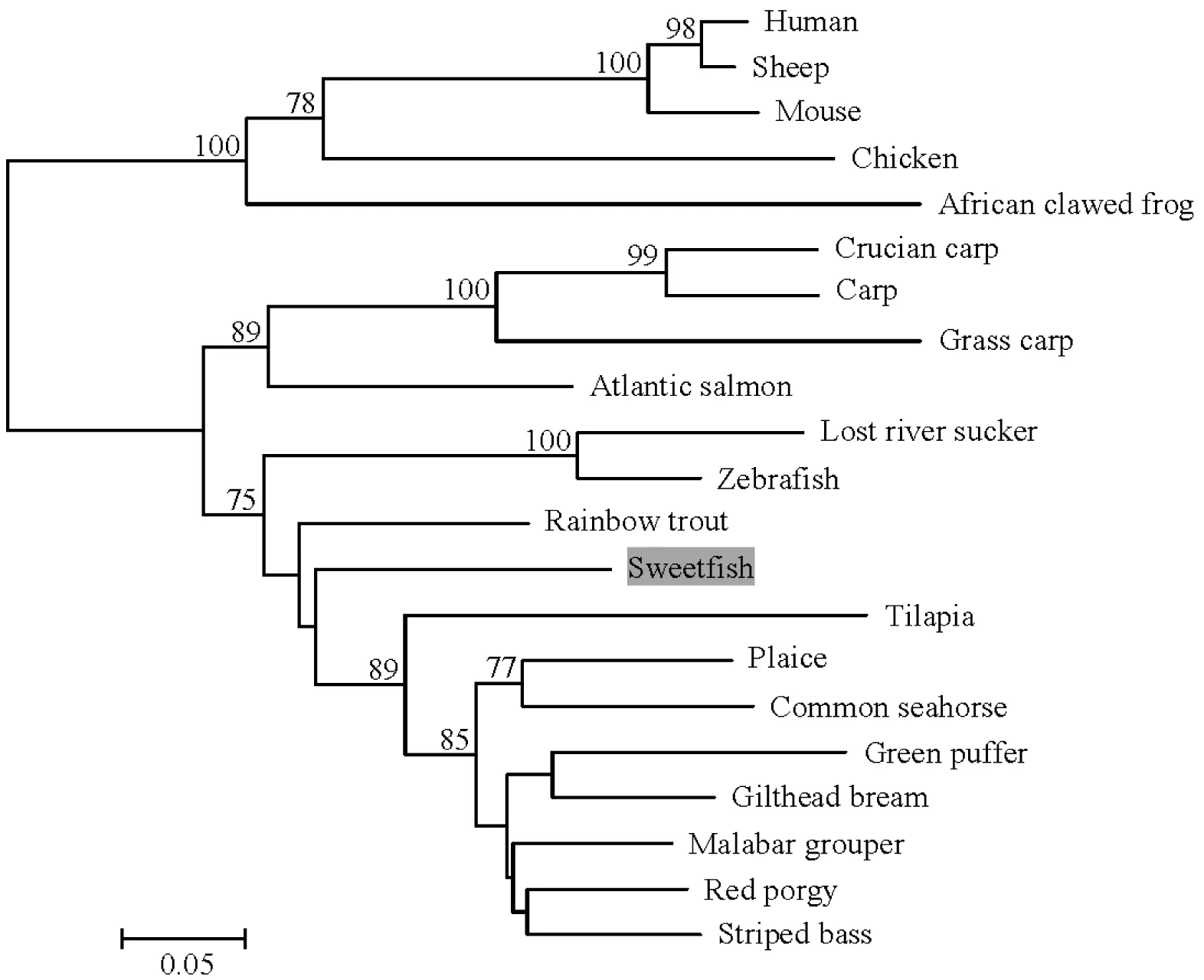
图2 香鱼和其他物种TGF-β1氨基酸序列的系统进化树
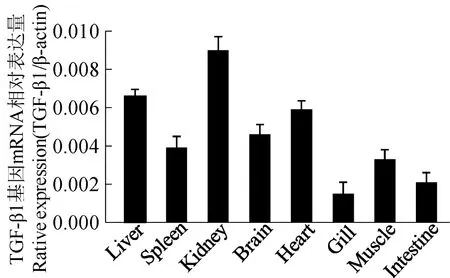
图3 TGF-β1基因mRNA在香鱼各组织中的表达
2.3 感染后香鱼各组织TGF-β1基因mRNA的表达变化
香鱼感染鳗利斯顿氏菌后,各组织中的TGF-β1基因mRNA表达量均发生了变化,表达水平都有一个显著上调的过程。各组织中表达变化量又有所不同,其中肾组织中TGF-β1表达量变化最为显著,注射12 h时为对照组的14.5倍,其次是脑组织的表达变化,8 h的表达量为对照组的6倍。脾、心脏和鳃分别为3.3、3.7和3.5倍,其余组织表达量变化均在3倍以下(图4)。
2.4 香鱼TGF-β1的原核表达和抗血清制备
原核表达质粒pET-28a-TGF-β1经测序验证无误后,转化大肠杆菌BL21 pLys E,经IPTG诱导表达后,18%的SDS-PAGE电泳检测,结果显示蛋白分子量大小约为14.5 kDa(图5),符合预期大小(12.5 kDa TGF-β1成熟肽+2.0 kDa His-tag)。用目的蛋白免疫小鼠,3周后取小鼠血清。Western blot验证上述抗血清,所得抗血清能与目的蛋白TGF-β1起特异性反应,但不与细菌蛋白自身反应,可用于后续相关研究。

图4 实时荧光定量PCR检测香鱼各个组织TGF-β1基因mRNA表达变化
n= 3;* :P< 0.05
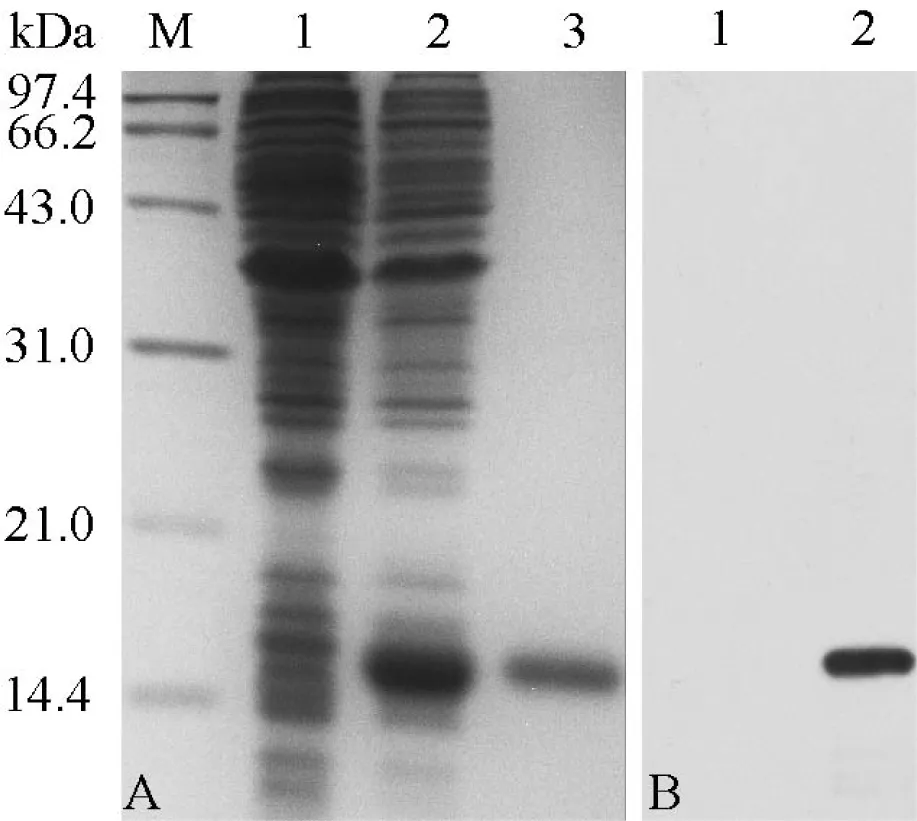
图5 香鱼TGF-β1成熟肽原核表达和抗血清验证
A:TGF-β1基因原核表达的SDS-PAGE电泳图。M: 标准蛋白质(kDa); 1: 转有pET-28a(+)空载的BL21 plys E菌体蛋白; 2: 转有pET-28a-TGF-β1重组质粒的BL21 plys E菌体蛋白; 3: TGF-β1蛋白切胶纯化产物; B: Western blot验证TGF-β1抗血清特异性, ECL显影。1: 转有pET-28a(+)空载的BL21 plys E菌体蛋白; 2: 转有pET-28a-TGF-β1重组质粒的BL21 plys E菌体蛋白。
3 讨论
本研究通过转录组测序,获得了香鱼TGF-β1的基因序列。序列分析表明,TGF-β1前导肽序列中前19个氨基酸残基为信号肽,成熟肽由C末端112个氨基酸组成了,分子量大小为12.5kDa。多序列比对表明香鱼TGF-β1成熟肽与虹鳟鱼同源性最高为93%,系统进化树分析表明与虹鳟的进化关系最近,和哺乳动物TGF-β1分别成簇。
RT-qPCR检测TGF-β1基因在健康香鱼各组织中的表达情况,结果表明在心、肝、脾、肾、脑、肌、肠、鳃8个组织中均有表达。在免疫相关的肾组织中表达量最高,肝、脾组织中表达量次之。已报道的TGF-β1基因几乎在所有的组织和细胞中表达。如鲤鱼在鱼卵,头肾、肝、脾、皮肤,头肾白细胞中均有表达,在头肾白细胞、头肾、脾中表达量较高[26];虹鳟在肝、脾、头肾、肾、心、脑、鳃、肌肉、肠等14个组织中均有表达,在头肾、脾、肾组织中表达量较高[27];金鱼的TGF-β1基因在头肾、肾、肝、脾、脑、心、鳃、肠中均有表达,在皮肤、肾、脾中表达量较高[28];草鱼在脾、鳃、脑、肝、肌肉、肾、头肾巨噬细胞和外周血白细胞中均有表达,在头肾巨噬细胞、鳃中表达量较高[29]。
本研究通过人工腹腔注射香鱼,使其感染鳗利斯顿氏菌,RT-qPCR检测各组织24 h内TGF-β1基因mRNA的表达变化,各组织的表达量均发生了变化。其中肾组织中TGF-β1基因mRNA表达量变化最为显著,注射12 h时为对照组的14.5倍,表明TGF-β1基因的mRNA表达变化与香鱼感染鳗利斯顿氏菌的急性期过程相关。鳗利斯顿氏菌可以侵染大多数海水鱼,对海水养殖鱼类危害大,也是被研究较多的弧菌[30]。Caipang等[31]用鳗利斯顿氏菌人工感染大西洋鳕鱼(Gadusmorhua),研究发现感染后血清中载脂蛋白A-I、非特异性细胞毒素细胞受体蛋白1、白介素1等相关免疫基因均出现显著变化。Tierney等[32]通过人工感染鳗利斯顿氏菌虹鳟,观察虹鳟在水中游泳表现,感染低浓度的和对照组无明显变化,高浓度组出现明显异常。Rojo等[33]通过腹腔注射鳗利斯顿氏菌人工感染斑马鱼,研究显示白介素1β、Toll样受体22、肿瘤坏死因子等免疫相关因子在感染后表达显著变化。目前尚未见有关于细菌感染香鱼后TGF-β1基因或蛋白表达变化的文献。本文通过鳗利斯顿氏菌人工感染香鱼,并测定TGF-β1的表达变化,表明TGF-β1的表达变化与香鱼感染鳗利斯顿氏菌的急性期过程相关,可能参与到鱼类免疫调节过程中。另外,TGF-β1基因在鱼类免疫调节中具体的作用机制尚未明确,还有待进一步研究。
本研究揭示TGF-β1可能在香鱼感染鳗利斯顿氏菌急性期的免疫应答过程中发挥作用,有助于下一步研究TGF-β1基因对鱼类的免疫调节作用机制。
参考文献:
[1]Chin D, Boyle G M, Parsons P G, et al. What is transforming growth factor-beta (TGF-beta)? [J]. British Journal of Plastic Surgery, 2004, 57(3): 215-221.
[2]Li M O, Flavell R A. TGF-beta: a master of all T cell trades [J]. Cell, 2008, 134(3): 392-404.
[3]Maehr T, Wang T, Gonzalez V J L, et al. Cloning and expression analysis of the transforming growth factor-beta receptors type 1 and 2 in the rainbow troutOncorhynchusmykiss[J]. Dev Comp Immunol, 2012, 37(1): 115-126.
[4]Kulkarni A B, Ward J M, Yaswen L, et al. Transforming growth factor-beta 1 null mice. An animal model for inflammatory disorders [J]. Am J Pathol, 1995, 146(1): 264-275.
[5]Galdiero M, Marcatili A, Cipollaro de l′Ero G, et al. Effect of transforming growth factor β on experimentalSalmonellatyphimuriuminfection in mice [J]. Infect Immun, 1999, 67(3): 1432-1438.
[6]Fan K, Ruan Q, Sensenbrenner L, et al. Transforming growth factor-beta 1 bifunctionally regulates murine macrophages proliferation [J]. Blood, 1992, 79: 1679-1685.
[7]McCartney-Francis N L, Mizel D, Wong H, et al.TGF-β regulates production of growth factors and TGF-β by human peripheral bloodonocytes [J]. Growth Factors, 1990, 4: 27-35.
[8]Rafferty D E, Montgomery P C. The effects of transforming growth factor-beta and interleukins 2, 5 and 6 on immunoglobulin production in cultured rat salivary gland tissues [J]. Oral Microbiol Immunol, 1995, 10: 81-86.
[9]Zettel L, Clark D A, Ernst P B. Transforming growth factor-beta 1 enhances IgG and IgA sheep red blood cell responses [J]. Int Immunol, 1992, 4: 975-983.
[10]Ehrhardt R O, Strober W, Harriman G R. Effect of transforming growth factor (TGF)-beta 1 on IgA isotype expression. TGF-beta 1 induces a small increase in slgA+B cells regardless of the method of B cell activation [J]. J Immunol, 1992, 148: 3830-3836.
[11]Letterio J J, Roberts A B. Regulation of immuneresponses by TGF-β [J]. Annu Rev Immunol, 1998, 16: 137-161.
[12]McCartney-Francis N L, Frazier-Jessen M, Wahl S M. TGF-beta: a balancing act [J]. Int Rev Immunol, 1998, 16(5/6): 553-580.
[13]Fontana A, Constam D B, Frei K, et al. Modulation of the immune response by transforming growth factor beta [J]. Int Arch Allergy Immunol, 1992, 99: 1-7.
[14]Harun N O, Wang T, Secombes C J. Gene expression profiling inna veand vaccinated rainbow trout afterYersiniaruckeriinfection: insights into the mechanisms of protection seen in vaccinated fish [J]. Vaccine, 2011, 29(26): 4388-4399.
[15]Orieux N, Douet D G, Le Henaff E M, et al. Prevalence ofFlavobacteriumpsychrophilumbacterial cells in farmed rainbow trout: characterization of metallothionein A and interleukin1-betagenes as markers overexpressed in spleen and kidney of diseased fish [J]. Vet Microbiol, 2013, 162(1): 127-135.
[16]Harms C A, Howard K E, Wolf J C, et al.Transforming growth factor-β response to mycobacterial infection in striped bassMoronesaxatilisand hybrid tilapiaOreochromisspp[J]. Vet Immunol Immunopathol, 2003, 95(3/4): 155-163.
[17]李长红, 陈 炯, 史雨红, 等. 宁海地区香鱼弧菌病病原菌鉴定 [J]. 微生物学报, 2009, 49(7): 931-937.
[18]杨旦阳, 陈 炯, 陆新江, 等. 香鱼CCL4-like基因的克隆、序列分析及免疫相关 [J]. 中国细胞生物学学报, 2013, 35(5): 676-683.
[19]李长红, 陈 炯, 史雨红, 等. 香鱼抗凝血酶基因(AT)cDNA的克隆、序列分析及组织表达特征 [J]. 农业生物技术学报, 2011, 19(1): 157-163.
[20]陈梅珍, 陈 炯, 陆新江, 等. 香鱼hepcidin基因的克隆、序列分析及组织表达特征 [J]. 动物学研究,2010,31(6): 595-600.
[21]黄左安, 陈 炯, 陆新江, 等. 香鱼凝血因子X基因表达与鳗利斯顿氏菌感染的相关性 [J]. 动 物 学 研 究, 2011, 32(5): 492-498.
[22]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408.
[23]Annes J P, Munger J S, Rifkin D B. Making sense of latent TGF-beta activation [J]. J Cell Sci, 2003, 116(2): 217-224.
[24]Hardie L J, Laing K J, Daniels G D, et a1.Isolation of the first piscine transforming growth factor beta gene:analysis reveals nitissue specific expression and a potential regulatory sequence in rainbow trout(Oncorhynchusmykiss) [J]. Cytokine, 1998, 10(8): 555-563.
[25]Burt D W, Law A S. Evolution of the transforming growth factor-beta superfamily [J]. Prog Growth Factor Res, 1994, 5(1): 99-118.
[26]Zhan Y, Jimmy K. Molecular isolation and characterisation of carp transforming growth factor beta 1 from activated leucocytes [J].Fish Shellfish Immunol, 2000, 10(4): 309-318.
[27]Maehr T, Costa M M, Vecino J L, et al. Transforming growth factor-beta1b: a second TGF-beta1 paralogue in the rainbow trout (Oncorhynchusmykiss) that has a lower constitutive expression but is more responsive to immune stimulation [J]. Fish Shellfish Immunol, 2013, 34(2): 420-432.
[28]Haddad G, Hanington P C, Wilson E C, et al. Molecular and functional characterization of goldfish (CarassiusauratusL.) transforming growth factor beta [J]. Dev Comp Immunol, 2008, 32(6): 654-663.
[29]Yang M, Zhou H. Grass carp transforming growth factor-beta 1 (TGF-beta 1): molecular cloning, tissue distribution and immunobiological activity in teleost peripheral blood lymphocytes [J]. Mol Immunol, 2008, 45(6): 1792-1798.
[30]杨少丽, 王印庚, 董树刚. 海水养殖鱼类弧菌病的研究进展 [J]. 海洋水产研究, 2005, 26(4): 75-83.
[31]Caipang C M, Hynes N, Puangkaew J, et al. Intraperitoneal vaccination of Atlantic cod,Gadusmorhuawith heat-killedListonellaanguillarumenhances serum antibacterial activity and expression of immune response genes [J]. Fish Shellfish Immunol, 2008, 24(3): 314-322.
[32]Rojo I, de Ilárduya O M, Estonba A, et al. Innate immune gene expression in individual zebrafish afterListonellaanguillaruminoculation[J]. Fish Shellfish Immunol, 2007, 23(6): 1285-1293.
[33]Tierney K B, Balfry S K, Farrell A P. SubclinicalListonellaanguillaruminfection does not impair recovery of swimming performance in rainbow troutOncorhynchusmykiss[J]. Dis Aquat Organ, 2005, 67(1/2):81-86.
