α-SMA与肿瘤发展相关性的研究
2014-03-23张晶晶艾红佳牛庆元马德顺
张晶晶, 艾红佳, 牛庆元, 马德顺
(沈阳大学 生命科学与工程学院, 沈阳 110044)
近期研究发现α-SMA与肿瘤的发展之间存在相关性。国内学者研究金地鼠颊囊白斑癌变模型标本的α-SMA表达情况时发现,随着细胞癌变程度增高,其α-SMA的表达量越低[1]。而其他学者在对乳腺癌侵润行为的研究中发现,α-SMA的表达程度与乳腺癌侵润进程相关[2]。而Chen在研究中证实α-SMA能够加强细胞牵引力(cell traction forces,CTFs)[3]。国外的学者发现α-SMA是一种机械敏感性蛋白,介导应力纤维的收缩[4-6]。Kraning-Rush等以人的乳腺癌、前列腺癌与肺癌为研究对象,各研究对象均取具转移性与不具转移性两种细胞样本;对比各组牵引力时发现,随着癌细胞的转移的潜能性增加,其细胞牵引力显著性增大[7]。Indra等对比4个具有不同转移能力、同一来源的乳腺肿瘤细胞系的牵引力时,得出小鼠肿瘤细胞随着转移潜能的增加,其牵引力在2D水平上表现出减小的趋势,但在3D水平上具有增大的倾向[8]。
这些研究初步探索了肿瘤细胞与α-SMA以及肿瘤细胞与细胞牵引力的关系,然而,单个细胞水平的α-SMA表达与肿瘤发生以及CTFs之间的关系尚未见报道。因此,本实验以α-SMA,CTFs为研究对象,辅以细胞微丝的观察,研究了小鼠肿瘤细胞与二者的相关性,试图探索它们与肿瘤侵润过程的相关性。
1 材料与方法
1.1 实验动物及试剂
Hepatoma cells (Hepa1-6)以及Lewis肺腺癌细胞株(LLC)细胞由中科院提供。C57BL/6j小鼠购自沈阳医学院动物实验中心,4周龄,体重17 g±2 g,雌性。实验条件符合SPF要求,所用物品均经高压灭菌消毒。高糖DMEM培养基购于Invitrogen公司,胎牛血清购于德国Biochrom公司,抗体及鬼笔环肽购于Sigma公司。胰蛋白酶购自Sigma公司。自制双抗(含青霉素、链霉素)。
1.2 细胞的获取与培养
1.2.1 小鼠细胞原代培养
小鼠肝细胞原代培养。取4周龄SPF级雌性C57BL/6j,颈椎脱臼法处死,解离小鼠肝组织。剥去组织外包裹的膜,将组织剪碎,加入无菌PBS反复漂洗,当组织块颜色由深红变为浅白后,1500 r/min离心5 min,弃上清。向组织块中加入3倍体积,浓度为0.1%的Ⅱ型胶原蛋白酶溶液,4°C冰箱消化过夜。次日,取出装有消化中的组织块的离心管,吸打至组织块分散为细胞团,用200目细胞筛剔除体积较大的组织或细胞团,将筛出的液体1500 r/min低温离心5 min,弃上清,加入5 mL含10%胎牛血清的培养基,接入培养瓶中,置于37℃,CO2浓度为5%的培养箱中培养。1 h左右观察细胞贴壁情况,舍弃贴壁较快的成纤维细胞,将培养液移至另一瓶中,反复2~3次,对细胞进行初步纯化,待细胞长满培养瓶底面积的80%~90%后,利用不同细胞对胰蛋白酶的耐受性不同,进一步对细胞进行纯化,得到纯度较高的肝细胞。对所得肝细胞通过形态学以及PAS染色法进行鉴定[9],
小鼠肺细胞原代培养。剖离小鼠肺组织,于1%PBS中除去气管、血管等组织,用PBS清洗组织内的血污后,用眼科剪将组织剪成大小为1 mm3左右的小块,并加入3倍体积、浓度为0.25%的胰酶,置于37℃下消化10~20 min后,加入等量的含有10%FBS的DMEM培养基终止消化,200目筛网过滤后,1500 r/min低温离心5 min,去上清,再将沉淀加入0.1%Ⅰ型胶原酶在37℃下消化10~15 min,加入含有10%FBS的DMEM培养基终止消化,1500 r/min离心5 min,将细胞悬液接种于培养瓶中,置37℃,5%CO2的培养箱中培育,1 h左右观察细胞贴壁情况,此时贴壁的多为成纤维细胞,悬浮的多数为肺泡Ⅱ型上皮细胞和其他杂细胞,将培养液小心吸出置于另一瓶中继续培养,反复2~3次,最后吸出培养液,1000 r/min离心5 min,弃上清,用含10%FBS的DMEM培养基重悬沉淀细胞,接种于培养瓶置37℃,5%CO2的培养箱中培育。对肺细胞通过SP-C免疫荧光染色进行鉴定[10-11]。
1.2.2 小鼠癌细胞建系培养
取Hepal-6细胞株与LLC细胞株,置于含5%CO2,37℃ 的培养箱中培养,培养基为含10%FBS的DMEM高糖培养基,每2 d换液1次,显微镜下观察,待培养细胞总量达到实验需求、细胞处于对数生长期时进行消化,血球计数板进行计数,制成浓度为1×107/mL的细胞悬液。取4周龄SPF级雌性C57BL/6j,按0.2 mL/鼠的量接种于4周龄雌性C57BL/6j小鼠前肢部皮下,接种细胞后,观察小鼠皮下成瘤与肿瘤生长情况。待成瘤后,颈椎脱臼法处死小鼠,分离皮下的肿瘤组织,并按照正常细胞的制取方法获得Hepal-6与LLC细胞。培养的初始阶段细胞的形态并不稳定,传代至细胞形态基本稳定时,即可用于后续试验。
1.3 α-SMA的免疫荧光染色
将去除残余培养基后的细胞爬片于3.7%的甲醛-PEMD固定液中固定7 min,1%Triton X-100中通透10 min,37℃ 1%山羊血清中孵育1 h,以封闭爬片上的非特异性抗原,洗去山羊血清后,加入一抗于4℃孵育过夜;洗去一抗后加入FITC标记的二抗,于37℃避光染色2 h,每次更换溶液期间,都以如下程序漂洗:PBS 5 min×3次,ddH2O 3 min×1次,以保证后续的步骤不被影响。染色结束后置于荧光显微镜(Leica 3000B)下观察并拍照记录。由于荧光本身具有淬灭特性,为了后续图像分析的准确性,拍照时应在最短时间内完成。
1.4 鬼笔环肽染色
取密度适中的细胞爬片,用PBS轻柔洗涤;3.7%的甲醛-PEMD固定10 min,PBS洗去固定液,略干燥后滴0.1%Triton X-100处理10 min,PBS稍洗,加入20 μL 5 μg/mL鬼笔环肽染液到清洁载玻片上,将爬片有细胞的一面反扣其上,避光染色40 min,取出后用PBS和蒸馏水冲洗,显微镜下观察。
1.5 细胞牵引力的测算
1.5.1 CTF技术的基本原理
细胞贴附于弹性基质时,会使贴附表面发生形变,根据材料力学原理,计算基质的形变程度可以间接测算细胞牵引力的大小,方向及其他力学特征量。
1.5.2 操作步骤
确定所需弹性基质的刚度,并按所需各成分的配比制备弹性基质。本实验采用硬度为3000(Pa)的双层聚丙烯酰胺凝胶,下层为无荧光微珠的基底层,上层则掺入了3%~4%的荧光微珠。在制备好的弹性基质上,按照1000~1500细胞/盘的密度种植细胞,并于37℃,5% CO2的条件下避光培养,待细胞贴壁后,补充2.5 mL培养基,整个细胞培养的时间应控制在6 h。每个样本需拍摄3张图片供后续计算:第1张应记录细胞在普通光源下的形态与位置;第2张应记录在有细胞贴附时,各荧光微珠所处位置;第3张应记录细胞脱离基质后,各荧光微珠所处位置[12-14]。
1.5.3 图像数据的分析与处理
将拍摄好的图片导入MATLAB7.0中计算各样本的均方根牵引力,投影面积,最大牵引力等各项数据,将所得数据汇总录入spss17.0进行K-S检验及t检验。
2 结果

A—为小鼠肝细胞α-SMA的分布;B—为小鼠Hepa1-6细胞α-SMA的分布;C—为小鼠肺细胞α-SMA的分布;D—为小鼠LLC细胞α-SMA的分布。
图1小鼠肝细胞、肺细胞癌变前后α-SMA分布的变化
Fig 1 The changes of the α-SMA expression level in mouse hepatic cells and lung cells before & after the canceration
由图1可清晰的反映出α-SMA在两种细胞内表达强度的不同。在小鼠肝细胞的胞质内,α-SMA的分布较为均匀且表达量较高,而Hepa1-6细胞中α-SMA的分布稀疏,表达的强度也有明显降低,通过软件imagepro-plus6.0可以对图像做进一步的分析, 所测算出的结果汇总于图3。
由图2中A与B、C与D二组牵引力的分布图可以看出,正常细胞的牵引力分布较均匀,着力点较多,力的分布面积较大。而肿瘤细胞的牵引力分布较为集中,着力点较单一,面积也相对较小。
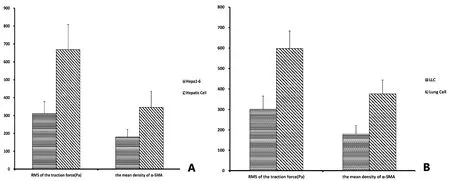
通过K-S检验和t检验,测算出的正常细胞与肿瘤的牵引力均方根值与α-SMA的平均光密度的结果见图3。

A—为小鼠肝细胞牵引力的测算结果;B—为小鼠Hepa1-6细胞牵引力的测算结果;C—为小鼠肺细胞牵引力的测算结果;D—为小鼠LLC细胞牵引力的测算结果。
图2小鼠肝、肺细胞癌变前后细胞牵引力的变化
Fig 2 The calculation of cell traction force in mouse hepatic and lung cells before & after the canceration
A—小鼠肝细胞以及肝肿瘤细胞;B—小鼠肺细胞以及肺肿瘤细胞
图3小鼠肝、肺细胞癌变前后均方根牵引力及平均光密度的测算结果
Fig 3 The calculation of RMS traction and mean density in mouse hepatic and lung cells before & after the canceration

A—小鼠肝细胞内微细分布; B—小鼠肝肿瘤细胞内微分布
图4对比肝细胞与Hepa1-6细胞的微丝变化
Fig 4 The changes of microfilament between hepatic cells and Hepa1-6 cells
由上图的数据分析得出:小鼠细胞癌变后,与正常细胞相比,肝肿瘤细胞与肺肿瘤细胞的均方根牵引力分别减小了53.4%和49.7%,t检验表明二者之间具有显著性差异;二者相比,α-SMA的平均光密度分别47.9%和52.3%,t检验显示其间有显著性差异。
对比图4中的细胞微丝可以发现Hepa1-6细胞内的微丝明显加粗、扭曲,并呈现不规则的排布。放大肝细胞内部分微丝可在底面见到清晰的回落点,而在Hepa1-6细胞内,并无明显的回落点。
3 讨论
对4细胞系、各40组样本的均方根牵引力以及α-SMA的表达量进行t检验,发现肝细胞与肝肿瘤细胞、肺细胞与肺肿瘤细胞在均方根牵引力的比较中P<0.05,差异显著。这个结果提示α-SMA的表达与牵引力的变化、细胞癌变密切相关。并且,α-SMA的表达与牵引力的变化呈现一致性,印证了Chen的研究结果[3]。综合α-SMA、微丝的染色结果与牵引力的分析图来看,细胞癌变后,α-SMA的表达量的变化影响了FAs(focal adhesions)的成熟进程[15],微丝在贴附面无明显回落点也支持此结论,然而胞内产生牵引力需借由FAs才能传递至胞外基质,这就解释了牵引力分析结果中着力点数量、分布面积都明显减少的现象。在正常细胞内,牵引力借由完善的微丝系统,将牵引力通过微丝均匀分布,形成稳定的张力平衡,并通过FAs与基质面结合,这对于细胞自身结构的维持,以及细胞在组织内空间位置的固定都是有利的;相比之下,肿瘤细胞内微丝加粗,呈扭曲状,说明微丝处于包含能量的状态,微丝的这种变化使细胞处于不稳定状态,加之牵引力分布的不均衡,使细胞趋向于运动。综合以上我们认为,细胞癌变过程中,α-SMA表达的下调造成了FAs、细胞牵引力以及细胞微丝的变化,最终影响了细胞的稳定性,使细胞趋向于运动,这也许是肿瘤细胞转移行为发生的基础条件之一。
目前在人与小鼠之间,对于细胞癌变过程中牵引力变化趋势的研究得出了相对立的结果。在以人的组织细胞为样本的研究中,牵引力随着细胞癌变的发生,表现出牵引力增大的趋势[7];而在以小鼠组织细胞为样本的研究中,牵引力则随着癌症的发展表现出减小的倾向[9]。在人与小鼠之间,α-SMA的表达量的变化与牵引力的变化表现出了一致性[1-2],由此可以推测α-SMA的调节机制不同是导致人与小鼠细胞癌变过程中牵引力变化趋势的不同的原因之一。
参考文献:
[1]华 丽,周曾同,张水龙,等.α-SMA在金地鼠颊癌囊变过程中的动态观察[J].临床口腔医学杂志,1999,15(4):232-234.
[2]徐 继,张 岩,何治军.乳腺癌间质成纤维细胞α-SMA表达的意义[J].重庆医学,2010,12,39(23):3195-3199.
[3]Chen J X, Li H X, Raj N S, et al.Alpha-smooth muscle actin expression enhances cell traction force[J]. Cell Motility and the Cytoskeleton, 2007,64(4): 248-257.
[4]Goffin J M, Pittet P, Csucs G, et al. Focal adhesion size controls tension-dependent recruitment of alpha-smooth muscle actin to stress fibers[J]. Journal Cell Biol, 2006, 172(2): 259-268.
[5]Kawai-Kowase K, Sato H, Oyama Y, et al. Basic fibroblast growth factor antagonizes transforming growth factor-beta1-induced smooth muscle gene expression through extracellular signal-regulated kinase 1/2 signaling pathway activation[J]. Arterioscler Thromb Vasc Biol, 2004, 24(8): 1384-1390.
[6]Bogatkevich G S, Tourkina E, Abrams C S, et al. Contractile activity and smooth muscle alpha-actin organization in thrombin-induced human lung myofibroblasts[J]. Am Journal Physiol Lung Cell Mol Physiol, 2003, 285(2): 334-343.
[7]Kraning-Rush Casey M, Joseph P, Reinhart-King C A. Cellular traction stresses increase with increasing metastatic potential[J]. PLoS ONE, 2012, 7(2):e32572.
[8]Indra I, Undyala V, Kandow C, et al. An in vitro correlation of mechanical forces and metastatic capacity[J]. Physical Biology, 2011, 8(1):1-14.
[9]谢华福,甘 淋,李 娟, 等.一种简单的肝细胞分离、培养和鉴定方法[J].泸州医学院学报,2003,26(4):306-308.
[10]郑金旭,黄振杰,汤 艳,等.构建原代分离培养与鉴定小鼠肺泡Ⅱ型上皮细胞的方法及模型[J]. 中国组织工程研究与临床康复, 2010, 154:2761-2764.
[11]Wang J H C, Lin J S. Cell traction force and measurement[J]. Biomechan Model Mechanobiol, 2007, 6(6):361-371.
[12]Li B, Wang J H C. Application of sensing techniques to cellular force measurement[J]. Sensors (Basel, Switzerland), 2010, 10(11):9948-9962.
[13]Wang J H C. Cell traction forces (CTFs) and CTF microscopy applications in musculoskeletal research[J]. Oper Tech Orthop, 2010, 20(2): 106-109.
[14]Kønnov-Jessen L, Pefersen O W. A function for filamentous alpha-smooth muscle actin : retardation of motility in fibroblasts[J].The Journal of Cell Biology, 1996, 134(1):67-80.
[15]Rønnov-Jessen L, Petersen O W. A function for filamentous a-smooth muscle actin : retardation of motility in fibroblasts[J].The Journal of Cell Biology, 1996, 134(1):67-80.
