纳米ZnO对斑马鱼肝脏生理生化指标的影响
2014-03-23周占清赵群芬陈晓菲
周占清, 赵群芬, 陈晓菲, 刘 林
(宁波大学 海洋学院,浙江 宁波 315211 )
纳米材料因其特殊的颗粒尺寸及特有的物理化学性质而被广泛应用。随着大量的生产和应用,纳米颗粒将不可避免地向环境中释放,最终会进入水环境,由此很可能给水生生物带来潜在的威胁。因此纳米材料对水生生物的生物效应越来越受到人们的关注[1-7]。纳米ZnO是一种新型高功能精细无机产品,主要应用于纺织工业、抗菌玻璃、橡胶工业、建筑材料涂料工业和光催化剂等领域。最初认为纳米ZnO是无毒的,对生物是安全的,但是随着报道其对藻类有毒性以来[8],陆续又有报道称纳米ZnO对人肺上皮细胞[9]、革兰氏阳性菌有毒性[10],对小鼠肝组织DNA有损伤[11]。并发现纳米ZnO的毒性机制可能是参与活性氧化物的形成及诱导细胞凋亡[12]。
金属氧化物可能通过光照、干扰细胞代谢及细胞间相互作用生成ROS,而过量的ROS可能会破坏抗氧化酶系统,从而对GSH、MDA和Na+K+-ATPase造成影响,出现组织器官蛋白、DNA和膜损伤[8]。ZnO纳米颗粒是金属氧化物的一种,随着ZnO纳米颗粒广泛地应用,通过生活和工程应用等途径进入水环境,对水生生物可能会产生一定的毒性作用。本研究以斑马鱼为实验动物研究了ZnO纳米颗粒处理下肝组织解剖结构以及ROS、GSH、MDA含量、Na+K+-ATPase活性的变化,以探讨纳米颗粒的毒性效应及引起该效应的机制。
1 材料与方法
1.1 材料
斑马鱼(Daniorerio)购于宁波天胜花鸟市场,平均体长3.00 cm±0.30 cm,平均体重0.50 g±0.05 g,实验前至少驯养7 d,养殖水为去氯充分曝氧的自来水,水温24℃±0.5℃,每日喂食1次,驯养期间无死亡。实验前1 d停止投饵,实验期间不间断充氧。
纳米ZnO(25nm±2nm):购于杭州大洋纳米新材料有限公司。还原型谷胱甘肽(GSH)、丙二醛(MDA)、Na+K+-ATPase、活性氧(ROS)测定试剂盒购于南京建成生物研究所。
1.2 方法
处理组斑马鱼的纳米ZnO浓度分别为2.8 mg/L、5.6 mg/L、11.2 mg/L、22.4 mg/L和44.8 mg/L,暴露试验参照GB/T13276-1991,约1 L的水中暴露1 g斑马鱼,每容器7~8尾鱼, 3个平行。实验结束后立即解剖取出肝组织,加入预冷的匀浆介质(0.01 mol/L Tris-HCl、0.001 mol/LEDTA-2Na、0.01 mol/L蔗糖,pH值7.4)研磨,2000~4000 r/min离心,取上清,参照试剂盒说明,分别测定GSH、MDA、Na+K+-ATPase和ROS。蛋白质含量用考马斯亮蓝法测定。
GSH以每克组织蛋白中GSH的mg数表示,MDA以每毫克组织蛋白中MDA的nmol数表示,Na+K+-ATPase活力定义为:每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1μmol无机磷量为一个ATP酶活力单位(μ)。ROS以荧光强度/毫克蛋白表示。
1.3 数据处理
数据用SPSS16.0统计软件进行单因素方差分析(One Way ANOVA),差异显著性检验采用Turkey法,P<0.05表示差异显著,P<0.01表示有极显著差异。
2 结果
2.1 ZnO纳米颗粒对斑马鱼肝组织GSH影响
不同浓度ZnO纳米颗粒处理下,斑马鱼肝组织中GSH活性变化见图1,各处理组中斑马鱼肝组织中GSH含量显著少于对照组(P<0.05),说明ZnO纳米颗粒对斑马鱼肝组织的GSH含量有明显的抑制作用。

图1 不同浓度ZnO纳米颗粒在不同时间对斑马鱼肝组织GSH影响(“*”表示P<0.05)Fig 1 The effect of GSH on Danio rerio liver tissue at different nano-ZnO expose concentrations and treatment time (“*”means p<0.05)
2.2 ZnO纳米颗粒对斑马鱼肝组织MDA影响
从图2看出,ZnO纳米颗粒悬浮液对斑马鱼肝组织有明显的脂质过氧化损伤。在ZnO纳米颗粒暴露不同的时间后,各浓度处理组的斑马鱼肝组织MDA含量随着ZnO纳米颗粒浓度的升高而升高,与对照组相比,差异显著(P<0.05)

图2 不同浓度ZnO纳米颗粒在不同时间对斑马鱼肝组织MDA影响(“*”表示P<0.05)Fig 2 The effect of MDA on Danio rerio liver tissue at different nano-ZnOexpose concentrations and treatment time (“*”means P<0.05)
2.3 ZnO纳米颗粒对斑马鱼肝组织Na+K+-ATPase影响
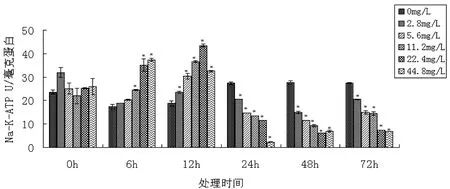
图3不同浓度ZnO纳米颗粒在不同时间对斑马鱼肝组织Na+K+-ATPase影响(“*”表示P<0.05)Fig 3 The effect of Na+K+-ATPase on Danio rerio liver tissue at different nano-ZnO expose concentrations and treatment time (“*”means P<0.05)
ZnO纳米颗粒对斑马鱼肝组织Na+K+-ATPase的活性影响与处理的时间和浓度有关(图3)。在6 h和12 h,ZnO纳米颗粒对斑马鱼肝组织Na+K+-ATPase起到诱导作用;而处理24 h后,ZnO纳米颗粒对斑马鱼肝组织Na+K+-ATPase具有显著的抑制作用(p<0.05)。
2.4 ZnO纳米颗粒对斑马鱼肝组织ROS影响
如图4中所示,24 h暴露不同浓度的ZnO纳米颗粒后,肝组织细胞中ROS含量显著高于对照组(P<0.05),分别为对照组的111.54%、133.23%、165.41%、177.48%和131.94%。ZnO纳米颗粒在肝组织细胞中产生过量的ROS,造成过氧化损伤。

图4 不同浓度ZnO纳米颗粒处理24 h后对斑马鱼肝组织ROS影响(“*”表示P<0.05)Fig 4 The effect of ROS on Danio rerio liver tissue at different nano-ZnO expose concentrations and treatment time (“*”means P<0.05, “**” means P<0.01)
3 讨论
外源物质通过摄食、表面接触等途径进入鱼体后会引起鱼的一系列生理生化反应,而肝组织是其中比较敏感的组织器官,它将有毒物质代谢反应后变成低毒或无毒的代谢物,最终排出体外。但有毒物质浓度过高会造成肝细胞损伤,使肝细胞结构表现异常和病变,肝组织的生理代谢活动也会受到影响,表现为生理指标的变化,所以,鱼类的肝组织中的形态和生理的变化可以作为环境中有毒物质污染的生物指示[13]。
GSH能清除体内氧自由基(H2O2),轻度的外界刺激能诱导GSH[14],过量刺激(如ROS)则会导致其耗竭[15]。本研究中,与对照组相比,处理组中斑马鱼肝组织中GSH含量均减少,这很可能是斑马鱼的肝受到了纳米氧化锌的严重刺激,产生了过量的ROS,而ROS的产生耗竭了GSH,这与Ahmad等研究硅纳米颗粒处理后人肝细胞株HepG2,ROS升高,GSH减少的结果相似[16]。
MDA是生物膜脂质过氧化物在氧自由基的作用下形成的一种脂质过氧化物,MDA作为氧化应激的标志物,其含量变化反映了机体损伤程度。Govindasamy等发现,纳米银处理罗非鱼肝脏中MDA含量增加,并且抑制了抗氧化酶活性,随之破坏了鱼体内氧化酶和抗氧化酶之间的平衡[17]。Wu等报道纳米TiO2对小鼠体内和体外潜在的生物毒性,小鼠皮肤和肝脏MDA含量有显著升高,说明纳米颗粒的沉积间接诱导了病理损伤[18]。本实验结果显示,处理组中斑马鱼肝组织中MDA的含量是增加的,说明纳米氧化锌颗粒在斑马鱼体内沉积,并随着体内循环系统进入肝脏,破坏肝脏中的氧化酶和抗氧化酶系统,从而对肝脏造成氧化损伤。
有研究报道,当鱼受到环境中污染物的胁迫时,Na+K+-ATPas活性会被抑制,或先升高再降低[19-21],故现认为Na+K+-ATPase是一种很有潜力的环境污染效应的生物标志物,在实验中发现24 h前Na+K+-ATPase活性随着纳米颗粒浓度的升高而升高,24 h后随着ZnO纳米颗粒浓度的升高,Na+K+-ATPase活性逐渐降低,说明ZnO纳米颗粒在初期刺激斑马鱼肝中的Na+K+-ATPase的活性,是鱼对环境中异物的一种应急防御反应,随后随着胁迫时间和ZnO纳米颗粒浓度的增加,超过防御机制的承受能力故而表现为Na+K+-ATPase的活性降低。
ROS容易侵袭多不饱和脂肪酸,损害细胞功能,有报道显示高浓度的纳米TiO2使小鼠大脑产生明显的ROS,产生的过量ROS会破坏大脑中氧化和抗氧化系统平衡,最终导致脂质过氧化反应[22]。通常,当ROS升高或ROS防御体系破坏,细胞或动物就可称为产生了氧化应激[23-25]。本实验中检测到ZnO纳米颗粒处理组ROS水平显著高于对照组,说明ZnO纳米颗粒刺激斑马鱼产生了氧化应激反应。
ROS, MDA和GSH是3种重要的氧化应激生理生化指示剂。通常情况下,组织细胞的抗氧化系统保护其不受ROS的攻击,消除或者减弱氧化损伤。而相反的,当ROS和MDA水平升高以及GSH水平降低时,组织细胞产生氧化应激,并最终导致损伤。本实验中ZnO纳米颗粒刺激鱼体内产生ROS的机制可能为干扰细胞代谢活动产生ROS或干扰细胞间相互作用促进产生ROS。所有的处理组都显示了ZnO纳米颗粒对斑马鱼肝组织产生了明显的毒理作用,表明虽然纳米颗粒在水中可能产生团聚作用,但其仍对组织器官产生毒性影响。一方面,组织细胞内ROS的产生可能是由于氧化锌纳米颗粒进入肝脏细胞中,对线粒体造成损伤。纳米颗粒进入细胞后不再自由地分布于胞质中,而是优先附着于线粒体上,当纳米颗粒侵入到线粒体上,抗氧化防御能力即随之改变,而抗氧化酶活性的降低可能是由于纳米颗粒抑制了相关酶mRNA的表达[22]。另一方面,ZnO纳米颗粒进入细胞后迅速分解释放Zn2+,细胞内的Zn2+含量提高,使线粒体功能损伤,产生ROS[26],过量的ROS可能是ZnO纳米颗粒重要的毒性机制之一。
参考文献:
[1]Zhu X S, Zhu L, Duan Z H, et al. Comparative toxicity of several metal oxide nanoparticle aqueous suspensions to Zebra fish(Daniorerio) early developmental stage[J]. Environ Sci Health, 2008, 43 (3):278-284.
[2]Farkas J, Christian P, Urrea J A G, et al. Effects of silver and gold nanoparticles on rainbow trout (Oncorhynchusmykiss) hepatocytes[J]. Aquatic Toxicology, 2010, 96:44-52.
[3]Heinlaan M, Ivask A, Blinova I, et al. Toxicity of nanosized and bulk ZnO, CuO and TiO2to bacteriaVibriofischeriand crustaceansDaphniamagnaandThamnocephalusplatyurus[J]. Chemosphere, 2008, 71:1308-1316.
[4]Mortimer M, Kasemets K, Kahru A. Toxicity of ZnO and CuO nanoparticles to ciliated protozoaTetrahymenathermophila[J]. Toxicology, 2011, 269:182-189.
[5]Ramsdena C S, Henrya T B, Handya R D. Sub-lethal effects of titanium dioxide nanoparticles on the physiology and reproduction of zebrafish[J]. Aquatic Toxicology, 2013, 126:404-413.
[6]Adams L K, Lyon D Y, Alvarez P J J. Comparative eco-toxicity of nanoscale TiO2, SiO2and ZnO water suspensions[J]. Water Res, 2006, 40(19):3527-3532.
[7]Oberd Ö E. Manufactured nanomaterials (fullerenes, C60)in-duce oxidative stress in the brain of juvenile largemouth bass[J]. Environ Health Perspect, 2012, 112(10):1058-1062.
[8]Yon J N, Jamie R L. Manufactured nano-particles: an overview of their chemistry, interactions and potential environmental implications[J]. Science of the Total Environment, 2008, 400:396-414.
[9]Hsiao I L, Huang Y J. Effects of various physicochemical characteristics on the toxicities of ZnO and TiO2nano particles toward human lung epithelial cells[J]. Science of the Total Environment, 2011, 409:1219-1228.
[10]Mortimer M, Kasemets K, Kahru A. Toxicity of ZnO and CuO nanoparticles to ciliated protozoaTetrahymenathermophila[J]. Toxicology, 2011, 269:182-189.
[11]Sharma V, Singh P, Pandey A K, et al. Induction of oxidative stress, DNA damage and apoptosis in mouse liver after sub-acute oral exposure to zinc oxide nanoparticles[J]. Mutation Research, 2012, 745:84-91.
[12]Peng X H, Palma S, Fisher N S, et al. Effect of morphology of ZnO nanostructures on their toxicity to marine algae[J]. Aquatic toxicology, 2011, 102:186-196.
[13]Menard A, Drobne D, Jemec A. Ecotoxicity of nanosized TiO2. review of in vivo data[J]. Science Emironmental pollution, Direct, 2011, 159:677-684.
[14]Chad S W, Lan P L, Collin C W, et al. Glutathione (GSH) and the GSH synthesis gene Gclm modulate vascular reactivity in mice[J]. Biology and Medicine, 2012, 53:1264-1278.
[15]田文静, 白 伟, 赵春禄, 等. 纳米ZnO对斑马鱼胚胎抗氧化酶系统的影响[J].中国环境科学,2010,30(5):705-709.
[16]Ahmad J, Ahamed M, Akhtar M J, et al. Apoptosis induction by silica nanoparticles mediated through reactive oxygen species in human liver cell line HepG2[J]. Toxicology and Applied Phamacology, 2012, 259:160-168.
[17]Govindasamy R, Rahuman A. Histopathological studies and oxidative stress of synthesized silver nanoparticles inMozambiquetilapia(Oreochromismossambicus)[J]. Journal of Environmental Science, 2012, 24(6):1091-1098.
[18]Wu J H, Liu W, Xue C B, et al. Toxicity and penetration of TiO2nanoparticles in hairless mice and porcine skin after subchronic dermal exposure[J]. Toxicology Letters, 2009, 191:1-8.
[19]Sathya V, Ramesh M, Poopal R K, et al. Acute and sublethal effects in an Indian major carpCirrhinusmrigalaexposed to silver nitrate: Gill Nat/Kt-ATPase, plasma electrolytes and biochemical alterations[J]. Fish & Shellfish Immunology, 2012, 32:862-868.
[20]Yohana M V S, Richard D H, Katherine A S. Endosulfan affects health variables in adult zebrafish (Daniorerio) and induces alterations in larvae development[J]. Comparative Biochemistry and Physiology, 2011, 153:372-380.
[21]Robert J G, Roxana W, Kelly A H, et al. Exposure to copper nanoparticles causes gill injury and acute lethality in zebra fish (Daniorerio)[J]. Environmental Science and Technology, 2008, 41(23):8178-8186.
[22]Ma L L, Liu J, Li N, et al. Oxidative stress in the brain of mice caused by translocated nanoparticulate TiO2delivered to the abdominal cavity[J]. Biomaterial, 2010, 31:99-105.
[23]Ye Y Y, Liu J W, Chen M C, et al. In vitro toxicity of silica nanoparticles in myocardial cells[J]. Enviromental Toxicology and Pharmacology, 2010, 29:131-137.
[24]Li Y X, Yu S H, Wu Q L, et al. Chronic Al2O3-nanoparticle exposure causes neurotoxic effects on locomotion behaviors by inducing severe ROS production and disruption of ROS defense mechanisms in nematodeCaenorhabditiselegans[J]. Journal of Hzardous Materials, 2012, 219-220:221-230.
[25]Bondarenko O, Ivask A, K kinen A, et al. Sub-toxic effects of CuO nanoparticles on bacteria: Kinetics, role of Cu ions and possible mechanisms of action[J]. Environmental Pollution, 2012,169:81-89.
[26]Song W H, Zhang J Y, Guo J, et al. Role of the dissolved zinc ion and reactive oxygen species in cytotoxicity of ZnO nanoparticles[J]. Toxicology Letters, 2010, 199:389-397.
