基于壳聚糖/碳纳米管/石墨烯/铁氰化镍纳米复合材料构建的电化学适体传感器用于凝血酶的检测
2014-10-19肖丽娟柴雅琴
肖丽娟,孙 娟,柴雅琴
(西南大学化学化工学院,重庆现代分析重点实验室,重庆400715)
0 引言
凝血酶是凝血过程中一种重要的丝氨酸蛋白酶,可以加速和巩固凝血过程,调控炎症和伤口愈合速度,其浓度和活性在许多发病机理如白血病,动脉血栓症等中占主导作用,对凝血酶的分析检测在医学、生物学上具有重要的意义[1]。在众多生物传感检测方法中,电化学适体传感器因具有灵敏度高、分析速度快、操作便利、成本低廉、易于实时监测等优点,可实现凝血酶的快速准确检测[2~3]。非标记型电化学适体生物传感器无需对适体进行标记,直接根据适体识别前后引起电阻、电流或电位的变化进行检测的传感器。这类传感器的优点是操作简单、实时检测方便、假信号率低,对适体的活性没有损伤[4~5]。
石墨烯(graphene)是一种由sp2杂化的单层碳原子以六边形排列形成的周期性蜂窝状二维碳质新材料。独特的二维结构使得石墨烯在力学、热学、电学等方面表现出优异的性能。例如石墨烯具有大的比表面积、超强的电子传导能力、优异的热导率和稳定性[6~7]。一维结构的碳纳米管(carbon nanotubes)也具有大的比表面积、超强的机械性能、良好的导电能力和吸附性能[8~9]。这些特点使得碳材料在作为电化学传感器的固载基质用于放大信号和提高检测灵敏度等方面展现出诱人的前景。
基于此,该文构建了一个高灵敏非标记型电化学适体传感器用于凝血酶的检测。壳聚糖(CS)由于其具有出色的分散能力和成膜能力[10],易于形成壳聚糖/碳纳米管/石墨烯/铁氰化镍 (CSCNTs-Gra-FP)纳米复合材料以提高电活性物质FP的固载量。其中,石墨烯和碳纳米管的加入,不仅增大了电极的比表面积,而且促进了电子的传输速率。其次,在适体传感器的制备过程中通过沉积方法引入纳米金粒子 (nano-Au)用于凝血酶适体的固载,nano-Au大的比表面积和强的催化能力能够起到放大电化学反应信号和降低检测限的作用[11]。根据此原理制备的适体传感器能够准确灵敏地检测凝血酶。
1 实验部分
1.1 仪器与试剂
CHI600a电化学工作站 (上海辰华仪器公司);超声波清洗仪DS-1510DT(上海生析超声仪器有限责任公司);实验采用的三电极体系,饱和甘汞电极(SCE)为参比电极,铂电极为辅助电极,修饰的玻碳电极(GCE,φ=4mm)为工作电极。
碳纳米管(CNTs)、石墨烯(Gra)(中国南京先丰纳米材料科技有限公司);壳聚糖(CS)、氯金酸(HAuCl4)、 铁氰化镍 (FP)(美国 Sigma 公司);NiCl2·6H2O、K3Fe(CN)6(中国四川化学制品公司);凝血酶适体(TBA)、凝血酶(TB)(中国大连宝生生物公司);牛血清蛋白(BSA)、甲胚蛋白(AFP)、癌胚抗原(CEA)(中国郑州博赛生物技术股份有限公司)。 磷酸缓冲溶液(PBS,pH=7.0,0.1 mol/L)由 0.1 mol/L Na2HPO4、0.1 mol/L KH2PO4、0.1 mol/L KCl配制而成。三羟甲基氨基甲烷-盐酸缓冲液(Tris-HCl,pH=7.4,20 mmol/L)用 140 mmol/L NaCl、5 mmol/L KCl、1 mmol/L MgCl2制备。 相关试剂均为分析纯,及时制备使用,实验用水均为二次蒸馏水。
1.2 铁氰化镍的制备
铁氰化镍的合成步骤如下:首先,将20 mL 0.01 mol/L NiCl2溶液逐滴加到 20 mL 含有 0.05 mol/L KCl的 0.05 mol/L K3Fe(CN)6溶液中,滴加完毕后,继续剧烈搅拌5min。然后,将所得混合液立即进行高速离心并用二次蒸馏水洗涤几次。最后,将黄色沉淀物分散在 20 mL PBS(pH=7.0)的溶液中,密封备用。
1.3 CS-CNTs-Gra-FP纳米复合材料的制备
首先,分别取碳纳米管1 mg、石墨烯1 mg,将其分散在2 mL 0.5 mg/mL的壳聚糖溶液中。将得到的混合物超声处理几个小时以获得均匀分散的CS-CNTs-Gra复合物。随后,将CS-CNTs-Gra复合物与铁氰化镍(FP)以1∶5的比例混合均匀,得到CS-CNTs-Gra-FP纳米复合材料。
1.4 适体传感器的制备
分别 用 粒径为 0.3 μm 和 0.05 μm 的 Al2O3粉把玻碳电极(GCE)抛光成镜面,然后用二次蒸馏水、无水乙醇、二次蒸馏水超声洗涤5 min,清洗后的电极置于室温下晾干。
首先,用5 μL CS-CNTs-Gra-FP对电极进行修饰,在室温晾干成膜后,将电极浸没在1%的HAuCl4溶液中,用电化学沉积的方法在电极表面修饰上一层纳米金(nano-Au)。随后,在该电极上滴加 20 μL TBA(2 μmol/L),在室温下孵育 16 h。再滴加20 μL BSA (1%),在室温下孵育40 min以封闭电极表面的非特异性吸附位点。最后,滴加20 μL不同浓度的TB,室温下孵育50 min,即可用于实验检测。该适体传感器的制备过程示意图如图1。
1.5 实验方法
该实验测量电极电流采用三电极系统:将制备好的电化学适体传感器作为工作电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极。采用循环伏安法(CV)对电极的制备过程进行检测。以 2 mL PBS(pH=7.0)缓冲液作为检测底液,扫描电位在 0.1~0.8 V 范围内, 以 100 mV/s的速度进行循环伏安扫描,实验均在室温条件下进行。
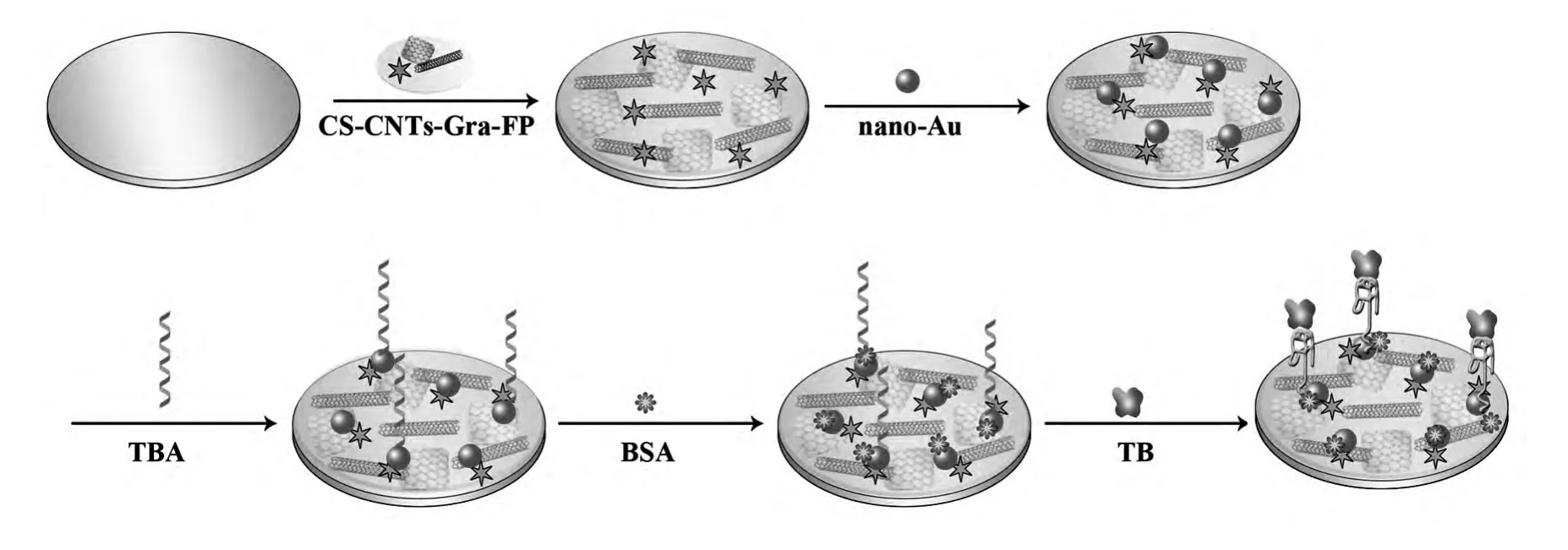
图1 适体传感器的制备过程Fig.1 The fabrication progress of the electrochemical aptasensor
2 结果与讨论
2.1 适体传感器的电化学表征
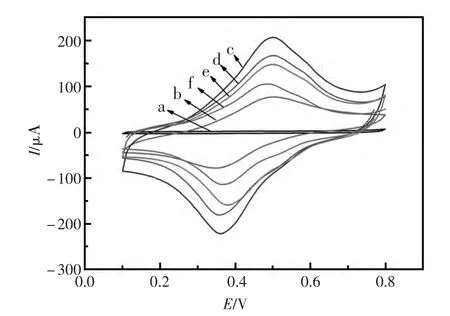
图2 电极在0.1 mol/L PBS(pH=7.0)溶液中的循环伏安表征曲线。(a)裸的玻碳电极;(b)CS-CNTs-Gra-FP修饰的电极;(c)nano-Au/CS-CNTs-Gra-FP修饰的电极;(d)固定了TBA的电极;(e)经BSA封闭的电极;(f)与TB孵育后的电极Fig.2 The CVs of different modified electrodes in 0.1 mol/L PBS solution(pH=7.4);(a)GCE,(b)CS-CNTs-Gra-FP/GCE,(c)nano-Au/CS-CNTs-Gra-FP/GCE,(d)TBA/nano-Au/CSCNTs-Gra-FP/GCE,(e)BSA/TBA/nano-Au/CS-CNTs-Gra-FP/GCE,(f)TB/BSA/TBA/nano-Au/CS-CNTS-Gra-FP/GCE
为了研究修饰电极表面电化学性质的变化,采用循环伏安法(CV)对不同步骤下的电极进行了电化学表征,如图2所示。曲线a为裸电极的循环伏安图,因无电活性物质,故无氧化还原峰;当CS-CNTs-Gra-FP复合物修饰到电极表面后,在0.4 V左右出现一对可逆性好的氧化还原峰(曲线b);曲线c表示nano-Au修饰后电极的循环伏安图,因为nano-Au易于传输电子,所以峰电流值增大;孵育TBA后的电极,峰电流值明显降低 (曲线d),这是由于TBA阻碍了电子的传递;当用大分子蛋白质BSA封闭电极上的非特异性吸附位点后,峰电流值进一步减小(曲线e);曲线f为孵育10 nmol/L TB后电极循环伏安图,由于TB对电极表面电子传输的进一步阻碍,使得氧化还原峰电流值再次减小。
2.2 不同扫描速度对适体传感器的影响
将已完整修饰的电极在pH=7.0的PBS检测液中用循环伏安法进行变速扫描,扫描速度改变,相应的峰电流值也发生变化。扫描速度与相对应的峰电流值的关系如图3(从内至外的扫描速 度 依 次 为 10、20、50、80、100、120、150、180、200、250、300、350、400 mV/s)。 由图可知,随着扫描速度从10 mV/s~400 mV/s不断变化,峰电流值也不断增大,且与扫描速度的平方根成正比,说明电极表面呈扩散控制。
2.3 适体传感器的电流响应特性
用 pH=7.4的 Tris-HCl溶液配置浓度为0.01、0.1、1、5、10、15、20、30 nmol/L 的 凝 血 酶 溶液。由低浓度到高浓度依次向BSA封闭后的电极滴加20 μL凝血酶溶液,各孵育50 min后,置于pH=7.0的PBS溶液中进行CV测定,测定结果如下所示:
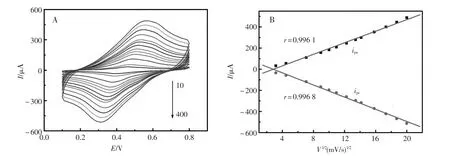
图3 (A)不同扫描速度对适体传感器的影响(B)峰电流和扫描速度平方根的线性关系Fig.3 (A)Cyclic voltammograms of the electrochemical aptasensor at different scan rate;(B)The plot of redox peak currents vs.square root of scan rate
由图4可以看出,在测定不同浓度的TB溶液时,峰电流的信号有了不同程度的减弱。其原因是TB是蛋白质大分子,并且与TBA特异性结合,阻碍了电子的传输,使得电流响应信号减小。图4表明TB浓度在0.01~30 nmol/L范围内,该适体传感器的峰电流值与其具有良好的线性关系,线性方程为:I/μA=22.01 g(c/(nmol/L))-135.4,相关系数r=0.999 6,检测下限为 0.003 nmol/L。
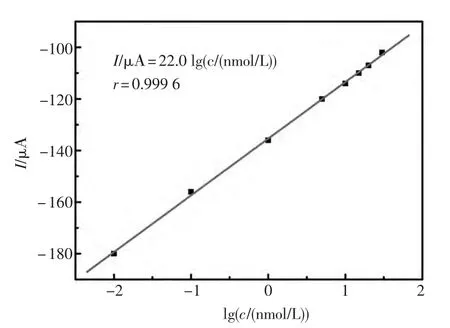
图4 适体传感器对不同浓度的TB的定量检测Fig.4 Quantitative analysis of the aptamsensor for TB
2.4 适体传感器稳定性的测定
在扫描速度为100 mV/s下,将BSA封闭后的电极在PBS检测液中进行100圈循环伏安扫描。得到的循环伏安曲线如图5所示:峰电流值变化值为3.23%(<5%),表明电极具有良好的稳定性。主要原因是由于CS-CNTs-Gra-FP纳米复合物以及金纳米粒子单层膜修饰的电极具有良好的稳定性。
2.5 适体传感器选择性的测定
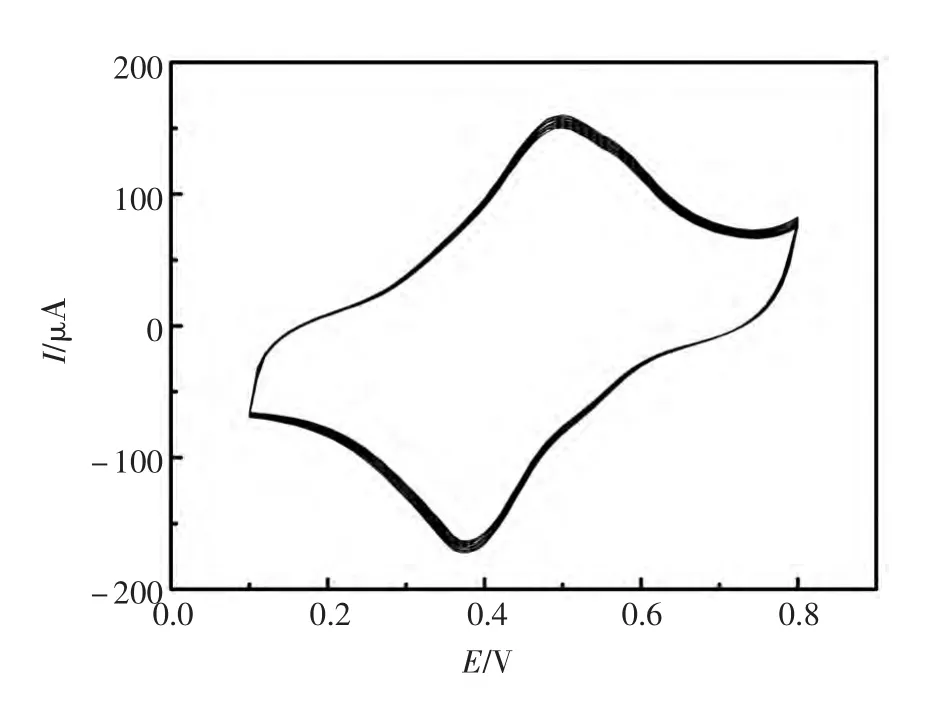
图5 适体传感器稳定性的测定Fig.5 Stability analysis of the electrochemical aptasensor
为了研究适体传感器的选择性,选用了三种可能的干扰蛋白物质BSA、CEA、AFP进行测定。修饰电极表面分别与 20 μL BSA+TB、CEA+TB、AFP+TB、TB(10 nmol/L)、Tris(pH=7.4)孵育 50 min。然后将上述电极置于pH=7.0的PBS检测液中进行循环伏安测定,结果如图6所示:Tris-HCl溶液孵育后的电极峰电流值基本没发生改变,与上一步BSA封闭后的电极峰电流值差距ΔI很小,说明其对该适体传感器的干扰性较小,或是无干扰。 而 BSA+TB、CEA+TB、AFP+TB、TB孵育后的电极峰电流值与上一步BSA封闭后的电极峰电流值差距很大,但其峰电流值相差不大,归因于TB阻碍了电子的传递,使得电流响应信号减小,峰电流值也相应地减小,因此可以认为BSA、CEA、AFP对该适体传感器的干扰性较小。综上所述,该适体传感器具有良好的选择性。
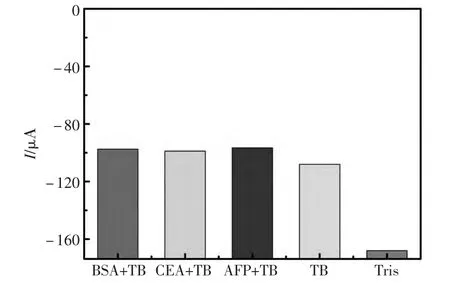
图6 适体传感器选择性的测定Fig.6 Selectivity determination of the electrochemical aptasensor
2.6 适体传感器的应用
为了评估所构建的电化学适体传感器在临床诊断的可行性,用标准添加的方法做了回收率实验。即将人体血清与Tris-HCl溶液按1∶50的比例进行稀释,然后用稀释后的人体血清配制浓度成不同浓度的凝血酶溶液。结果如表1所示:回收率为90%~110%,在可接受的范围内。实验表明该适体传感器在临床诊断中具有一定的实际应用价值。
3 结论
该文成功构建了一个非标记型电化学适体传感器用于凝血酶的高灵敏检测。其中CSCNTs-Gra-FP纳米复合材料提高了电活性物质FP的固载量,增强了电极的电化学响应。碳纳米管、石墨烯和纳米金的引入不仅增大了电极的比表面积,也增强了电子的传输速率,从而有效提高了该传感器的灵敏度。此外,该传感器还具有稳定性好、特异性强、灵敏度高、检测限低等优点。

表1 人体血清样品的加标回收Tab.1 The recovery of human serum samples
[1]Alisa S W.Thrombin generation and fibrin clot[J].Blood Rev.,2007,21(3):131~142.
[2]李晓霞,申丽华,漆红兰.适体电化学生物传感器研究进展 [J].中国学术期刊电子出版社, 2007,26(12):19~33.
[3]Teles F R R,Prazeres D M F,Lima-Filho J L.Rev.Trends in dengue diagnosis[J].Med.Virol.,2005,15(5):287~302.
[4]陶满兰,胡银香,谭林,等.适体生物传感器研究进展[J].中国学术期刊电子出版社,2008,35(6):65~157.
[5]Xiao Y,Lubin A A,Heeger A J,et al.Label-free electronic detection of thrombin in blood serum by using an aptamer-based sensor[J].Angew.Chem.Int.Ed.,2005,44(34):5 456~5 459.
[6]Meyer J C,Geim A K,Novoselov K S,et al.The structure of suspended graphene sheets[J].Nature,2007,446:60~63.
[7]Novoselov K S,Geim A K,Morozov S V,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5696):666~669.
[8]Mahmood M S,Roham R.Investigation of nanotube length effect on the reinforcement efficiency in carbon nanotube based composites[J].Steel.Compos.Struct.,2010,92(10):2 415~2 420.
[9]Valcárcel M,Cárdenas S,Simonet B M.Role of Carbon Nanotubes in Analytical Science[J].Anal.Chem.,2007,79(13):4 788~4 797.
[10]Zhang M G,Smith A,Gorski W.Carbon Nanotube Chitosan System for Electrochemical Sensing Based on Dehydrogenase Enzymes[J].Anal.Chem.,2004,76(17):5 045~5 050.
[11]赵建军,刘卫卫,潘勇,等.纳米Au修饰电化学传感器直接检测液相中沙林的研究 [J].化学传感器,2011,31(1):43~47.
