吉西他滨脂质衍生物聚合物胶束的制备及其理化性质和抗肿瘤活性
2014-03-23杜丽娜金义光
左 靖,杨 明,李 淼,杜丽娜,金义光
(1.安徽医科大学研究生学院,安徽合肥 230032;2.军事医学科学院放射与辐射医学研究所药物化学研究室,北京 100850;3.北京化工大学生命科学与技术学院,北京 100029)
吉西他滨脂质衍生物聚合物胶束的制备及其理化性质和抗肿瘤活性
左 靖1,2,杨 明3,李 淼2,杜丽娜2,金义光1,2
(1.安徽医科大学研究生学院,安徽合肥 230032;2.军事医学科学院放射与辐射医学研究所药物化学研究室,北京 100850;3.北京化工大学生命科学与技术学院,北京 100029)
目的制备吉西他滨(Gem)脂质衍生物及其聚合物胶束,克服Gem体内易失活、不能口服和无靶向性的缺陷。方法合成N-苯甲酰-3′-乙酰吉西他滨(BAG)。用注入法制备载BAG的泊洛沙姆188胶束(BAG∶泊洛沙姆188=10∶1,mol/mol);用激光粒度和电位仪测定胶束的粒度和Zeta电位;胶束用负染法透射电镜法观察胶束微观形态。Gem或BAG聚合物胶束5,10,20,30,50,70和90μmol·L-1与人乳腺癌细胞MCF-7培养24,48和72 h,用MTT法测定对MCF-7细胞生长的抑制率。肝癌细胞H22移植瘤小鼠分别iv或ig给予Gem 40 m g·kg-1或BAG聚合物胶束62 m g·kg-1,间隔2 d给药1次,共3次,末次给药后第2天处死小鼠,测定抑瘤率。结果经薄层色谱法、核磁共振氢谱和碳谱、红外光谱和质谱验证,BAG的结构正确。BAG聚合物胶束外观为淡蓝色乳光的透明溶液,粒径为62.82 nm,Zeta电位为-18.8 m V,电镜下呈现球状均匀分布。MTT法实验结果表明,Gem和BAG聚合物胶束分别与MCF-7细胞培养24,48和72 h,其抑制MCF-7细胞生长的IC50分别为40.6和90.0,5.0和14.9,5.0和13.6μm o l·L-1。体内实验结果表明,Gem口服和注射组与模型对照组比较(P<0.01)、BAG聚合物胶束口服和注射组与泊洛尔姆188空白胶束组比较(P<0.05,P<0.01)均具有明显的抑瘤作用;作用强度,BAG聚合物胶束口服优于Gem口服(P<0.05),BAG聚合物胶束注射优于其口服(P<0.05),BAG聚合物胶束注射与Gem注射作用相当。结论Gem脂质衍生物能载入泊洛沙姆188聚合物胶束内。BAG聚合物胶束体外对MCF-7细胞生长有抑制作用,iv和ig给药对小鼠H22移植瘤均具有抑瘤作用。BAG聚合物胶束口服优于Gem口服,提示BAG聚合物胶束有望开发成为新型的抗肿瘤口服制剂。
吉西他滨;脂质衍生物;聚合物胶束;抗肿瘤药
DO l:10.3867/j.issn.1000-3002.2014.03.017
目前,抗肿瘤药物由于缺乏体内分布的特异性,在正常组织分布较多,致使毒性作用显著。肿瘤组织血管内皮细胞间隙大,对生物大分子和纳米颗粒的渗透性增强,同时肿瘤组织淋巴循环差,使渗透进入肿瘤的生物大分子及纳米颗粒滞留增强,称为增强渗透和滞留效应,成为肿瘤靶向纳米系统设计的基础[1-2],如脂质体[3-4]、纳米粒[5-6]、纳米脂质载体[7]和聚合物胶束[8-9]等。上市药物如注射用紫杉醇脂质体(力朴素Ⓡ)、盐酸多柔比星脂质体注射液(格莱Ⓡ)和注射用紫杉醇白蛋白纳米粒(AbraxaneⓇ)均具有良好肿瘤靶向治疗作用,减小了毒性作用。
核苷类药物被细胞摄取后干扰DNA和RNA复制,使细胞代谢和增殖周期中断,广泛用于抗肿瘤治疗。吉西他滨(gem citabine,Gem)是一线核苷类抗肿瘤药,临床上用于治疗胰腺癌和乳腺癌等多种恶性肿瘤[10]。Gem进入细胞后经脱氧胞嘧啶核苷激酶磷酸化,转化成具有活性的二磷酸核苷及三磷酸核苷发挥抗肿瘤作用。体内普遍存在的胞嘧啶核苷脱氨酶能将Gem迅速脱氨基化而失活。因此,减少或避免脱氨基化成为Gem衍生化研究的热点[11]。本研究合成了Gem 脂质衍生物 N-苯甲酰-3′-乙酰吉西他滨(N-benzoy-3′-acetylgem citabine,BAG),制备载BAG的泊洛沙姆188(P188)胶束,测定其粒径、表面电位及载药量,评价其体内外抗肿瘤作用。
1 材料与方法
1.1 药物、试剂和仪器
Gem,C9H11F2N3O4,纯度99.6%,北京凯莱森医药科技有限公司,批号20110203,临用前用生理盐水溶解;苯甲酸酐、叔丁基二甲基氯硅烷、咪唑和三水合四丁基氟化铵(TBAF·3H2O)均购自北京偶合科技有限公司;乙酸酐,国药集团化学试剂有限公司;乙酸(含量≥99.5%),国药集团化学试剂有限公司;P188,德国巴斯夫公司;除HPLC分析所用试剂为色谱纯外,其余试剂均为分析纯;反应溶剂均经脱水处理。JNM-ECA-400型超导核磁共振仪,日本电子株式会社;LCQ Max型质谱仪,美国Finnigan公司;H-7650型透射电镜,AMT cam era system,80 kV,日本Hitachi公司;Zetasizer Nano ZS型激光粒度和电位仪,英国Malvern公司;MinitroughⅡ型Langmuir膜天平,芬兰KSV公司;L-2310型高效液相色谱仪,日本Hitachi公司;VenusilMP C18柱(5μm,250 mm×4.6 mm),天津博纳艾杰尔科技有限公司。
1.2 细胞和动物
人乳腺癌MCF-7细胞来自北京化工大学。SPF级昆明小鼠45只,20~24 g,雄性,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2012-0001。
1.3 吉西他滨脂质衍生化
Gem脂质衍生化主要在酰胺键和糖环上4位羟基进行脂质化,合成步骤参考阿糖胞苷衍生化路线[12]。具体反应过程如下:称取Gem 0.2638 g(1 mmol)溶于50 m L乙醇,80℃搅拌回流5 m in,加苯甲酸酐0.2728 g(1.2 mm o l)继续反应1 h,以后每小时加入苯甲酸酐1.2 mm ol,共加3次,最后1次加入后,继续回流反应1 h。旋蒸除去溶剂后得粗产物。用二氯甲烷溶解粗产物后在硅胶柱上分离,收集带有产物点的洗脱液,除溶剂,得N-苯甲酰-吉西他滨(N-benzoyl gemcitabine,BG)白色粉末,产率71%。取BG 0.1835 g(0.5 mmol)、咪唑0.1126 g(1.6 mm ol)溶于6 m L N,N-二甲基甲酰胺,加入叔丁基二甲基氯硅烷0.1388 g(0.9 mm ol),加干燥管后室温搅拌72 h,加入6 m L甲苯共沸,除溶剂,得透明油状物。用体积分数2%甲醇氯仿溶液溶解油状物后,在硅胶柱上分离,收集带有产物点的洗脱液,除溶剂,得N-苯甲酰-4-叔丁基二甲基硅烷吉西他滨(N-benzoyl-4-tert-butyl dimethyl silyl gem citabine,BTG)白色颗粒。BTG 0.2112 g(0.4 mm o l)溶于12 m L无水吡啶,加乙酸酐(5.3 m L)室温搅拌24 h,除溶剂,残渣用体积分数2%甲醇氯仿溶液溶解后柱层析纯化,得N-苯甲酰-3′-乙酰-4-叔丁基二甲基硅烷吉西他滨(N-benzoyl-3′-acetyl-4-tert-butyl dimethyl silyl gem citabine,BATG)白色糊状物。取TBAF·3H2O 1.5575 g(5 mmo l)溶于5 m L四氢呋喃。另取BATG 0.1511 g(0.28 mm o l)溶于上述TBAF溶液中,室温反应10 m in后,加入乙酸0.1 m L,继续搅拌2 h,除溶剂,得淡黄色油状物,在硅胶柱上分离,得终产物N-苯甲酰-3′-乙酰吉西他滨(N-benzoy-3′-acetylgem citabine,BAG)白色粉末(图1)。
1.4 吉西他滨脂质衍生物结构鉴定
1.4.1 色谱法
参照《中国药典》第二部(2010版)附录V B薄层色谱法,吸取BAG甲醇溶液和Gem水溶液10μL,点于硅胶G薄层板上,以氯仿∶甲醇(9∶1,V/V)为展开剂,展开至接近薄层板上缘处取出,晾干,在254 nm紫外灯下观察物质斑点,计算比移值(Rf)。Rf=点样原点至斑点中心距离/点样原点至溶剂前沿距离。

Fig.1 Synthetic route o f N-benzoy-3′-acetyl-gem citabine(BAG).Gem:gem citabine;BG:N-benzoyl gem citabine;BTG:N-benzoyl-4-tert-butyl dimethyl silylgem citabine;BATG:N-benzoyl-3′-acetyl-4-tert-butyldimethyl silylgem citabine;BAG:N-benzoy-3′-acetyl-gem citabine.
1.4.2 光谱法
取BAG 20 mg·L-1甲醇溶液和Gem 20 mg·L-1水溶液,依《中国药典》第二部(2010版)附录ⅣA紫外可见分光光度法检测最大吸收波长。按照常规光谱检测方法,对BAG进行核磁共振氢谱、核磁共振碳谱、红外光谱和质谱的检测。
1.5 BAG聚合物胶束制备和理化性质测定
取BAG 0.025 g和P188 0.050 g(BAG∶P188=10∶1,m o l/m o l)溶于5 m L四氢呋喃中,得到5 g·L-1的BAG四氢呋喃溶液,取2 m L用100μL的微量注射器分次注入到涡旋振荡的2 m L水中,37℃水浴加热除去溶剂和部分水分。用2%磷钨酸溶液对胶束进行负染,透射电镜观察聚合物胶束微观形态。用激光粒度仪测定聚合物胶束粒径分布和Zeta电位。空白聚合物胶束制备同上,只注入含P188的乙醇/四氢呋喃(5∶1,V/V)溶液到水中,水浴加热除溶剂。
1.6 测定BAG聚合物胶束载药量
建立HPLC法测定BAG。色谱条件如下:VenusilMP C18柱(5μm,250 mm×4.6 mm);柱温:30℃;流动相:甲醇∶水(90∶10,V/V);流速:1 m L·m in-1;进样量:20μL;检测波长:261 nm。BAG的保留时间为4 m in。取5 mg BAG溶于5 m L THF,得1 g·L-1BAG标准贮备液,用甲醇稀释至0.5,1,10,20,50,70和100 mg·L-1。以峰面积(A)对浓度(c)作图,标准曲线方程为A=74337c-37047(R2=0.999)。将BAG聚合物胶束用甲醇稀释100倍,过0.22μm滤膜,取续滤液,测定聚合物胶束中BAG含量。BAG聚合物胶束的载药量(%)=〔BAG(m g)/BAG(m g)+P188(mg)〕×100%。
1.7 BAG聚合物胶束体外抑瘤活性评价
将人乳腺癌细胞MCF-7用DMEM培养液稀释至1×107L-1,接种于3块96孔板,每孔200μL,于5%CO2,37℃饱和湿度培养箱培养24 h后,加入不同浓度Gem水溶液和BAG胶束溶液,两者分别以水和空白聚合物胶束溶液作为对照。Gem和BAG聚合物胶束的终浓度分别为5,10,20,30,50,70和90μmol·L-1。培养24,48和72 h后,除去培养液,每孔加MTT溶液20μL,4 h后加150μL二甲亚砜溶液溶解,于酶标仪590 nm处测各孔A590nm,计算细胞生长抑制率[13]。抑制率(%)=(对照组A590nm-实验组A590nm)/对照组A590nm×100%。
1.8 BAG聚合物胶束体内抑瘤活性评价
无菌条件下抽取荷肝癌细胞H22小鼠腹水,生理盐水稀释至2×1010L-1。小鼠皮下接种0.2 m L H22细胞于右前侧腋下,7 d后腋下有隆起肿瘤硬块即为建模成功。取肿瘤大小均匀的小鼠,随机分为6组,模型组(iv给予等体积生理盐水)、模型+P188空白胶束组(尾静脉iv,40 m g·kg-1)、模型+Gem注射组(尾静脉iv,40 m g·kg-1)、模型+Gem口服组(ig,40 mg·kg-1)、模型+BAG聚合物胶束注射组(尾静脉iv,62 mg·kg-1,与Gem 40 mg·kg-1等量)和模型+BAG聚合物胶束口服组(ig,62 mg·kg-1),每组6只。间隔2 d给药1次,共3次。末次给药后第2天处死,取出肿瘤,称瘤湿重,计算抑瘤率。抑瘤率(%)=(正常对照组平均瘤重-给药组平均瘤重)/正常对照组平均瘤重×100%。
1.9 统计学分析
2 结果
2.1 BAG结构确认
BAG的氢谱、碳谱、红外光谱和质谱结果如下:1H NMR(400 MHz,DMSO-d6)δ(ppm):2.100(s,3H,O-CO-CH3),4.356(s,1H,OH),5.768(t,1H),7.510-7.548,8.005-8.026(m,6H,5-CH,苯基),8.001(s,1H,NH),11.448(t,1H);13C NMR(100 MHz,DMSO-d6)δ(ppm):21.0(CH3),59.0(-CH2OH),121.5(-CF2-),128.5-133.0(苯基),167.3,169.1(-CO-);FT-IR(KBr,cm-1):3489.4(-CH2OH),3387.7(C-NH);3143.4-3077.2,840.7,710.5(=CH),2964.2-2941.8(CH2,CH3),1749.9(-COO-),1712.6(-CO-),1656.9(-CO-NH-);ESI-MS(+)m/z:410.11(M+H)+,432.15(M+Na)+;ESI-MS(-)m/z:408.10(M-H)+。BAG是在Gem氨基基团和糖环4-OH上分别连接苯甲酰和乙酰基。因为BAG的1H NMR,13C NMR及红外光谱均显示有甲基基团、-CO-NH-基团和苯环特征峰,表明BAG合成成功。
薄层色谱法验证BAG的Rf为0.8,而Gem的Rf为0,前者呈较强非极性,与其结构相对应。BAG的最大吸收波长为261 nm,而Gem为258 nm。两者相近又不同,表明它们的母核相同,但具体结构不同。
2.2 BAG聚合物胶束的理化性质
BAG是脂溶性分子,可插入P188胶束的疏水性内核中。透射电镜显示,BAG聚合物胶束呈球状,分布均匀(图2)。BAG聚合物胶束粒径为62.82 nm,分布较均匀(图3A);Zeta电位为-18.8 m V(图3B)。虽然BAG聚合物胶束的表面电位较小,但聚合物胶束外层为长链的聚氧乙烯,阻止了胶束聚集和融合,保证了稳定性。BAG聚合物胶束载药量为(32.83±1.15)%,可满足给药需求。
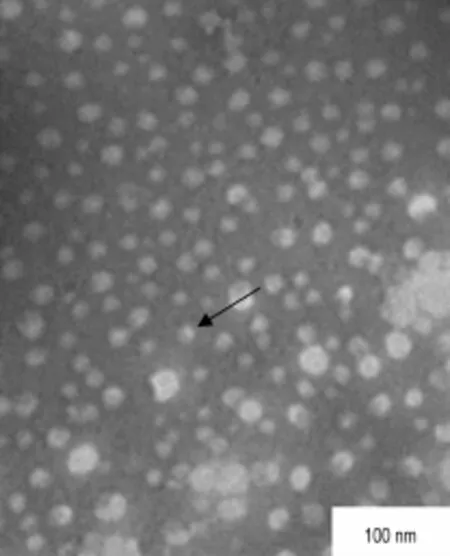
Fig.2 Negatively-stained transm ission elec tron m icroscope image o f BAG po lymeric m icelles.The arrow shows BAG polymeric m icelles.The morphology of BAG polym eric m icelles was spheres and m icelles distributed evenly.

Fig.3 Size d istribu tion(A)and zeta po ten tia l(B)o f BAG po lym eric m icelles.The measurement was performed on Malvern Zetasizer Nano ZS using the laser dynam ic light scattering m ethod.The peak of num ber m ode size distribution was 68.62 nm.The zeta potentialwas 18.8 m V.
2.3 BAG聚合物胶束体外对人乳腺癌MCF-7细胞的抑制作用
MTT实验结果(图4)表明,Gem或BAG聚合物胶束0~90μmol·L-1(0浓度的BAG聚合物胶束表示空白聚合物胶束)与人乳腺癌细胞MCF-7培养24,48和72 h,抑制细胞生长的IC50分别为40.6和90.0,5.0和14.9,5.0和13.6μmol·L-1,表明Gem体外对MCF-7细胞生长的抑制作用强于BAG聚合物胶束。另外,空白聚合物胶束在72 h内的细胞抑制率均<10%,表明空白胶束的细胞毒性很小,BAG聚合物胶束对MCF-7细胞抑制作用主要来源于BAG分子。

Fig.4 lnhibition o f BAG po lymeric m icelles and Gem so lu tion on MCF-7 cells in cubated fo r 24(A),48(B)and 72 h(C).,n=3.*P<0.05,**P<0.01,compared with BAG polym eric m icelles group of the same concentration.
2.4 BAG聚合物胶束体内对肝癌细胞H22移植瘤小鼠的抗肿瘤作用
由表1可见,① 与模型对照组比较,模型+P188空白胶束(iv)、模型+Gem口服和模型+Gem注射组瘤重明显减轻(P<0.01);与模型+P188空白胶束(iv)组比较,BAG聚合物胶束口服和注射组瘤重亦明显减轻(P<0.05,P<0.01);表明P188空白胶束、Gem口服和注射及BAG聚合物胶束口服和注射对H22移植瘤均具有明显的抑瘤作用。②与模型+Gem口服组比较,模型+BAG聚合物胶束口服组瘤重减轻(P<0.05),抑瘤率达47.1%,表明BAG聚合物胶束口服抑瘤作用强于Gem口服给药。③与模型+BAG聚合物胶束口服组比较,BAG聚合物胶束注射给药抑瘤作用更明显(P<0.05)。④与模型+Gem注射组比较,模型+BAG聚合物胶束注射组瘤重无显著性差异,两组抑瘤率均达到80%以上,表明BAG聚合物胶束静脉给药其抑瘤作用与Gem相当。

Tab.1 Tum o r inhib ition o f BAG po lym eric m ice lles and Gem on hepatoma cells H22xenograft in m ice
3 讨论
本研究设计并合成了Gem脂质衍生物BAG,用注入法制备得到高度分散、均匀的含P188的BAG聚合物胶束。聚合物胶束常采用透析法[14-15]、薄膜分散法[16]和固体分散法[17]等方法制备。透析法制备时间长,换液频繁,药物易泄漏;因脂质衍生物形成的膜亲水性差,不易分散于水,所以用薄膜分散法制备也比较困难;固体分散法对药物和载体要求较高,不易实现。本研究采用本实验室经典的涡旋注入法[18-19],能有效分散药物,可得到均匀混悬液,且耗时短,工艺简单。一般认为粒子的zeta电位绝对值大于30 m V时,由于静电相斥作用使体系较稳定。虽然载BAG的P188胶束zeta电位为-18.8 m V,但泊洛沙姆结构中亲水性聚氧乙烯长链有利于胶束稳定,减少了聚集和融合。
体外实验结果表明,Gem和BAG聚合物胶束与MCF-7细胞作用48和72 h,在浓度<30μmol·L-1时,BAG聚合物胶束对MCF-7细胞的抑制作用明显小于Gem;但当浓度>30μmo l·L-1时,BAG聚合物胶束对MCF-7细胞的抑制作用与Gem相当。因此推测,BAG聚合物胶束发挥细胞毒性作用必须达到一定时间和浓度。一定时间是指有足够时间BAG可解离成Gem,一定浓度指有足够量Gem的产生。该结果也证明了BAG必须生成Gem后才能发挥对MCF-7细胞生长的抑制作用。同时表明,BAG可能会产生缓释效应。由于细胞培养液中酶很少,使BAG的降解缓慢。BAG进入体内后,酶活性较强,可能较快释放出活性分子。同一浓度BAG聚合物胶束在48和72 h药效均明显高于24 h,说明BAG聚合物胶束有缓释作用,这是其优势之一。
据报道,H22荷瘤雌性小鼠肿瘤重量和体积均明显大于雄性小鼠[20],为充分体现药效,避免肿瘤体积过大,本研究体内抑瘤实验选用雄性小鼠。研究结果表明,P188空白胶束静脉注射后也具有一定抑瘤作用,这主要是由于泊洛沙姆作为非离子型表面活性剂,能增加细胞膜流动性、消耗ATP并抑制药物外排有关[21]。载药后,抑瘤作用进一步增强。静脉注射给药时,BAG聚合物胶束抑瘤作用与等剂量Gem相当,口服给药时抑瘤作用明显优于Gem口服给药。目前临床上Gem不能口服,原因是药物很容易在胃肠道中失活。而Gem脂质衍生化后,不存在脱氨基反应,因此可能增加了药物的胃肠道吸收。BAG聚合物胶束口服给药时,药效虽不及注射给药,但仍有一定抑瘤作用,这为Gem脂质衍生物口服给药应用提供了实验依据。给药前随机分组,给药后小鼠体质量均有所增加,但无统计学差异(数据略),表明BAG聚合物胶束毒性较小。
目前Gem上市制剂为其盐酸盐注射剂,无法口服。Gem注射剂在体内降解快,毒性大,患者依从性差。口服BAG聚合物胶束有较明显抑瘤作用,为基于Gem的药物治疗提供了口服给药可能。下一步将改进Gem衍生化路线,以增强口服给药效果且达到缓释目的,同时研究其体内药动学特征。本研究为Gem的肿瘤靶向治疗和制备口服制剂提供了一种新思路,有较好的临床应用前景。
[1] Maeda H.The enhanced perm eability and reten-tion(EPR)effect in tumor vasculature:the key role of tumor-selectivemacromolecular drug targeting[J].Adv Enzyme Regul,2001,41:189-207.
[2] Mitra S,Gaur U,Ghosh PC,Maitra AN.Tum our targeted de livery o fencapsulated dextran-doxorubicin con jugate using chitosan nanoparticles as carrier[J].J Control Release,2001,74(1-3):317-323.
[3] Paolino D,Cosco D,Racanicchi L,Trapasso E,Celia C,Iannone M,et al.Gem citabine-loaded PEGylated unilamellar liposomes vs GEMZAR:biodistribution,pharmacokinetic features and in vivo antitumor activity[J].J Control Release,2010,144(2):144-150.
[4] Du B,LiY,Li X,A Y,Chen C,Zhang Z.Preparation,characterization and in vivo evaluation of 2-methoxyestradiol-loaded liposom es[J].Int J Pharm,2010,384(1-2):140-147.
[5] She W,Li N,Luo K,Guo C,Wang G,Geng Y,et al.Dendronized heparin-doxorubicin con jugate based nanoparticle as pH-responsive drug delivery system for cancer therapy[J].Biomate ria ls,2013,34(9):2252-2264.
[6] Fadel M,Kassab K,Fadeel DA.Zinc phthalocyanine-loaded PLGA biodegradab le nanoparticles for photodynam ic therapy in tumor-bea ring m ice[J].Lasers Med Sci,2010,25(2):283-292.
[7] Liu L,Tang Y,Gao C,LiY,Chen S,Xiong T,et al.Charac terization and biodistribution in vivo of quercetin-loaded cationic nanostructured lipid carriers[J].Colloids Surf B Biointerfaces,2014,115:125-131.
[8] Mu CF,Balakrishnan P,Cui FD,Yin YM,Lee YB,ChoiHG,et al.The effects ofm ixed MPEGPLA/Pluronic copolymer m icelles on the bioavailability and multidrug resistance of docetaxel[J].Biomaterials,2010,31(8):2371-2379.
[9] Coimbra M,Rijcken CJ,Stigter M,Hennink WE,Storm G,Schiffelers RM.An titumor efficacy of dexamethasone-loaded core-crosslinked polymeric m icelles[J].J Control Release,2012,163(3):361-367.
[10] W ang XJ.Progerss on clinical research of cem citabine[J].J Oncol(肿瘤学杂志),2005,11(1):69-71.
[11] Moysan E,Bastiat G,Benoit JP.Gem citabine versus Modified Gem citabine:a review of several prom ising chem icalmodifications[J].Mol Pharm, 2013,10(2):430-444.
[12] Alexander RL,Morris-Natschke SL,Ishaq KS,Flem ing RA,Kucera GL.Synthesis and cytotoxic ac tivity of two novel 1-dodecylthio-2-decyloxypropyl-3-phosphatidic acid conjugates with gemcitabine and cytosine arabinoside[J].JMed Chem,2003,46(19):4205-4208.
[13] Wei M,Xiao Y.Nephrotoxicity o f gem citabine on human breast cancer cell MCF-7 and human ermbryonic kidney cell 293 in vitro[J].Chin Hosp Pharm J(中国医院药学杂志),2011,31(8):632-635.
[14] Sezgin Z,Yüksel N,Baykara T.Preparation and characterization of polymeric m icelles for solubilization of poorly soluble anticancer drugs[J].Eur J Pharm Biopharm,2006,64(3):261-268.
[15] Shiraishi K,Kawano K,Minowa T,Maitani Y,Yokoyama M.Preparation and in vivo imaging o f PEG-poly(L-lysine)-based polymeric m icelle MRI contrastagents[J].JContro lRelease,2009,136(1):14-20.
[16] Wei Z,Hao J,Yuan S,Li Y,Juan W,Sha X,e t al.Paclitaxel-loaded Pluronic P123/F127 m ixed po lymeric m icelles:formulation,optim ization and in vitro cha racterization[J].Int J Pharm,2009,376(1-2):176-185.
[17] Song L,Shen YY,Hou JW,Lei L,Guo SR,Qian CY.Polymeric m ice lles for parente ral delivery o f cu rcum in:Preparation,cha racterization and in vitro evaluation[J].Colloid Surf A:Physicochem Engin Asp,2011,390(1-3):25-32.
[18] Jin Y,Xin R,Tong L,Du L,Li M.Combina tion an ti-HIV therapy w ith the self-assemblies of an asymmetric bolaamphiphilic zidovudine/didanosine prodrug[J].Mol Pharm,2011,8(3):867-876.
[19] Jin Y,Yang F,Du L.Nanoassemblies containing a fluorouracil/zidovudine glyceryl p rodrug w ith phospholipase A2-triggered drug release for cancer treatment[J].Colloids Surf B Biointerfaces,2013,112:421-428.
[20] Chen RT,Chen B,Xia Y,Yue F,Wang Q.Effects of gender on the grow th of tum or in m ice loaded w ith H22liver cance r[J].Chin Occup Med(中国职业医学),2008,35(4):283-285.
[21] Dumortier G,Grossiord JL,Agnely F,Chaumeil JC.A review of poloxamer 407 pharmaceuticaland pharmacological characteristics[J].Pharm Res,2006,23(12):2709-2728.
Preparation,physicochem ical p roperties and an ti-tum or activity o f po lym eric m icelles o f one gem citabine lip id derivative
ZUO Jing1,2,YANG M ing3,LIM iao2,DU Li-na2,JIN Yi-guang1,2
(1.Graduate Schoo l,AnhuiMedical University,He fei 230032,China;2.Departm ent o f Pharm aceutica l Sciences,Institute o f Radiation Medicine,Academ y o f M ilitary Medical Sciences,Beijing 100850,China;3.Co llege o f Life Science and Technology,Beijing University o f Chem ica l Techno logy,Beijing 100029,China)
OBJECTlVE To prepare a lipid derivative of gem citabine(Gem)and its polymeric m icelles to overcome the disadvantages of Gem.METHODS N-benzyl-3′-acetyl-gemcitabine(BAG)was synthesized.A BAG-loaded poloxamer polymeric m icelle(BAG∶poloxamer 188=10∶1,mol/mol)was p repared using an in jection method.The m icelles were characterized w ith a laser partic le size and e lectric charge instrum ent and negative ly-stained transm ission e lectron m icroscopy.Human breast cancer ce lls MCF-7 were cu ltured w ith Gem or BAG po lym eric m ice lles o f 5,10,20,30,50,70,90μmo l·L-1for 24,48 and 72 h,respective ly.The inhibitory rate o f ce lls was m easured w ith an MTT m ethod.The MCF-7 cytotoxicity of BAG po lym eric m ice lles was investigated.A pharmacodynam ic study was performed on the m ice bearing mouse hepatocellular cancer cells H22.Intravenous(iv)and oral(ig)adm inistration was used at the dose ofGem 40 mg·kg-1or BAG polymericm icelles 62 mg·kg-1.The m ice were adm inistered on the 1st,4th and 7th day and sacrificed on the 8th day.Tumor inhibitory rates were m easured.RESULTS The BAG structure was identified by thin layer chrom atograph,1H and13C NMR,in frared ray chromatograph and mass spectrum.The appearance of BAG m ice lles was a slightly b lue suspension.The m ice lles were spheres according to the electron m icroscopic observation.Their size was 62.82 nm and the zeta potentia l was-18.8 m V.The half inhibition concentration(IC50)o f Gem and BAG po lymeric m icelles was 40.6 and 90.0μm o l·L-1,5.0 and 14.9μm ol·L-1,5.0 and 13.6μmol·L-1at24,48 and 72 h,respectively according to the MTT results.According to the in vivo results,compared w ith the tumormodel group,Gem(ig),Gem(iv)and BAG polymeric m icelles(iv and ig)had significanteffecton the tumorweightofH22cellxenograftm ice(P<0.01).As foranti-tumor efficiency,BAG polymericm icelles(ig)were better than Gem(ig)(P<0.05);BAG polymeric m icelles(iv)were better than BAG po lym eric m ice lles(ig)(P<0.05),and BAG po lym eric m ice lles(iv)were a lm ost equal to Gem(iv).CONCLUSlON The lipid derivative o f Gem can be loaded in the po loxam er 188 po lym eric m ice lles.BAG po lym eric m ice lles show in vitro MCF-7 ce ll inhibition and in vivo inhibition o fmouse H22xerogra fts;iv or ig.BAG polym eric m ice lles(ig)show better anti-tum or effect than Gem(ig),indicating that BAG polym eric m ice lles are a p rom ising nove l anti-tum or ora l p reparation.
gem citabine;lipid derivatives;po lym eric m ice lles;antineop lastic agents
s:DU Li-na,Tel:(010)66930216,E-mail:dulina@188.com;JIN Yi-guang,Tel:(010)66931220,E-mail:jinyg@139.com
R979.1,R943
A
1000-3002(2014)03-0408-07
Foundation item:The pro jec t suppo rted by National Key Technologies R&D Program fo r New Drugs(2012ZX09301003-001-009);and Nationa l Natura l Science Foundation of China(81072598)
2014-01-28 接受日期:2014-05-19)
(本文编辑:齐春会)
国家科技重大专项(2012ZX09301003-001-009);国家自然科学基金(81072598)
左 靖(1988-),女,硕士研究生,主要从事靶向给药新剂型研究;杜丽娜(1977-),女,博士,副研究员,主要从事纳米靶向制剂和经皮给药制剂研究;金义光(1973-),男,博士,研究员,博士生导师,主要从事分子药剂学研究。
杜丽娜,E-mail:dulina@188.com,Tel:(010)66930216;金义光,E-mail:jinyg@139.com,Tel:(010)66931220
