9种海洋硅藻挥发性成分的比较分析
2014-03-22徐继林周成旭严小军
陈 姣,徐继林,李 艳,周成旭,严小军
(宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
海洋硅藻是一类单细胞藻类,种类多、数量大,被称为海洋的“草原”,是海洋有机物的主要生产者之一,同时提供了约40%的海洋初级生产力[1],在其生长过程中,挥发性组分可以通过海气交换进入大气,影响着局部甚至整个海域的气候[2]。硅藻作为海洋经济动物贝类、虾蟹幼体的直接饵料,其挥发性组分势必直接影响着养殖生物的肉质风味。研究表明,藻类代谢物直接影响着贝类对微藻的滤食速率和摄食选择性,而这些代谢物相当部分为藻类挥发性组分[3]。另有研究表明在藻类中产生的某些短链醛与其自身防御及诱导挠足类的繁殖失败密切相关[4],所以有必要对海洋硅藻的挥发性组分进行详细的研究。现有对硅藻的研究中,人们主要关注其蛋白质、脂类等营养效价[5,6],对于藻类的挥发性成分的研究,目前只局限在大型藻上[7,8],还未见对海洋微藻特别是海洋硅藻的挥发性成分的详细研究。
本文借助顶空固相微萃取-气相色谱-质谱联用技术(HS-SPME-GC/MS),对9种海洋硅藻进行挥发性成分进行了测定,并利用SIMCA-P分析软件对这些硅藻之间挥发性成分的差异进行详细研究,可为海洋硅藻的进一步开发利用及其化学分类学、饵料营养学等相关研究提供重要参考依据。
1 材料和方法
1.1 仪器和试剂
QP2010气相色谱-质谱分析仪,带AOC-20自动进样器(日本SHIMADZU公司),vocol色谱柱(60 m×0.32 mm×0.18 μm,美国Supelco公司),冷冻干燥机(美国LABCONCO公司),固相微萃取(SPME)系统和75 μm DVB/ CAR/ PDMS萃取头(美国Supelco公司),颗粒粒度计数分析仪(德国Casy公司),试剂均为国产分析纯。
1.2 样品处理
9株海洋硅藻藻种由宁波大学海洋生物实验室藻种室提供,分别为:角毛藻(Chaetoceroscalcitrons, NMBguh003-4)、冠盘藻(Stephanodiscusehrenberg,NMBguh017)、小硅藻(Nitzschiaclosterium,NMBguh002)、骨条藻(Skeletonemacostatum,NMBguh004-1)、骨条藻(Skeletonemacostatum,NMBguh004-2)、骨条藻(Skeletonemasp.,NMBguh004-3)、威氏海链藻(Thalassiosiraweissflogii,NMBguh021)、拟微型海链藻(Thalassiosirapseudonana,NMBguh005)和三角褐指藻(Phaeodactylumtricornutum, NMBguh001),拉丁名后编号为对应硅藻在藻种室的编号。培养海水(盐度25)经0.45 μm醋酸纤维滤膜过滤后煮沸冷却,培养液采用“NML3号”配方(100 mg/L KNO3, 10 mg/L KH2PO4, 20 mg/L Na2SiO3, 0.25 mg/L MnSO4·H2O, 2.50 mg/L FeSO4·7H2O, 10 mg/L EDTA-Na2, 6 μg/L VB1, 0.05 μg/L VB12)。藻种在5000 mL锥形瓶中于日光灯光照下培养,每个样品平行培养5瓶,光照强度45~55 μmol/(m·s),光暗周期12∶12(h/h),培养温度为(20±2)℃,每2 d用颗粒粒度计数分析仪[9]测量硅藻密度,当小硅藻、角毛藻、威氏海链藻的生长到达平台后期时在4℃、4000 r/min下对这3种硅藻离心收集;其余6种硅藻生长达到平台后期时,在4℃、4000 r/min下离心收集。分析前,藻粉冷冻干燥后置于-80℃超低温冰箱收藏。
称取微藻样品200 mg于15 mL SPME顶空瓶中,顶空瓶放置于30℃恒温水浴中。75 μm DVB/ CAR/ PDMS萃取头于气相进样口(210℃)老化30 min,用SPME装置的针头刺穿瓶盖内聚四氟乙烯密封垫,推出萃取头暴露于顶空中,固定深度3 cm,萃取40 min,20℃室温下平衡20 min,取出萃取头立即插入 210℃气相进样口,脱吸附5 min, 进行GC/MS分析。
固相萃取纤维预先在250℃下活化30 min以上,顶空瓶放置于30℃恒温水浴电磁搅拌机中,磁力搅拌下,用SPME装置的针头刺穿瓶盖内聚四氟乙烯密封垫,推出萃取头暴露于顶空中,固定深度3 cm,萃取30 min,停止搅拌,25℃室温下再平衡吸附15 min,随即拔出进行GC-MS分析。
1.3 色谱质谱条件
GC条件:采用不分流进样模式,进样口温度210℃,载气为高纯氦气,柱流速1.99 mL/min,柱前压83.5 kPa,柱起始温度35℃,保持3.5 min,以3℃/min升至40℃,保持1 min,再以5℃/min,升至100℃后以10℃/min升至210℃,保持25 min。
MS条件:用电子轰击(electron impact, EI)源分析,电子能量为70 eV,离子源温度200℃,接口温度210℃,选取全程离子碎片扫描(SCAN)模式,质量扫描范围为45~1000,溶剂延迟0.6 min。
1.4 数据处理
原始数据根据GC-MS总离子流图中各组分的离子碎片质量图谱,通过对NIST库和WILEY库检索结合有关文献[10,11]进行化合物定性,用面积归一法计算出各挥发性成分的百分含量。对5个平行组的样品建立一个包含样品种类名称、每一样品的峰数量(基于保留时间和对应质荷比)和归一化后的峰面积数据库,并将此数据库导入SIMCA-P+11.5软件(瑞典Umetrics AB公司)进行主成分分析(PCA)。
2 结果与讨论
2.1 不同种类硅藻间挥发性成分的差异
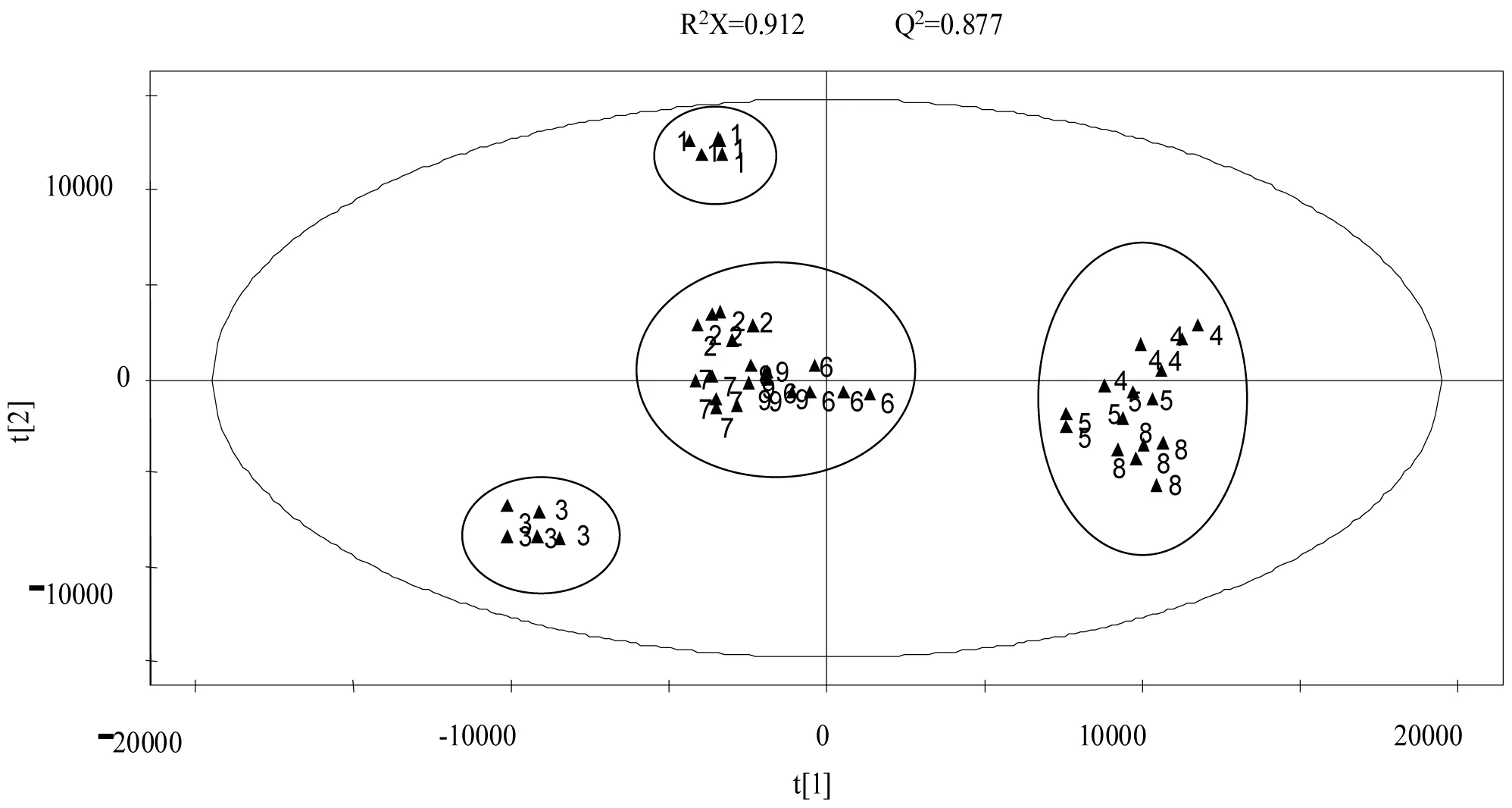
从硅藻藻粉样品GC-MS总离子流图可见(以骨条藻NMBguh004-2为例,图1),本方法能得到样品丰富的挥发性成分信息。从角毛藻、冠盘藻、小硅藻、骨条藻NMBguh004-1、骨条藻NMBguh004-2、骨条藻NMBguh004-3、威氏海链藻、拟微型海链藻和三角褐指藻分别分离出96、83、88、90、101、92、81及76个有效色谱峰,共鉴定出152种挥发性成分,9种硅藻分别鉴定出76、55、65、58、58、68、62、56和53种物质,占有效峰面积的82.14%、84.45%、81.23%、88.36%、85.76%、81.38%、80.23%、83.21%及86.56%,各组分相对百分含量见表1(表中数值为各样品5个平行组已鉴定成分的平均值)。对不同硅藻不同平行组进行峰面积积分,把样品信息和对应挥发性物质的定性定量信息输入SIMCA-P软件进行PCA分析,可得到各样品在第一主成分和第二主成分构成的平面上的投影得分图(图2) ,每一标注点代表每一种硅藻的一个样品。这种在二维空间上显示物质聚类分布的PCA得分图可以直观地表征样品间的相似或非相似性[12]。由图2可以清楚的看到:小硅藻、威氏海链藻、骨条藻NMBguh004-1和冠盘藻4种藻挥发性组成比较接近,拟微型海链藻、骨条藻NMBguh004-2和骨条藻NMBguh004-3挥发性组成比较接近,而三角褐指藻和角毛藻分别跟其它硅藻有较大的距离,说明与其它硅藻的挥发性组分差别较大。

图1 骨条藻(Skeletonema costatum,NMBguh004-2)挥发性物质GC-MS总离子流图
1—三角褐指藻; 2—小硅藻; 3—角毛藻; 4—拟微型海链藻; 5—骨条藻NMBguh004-3; 6—威氏海链藻; 7—骨条藻NMBguh004-1; 8—骨条藻NMBguh004-2; 9—冠盘藻。
图2硅藻样品挥发性成分的PCA得分图
Fig 2 PCA score plot of marine diatom for the analysis of volatile components
通过PCA对应的载荷图(图3),可以直观每一个物质对于硅藻间差异分类的贡献,在载荷图中间的物质都是共有的物质,而越靠近外缘的物质,离哪个样品近就说明该样品中对应的物质含量会相对较高。依据协方差大小,选取了对这9株硅藻挥发性物质差异贡献度前20种物质(表1),包括10种醛类,2种酮类,3种醇类,2种烷烃类,1种苯酚类物质和2种未鉴定出的标志物。

(图上标注物质及数值为表1中对应挥发性物质及其保留时间)
2.1.1 醛类
在对硅藻的醛类物质研究中,小硅藻、三角褐指藻、角毛藻、骨条藻NMBguh004-1、骨条藻NMBguh004-2、骨条藻NMBguh004-3、威氏海链藻、拟微型海链藻和冠盘藻中醛类所占百分比分别为:21.66%、33.78%、27.5%、31.2%、39.55%、33.03%、32.33%、47.24%和43.2%,鉴定出的醛类物质分别有12种、13种、19种、12种、17种、19种、12种、19种及18种。在这些物质中,2-丁烯醛、庚醛、2,4-庚二烯醛、壬醛、2-壬烯醛在9种硅藻中都被鉴定出,从鉴定结果(表2)可知:在平台后期硅藻的挥发性醛类物质中壬醛占了绝对的优势,而从PCA得分图及其对应载荷图可见,壬醛是造成三角褐指藻和角毛藻明显分别于其它硅藻的最主要挥发性成分,其在三角褐指藻中相对百分含量高达13.8%,而在角毛藻仅为4.48%(表2)。壬醛通常产生辛辣的刺激性气味[13], 因其在9种硅藻中相对百分含量较高,它可能对硅藻的特征风味有重要贡献。2-戊烯醛、庚醛、2,4-庚二烯醛、2,4-辛二烯醛是造成拟微型海链藻、骨条藻NMBguh004-2、骨条藻NMBguh004-3区别于其它硅藻的重要挥发性组分,其中2-戊烯醛在骨条藻NMBguh004-2中相对百分含量最高达到5.55%,拟微型海链藻中庚醛百分含量最高达到5.71%,骨条藻NMBguh004-2 中2,4-庚二烯醛含量达到3.57%,2,4-辛二烯醛在2种骨条藻中的相对百分含量明显高于其它几种硅藻,分别达到5.31%和4.78%。
有文献指出,不饱和醛类物质对挠足类的繁殖失败有关系[14]。从以上分析可知:此时期的骨条藻NMBguh004-2、骨条藻NMBguh004-3、拟微型海链藻因含较高的不饱和醛类物质而与其它硅藻明显分类,因此处于平台后期的这3种硅藻可能并不适合作为桡足类的饵料藻。而小硅藻、角毛藻、三角褐指藻、骨条藻NMBguh004-1因不饱和醛类物质相对含量较其它藻要低,相对其它几类藻可能比较适合桡足类的饲养。
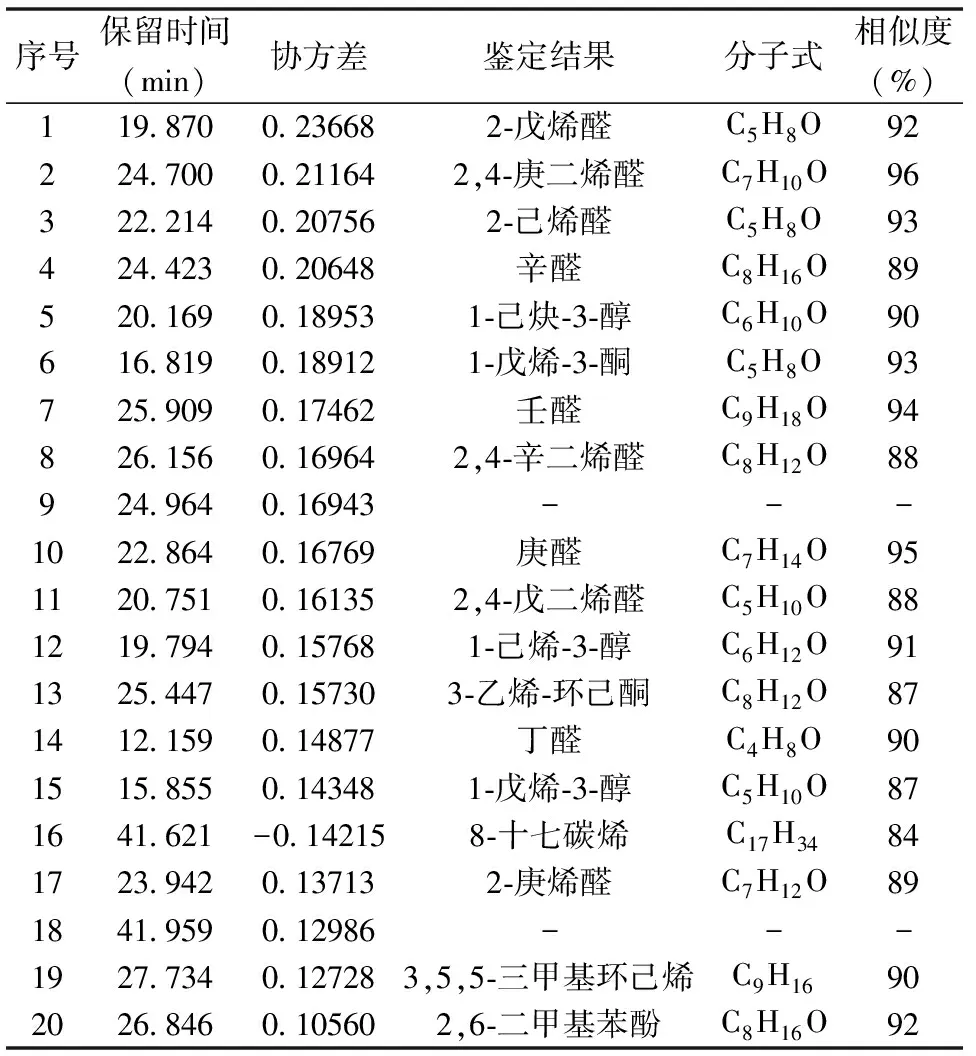
表1 决定9株硅藻样品差异的前20种挥发性成分
低级饱和脂肪醛一般具有强烈的刺鼻气味,随着链长的增加其刺激性气味逐渐减弱[14],但不饱和醛大多有愉快的香气[15],如2-己烯醛呈现青草气味[16],而2,4-庚二烯醛被认为具有鱼腥味和金属味[17]。在生物体内,很多醛类物质都来源自脂肪酸,在硅藻中作为重要生物标志物的2,4-辛二烯醛已在很多鱼肉中被检出且与鱼腥味的产生有着密切的关系[18]。有文献指出[19]2,4-辛二烯醛的产生量与十六碳三烯酸含量有很大的相关性,所以这种小分子醛类的变化也可以在一定程度上反应出硅藻间十六碳三烯酸含量的变化。在小硅藻、威氏海链藻、三角褐指藻中还检测到苯甲醛,它被认为是烤花生中的主要羰基化合物,具有令人愉快的香味,在针对大眼金枪鱼肉的风味研究认为对整体风味具有加和作用[20]。可见,这些醛类物质的混合构成了对应微藻各自具备特征气味,它们对鱼虾贝蟹的肉质风味形成和对饵料藻的摄食选择可能也起着很重要的作用。
2.1.2 烷烯烃类
除醛类物质外,硅藻中另外一大类挥发性物质为烷烯烃类,总共鉴定出44种,相对含量在小硅藻、三角褐指藻、角毛藻、骨条藻NMBguh004-1、骨条藻NMBguh004-2、骨条藻NMBguh004-3、威氏海链藻、拟微型海链藻、冠盘藻在已鉴定出的组分中烷烯烃类所占百分比分别为32.38%、14.23%、38.38%、26.83%、13.19%、26.19%、20.06%、26.83%和25.24%。角毛藻中的烷烯烃类物质的百分含量明显高于其它硅藻,由PCA得分图(图2)及载荷图(图3)可知:8-十七碳烯是造成角毛藻与其它硅藻不同的主要原因。由表2可见,这几类硅藻中只在角毛藻中检测到8-十七碳烯,相对百分含量高达5.83%。在这类物质中,小硅藻的烷烯烃类物质的总含量明显高于其它几类硅藻,其中己烷、十五烷、1-十五烯、十六烷含量明显高于其它烷烯烃物质含量。烷烯烃类主要来源于脂肪酸烷氧自由基的均裂,这些饱和或不饱和脂肪酸感觉阈值[21]较醛类高,一般对香气影响不大。有些烷烯烃类在一定条件下裂解之后是产生腥味的潜在物质[22]。
2.1.3 酮类
共有21种酮类物质中被鉴定出,冠盘藻中酮类物质相对百分含量最高(19.21%)。3,5-辛二烯-2-酮在这些藻中都被检测到,其中拟微型海链藻中百分含量相对最高(3.32%),骨条藻NMBguh004-1中含量相对较低(0.48%)。
1-戊烯-3-酮是硅藻中被检出的一种主要的生物标志物,这几类硅藻中1-戊烯-3-酮百分含量最高的为冠盘藻(6.63%),小硅藻相对较低(0.86%),在角毛藻和三角褐指藻中未被检测到。由于低级不饱和酮通常是具有刺激性气味[23],所以这种酮类物质可能会对硅藻的风味带来不良的影响。此外,3,5-辛二烯-2-酮在9种硅藻中都有检出,这种物质对鱼腥味有加强的作用[24]。
2.1.4 醇类
9种硅藻中,总共鉴定出24种醇类物质,醇类物质总含量相对最高的是角毛藻(17.45%),拟微型海链藻最低(6.55%),其中,1-戊烯-3-醇是9种硅藻中普遍存在的醇类物质,含量最高的是NMBguh004-3(4.24%),小硅藻中最低(1.25%)。从表2可知,1-己烯-3-醇和1-己炔-3-醇是硅藻挥发性成分分类的重要标志物,这两类物质对于威氏海链藻、骨条藻NMBguh004-2、骨条藻NMBguh004-3的分类起着重要作用(图2,图3),它们在骨条藻NMBguh004-2中百分含量最高(分别为3.73%和4.44%)。
总体而言,挥发性醇会形成品质较为柔和的气味[17],在这些微藻中均检测到1-己烯基-3-醇,该醇的气味主要为青草味。1-辛烯-3-醇具有蘑菇风味特征[25],已经在多种淡水鱼和海藻中被发现[22],这种醇在角毛藻和三角褐指藻中被检测到。在9种硅藻中,角毛藻醇类物质含量最高且种类最多,醇类物质因气味柔和对角毛藻的整体风味有着有益影响,可能会促进贝类等摄食者对其的摄食选择。
2.1.5 其它物质
三角褐指藻中苯酚类和呋喃类物质的相对百分含量都明显高于其它硅藻,其中,2,6-二甲基苯酚的相对百分含量高达11.59%,这类物质大多具有特殊的芳香气味, 2,6-二甲基-苯酚也是三角褐指藻区别于其它硅藻的主要生物标志物(表1),由于它在其它硅藻中含量很低,所以对另外8种硅藻的风味影响不大。在骨条藻NMBguh004-3中2-乙基呋喃的相对百分含量达到2.22%,呋喃类化合物大都具有很强的肉香味,2-乙基呋喃具有强烈的焦香气味[26]。羧酸类在硅藻中检出种类和含量都很少,仅在威氏海链藻、小硅藻、冠盘藻中检测到少量壬酸,三角褐指藻中检测到癸酸。在这些酸类物质中,相对百分含量最高的即为三角褐指藻中的癸酸为2.35%。
此外,在这些硅藻中都检出了一种噻唑类物质和一些含氯化合物,这些物质含量虽低但在这几种硅藻中普遍存在。对于硅藻中检测出这类含量不高但普遍存在的噻唑类物质,其气味极强,广泛存在于多种食品之中,多具有鲜菜、烤肉或坚果的香气[27],此物质的存在可能对硅藻的整体风味有着一定的影响。已有研究指出,海藻是挥发性卤素化合物的重要资源,多种红藻中都存在卤化物[38],而在本次实验中,在9种硅藻中均检测到一些挥发性卤化物,说明硅藻也是挥发性卤化物的重要资源。另外,在一些硅藻中,检测到乙基苯和对二甲苯,这类物质对硅藻的整体风味有着不利的影响[29]。值得我们注意的是,二甲基硫这种含硫化合物在9种硅藻样品中都被鉴定出,这几类硅藻中骨条藻(NMBguh004-1)二甲基硫含量最高,其相对含量达到9.16%,其次是小硅藻达到6.7%,在角毛藻、威氏海链藻、拟微型海链藻、骨条藻NMBguh004-2二甲基硫含量很低,相对含量都低于2%。在低浓度时,DMS会产生一种令人愉快的类蟹香,在较高浓度时却呈一种异常的气味,所以二甲基硫的含量决定了其对整体风味是有利还是有害[30]。有研究指出,二甲基硫是海洋中最丰富的挥发性硫化物[31],可以通过海气交换进入大气,从而影响局部甚至整个海域的气候以及形成酸雨、酸雾等[32]。从以上硅藻挥发性成分数据结果可知,骨条藻(NMBguh004-1)和小硅藻中二甲基硫相对于其它硅藻来说,对其周围水环境甚至大气环境影响相对较大。
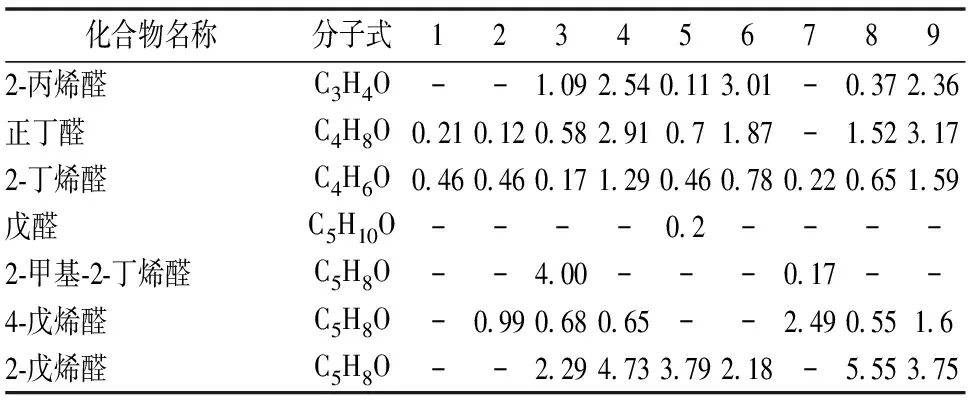
表2 9种海洋硅藻后期挥发性成分鉴定结果

续表2 (Table 2 Continued)化合物名称分子式1234567893-甲基-戊醛 C6H12O----1.873.563.071.594.743-甲基-戊醛C6H12O---1.92-----2-己烯醛C6H10O1.490.891.49 3.621.772.171.255.961.622,4-戊二烯醛C5H6O3.561.792.10 ------2,6-己二烯醛 C6H8O---0.880.22--0.44-庚醛C7H14O3.11.431.53 3.982.451.343.152.375.714-庚烯醛C7H12O0.56-0.42 1.780.530.77--0.432-庚烯醛C7H12O-------0.951.392,4-庚二烯醛C7H10O2.521.922.38 3.173.762.431.513.574.12辛醛C8H16O3.561.23--3.84----2-辛烯醛C8H14O--2.30 2.5721.60.92-2.352,4-辛二烯醛C8H12O--2.09 5.310.672.26-4.78-壬醛C9H18O13.88.015.48 4.936.689.017.95.966.862-壬烯醛C9H16O0.781.340.72 2.540.930.892.320.621.62,6-壬二烯醛C9H14O---1.35-----癸醛C10H12O-0.86 0.761.151.231.040.67E-2-癸烯醛C10H18O--0.27 1.560.7---0.332,4-癸二烯醛C10H16O -------0.710.26正十一醛C11H22O1.12--------2,6,6-三甲基-1-环己烯-1-甲醛C10H16O 0.152.311.05 0.751.20.461.062.920.65苯甲醛C7H6O2.471.173.7------己烷C6H140.967.650.48 0.89-8.870.830.274.57环己烷C6H12----0.220.38---2,4,4-三甲基-2-戊烯C8H16---1.95---0.18-2-甲基-2,3-己二烯 C7H12----0.26----2,3-二甲基-1-戊烯C7H14--0.02 1.850.4--0.56-2,6-辛二烯C8H16----1.14----1,3,5-辛三烯 C8H12-----0.88---3,5,5-三甲基-2-己烯C9H183.891.541.19 0.882.40.841.54-1.417-甲基-3,4-辛二烯 C9H161.12-------0.62-壬炔C9H162.45-0.62 0.88-0.84-0.51.572,4-壬二烯C9H16-------3.563.072,3,6-三甲基-1,6-庚二烯C10H18--1.11 --0.79---2,3,6-三甲基-1,6-庚二烯 C10H18--------1.868-甲基-癸烷C11H22-0.89-------十二烷 C12H26-0.37-------正十三烷C13H280.7-0.51 ------3,8-二甲基癸烷C12H26--0.65 ------正十四烷C14H30-1.915.04 2.334.571.783.141.03十四碳烯C14H281.31--------2-甲基癸烷C11H24--0.46 --0.47---壬基环戊烷 C14H28------0.43--癸基环戊烷C15H30-1.8--2.01----2-甲基正十四烷C15H32-0.50.45 ----1.99-2,6,10-三甲基十二烷C15H32-0.13--1.23-1.15-0.26正十五烷C15H32-2.516.10 1.781.961.343.581.20.931-十五烯C15H321.713.5-------3-甲基十四烷C15H32--1.35 ----1.4-3-甲基-十五烷 C16H34----3.05---0.672-甲基十五烷C16H34-2.462.84 -0.670.741.851.950.74十一烷基环戊烷C16H32 ------1.740.49-正十六烷C16H341.695.855.53 2.555.243.946.98-3.882,6,10-三甲基-十五烷C18H38--1.55 -----1.924-甲基十六烷C17H36-0.560.38 ------2-甲基十六烷C17H36-0.950.56 -----0.64
“-”表示在样品中未检测到该物质。
参考文献:
[1]Guillard R R L, Ryther J H. Studies of marine planktonic diatoms[J]. J Microbiol, 1962, 8:229-239.
[2]周成旭, 徐继林, 严小军, 等.海洋微藻培养液中二甲基硫与二甲基硫丙酸的同步分析[J].分析化学研究报告,2009,9(32):1308-1312.
[3]Ward J E, Targett N M. Influence of marine microalgal metabolites on the feeding behavior of the blue musselMytilusedulis[J]. Marine Biology, 1989, 101:313-321.
[4]Ianora A, Poulet S A, Miralto A, et al. The diatomThalassiosirarotula affects reproductive success in the copepodAcartiaclause[J]. Mar Biol, 1996, 125:279-286.
[5]徐继林, 严小军, 朱艺锋, 等. 一种饵料微藻的脂肪酸甾醇分析及化学分类的探讨[J].海洋学报, 2005,27(4): 121-126.
[6]曹淑莉, 向葆卿.8种海洋饵料微藻蛋白质含量及氨基酸组成比例的比较研究.海洋学报,1993,15(4):98-103.
[7]伊纪峰, 朱建一, 韩晓磊, 等. HS-SPME-GC /MS 联用检测红毛菜中的挥发性成分[J].南京师范大学学报,2009, 32(2): 103-107.
[8]王秀娟, 徐继林, 严小军. 2种海藻中半挥发性物质的成分分析[J].海洋科学, 2010, 34(1): 25-28.
[9]茅 华, 许 海, 刘兆普.温度、光照、盐度及pH对旋链角毛藻生长的影响[J].生态科学, 2007,26(5):432-436.
[10]谢惜媚, 陆慧宁.新鲜叶下珠挥发性成分的GC-MS分析[J].中山大学学报,2009,45(5):142-144.
[11]江 健, 王锡昌, 陈西瑶.顶空固相微萃取与GC-MS联用法分析淡水鱼肉气味组分[J].现代食品科技,2006, 22(2): 219-222.
[12]Vliet E V, Morath S, Eskes C, et al. A novel in vitro metabolomics approach for neurotoxicity testing, proof of principle for methyl mercury chloride and caffeine[J]. NeuroToxicology, 2008, 29(1): 1-12.
[13]章超桦, 平野敏行, 铃木健, 等.鲫的挥发性成分[J].水产学报, 2000, 4: 354-358.
[14]Howe G A, Schilmiller A L. Oxylipin metabolism in response to stress[J]. Curr Opin Plant Biol, 2002, 5: 230-236.
[15]阚建全. 食品化学[M].北京: 中国农业大学出版社,2002: 309-360.
[16]赵庆喜, 薛长湖, 徐 杰. 微波蒸馏-固相微萃取-气相色谱-质谱-嗅觉检测器联用分析鳙鱼鱼肉中的挥发性成分[J]. 色谱, 2007, 25(2):267-271.
[17]陈婉珠, 芮汉明, 张 玲. 海带腥味物质的HS-SPME-GC-MS 分析[J]. 食品工业科技, 2006,27(12): 71-73.
[18]Frank D, Poole S, Kirchhoff S, et al. Investigation of sensory and volatile characteristics of farmed and wildBarramundi(Latescalcarifer) using gas chromatography-olfactometry mass spectrometry and descriptive sensory analysis[J]. J Agric Food Chem, 2009, 57(21): 10302-10312.
[19]Laturnus F, Wiencke C, Kloser H. Antarctic macroalgae-sources of volatile halogenated organic components[J]. Marine Environment Research, 1996, 41(2):169-181.
[20]孙 静, 黄 健, 侯云丹,等.顶空固相微萃取-气质联用分析大眼金枪鱼肉的挥发性成分.食品科学[J].2011,32(22):230-233.
[21]宋焕禄. 食品风味化学[M]. 北京:化学工业出版社, 2008:211-232.
[22]汪秋安. 海藻等水产品的香气成分分析[J].海洋科学, 1997, 2: 26-29.
[23]陈 峰, 姜 悦. 微藻生物技术[M]. 北京:中国轻工业出版社,1999:59-63.
[24]吴 薇, 陶宁萍, 顾赛麒.鱼肉特征性气味物质研究进展[J]. 食品科学.2013,34(11):381-385.
[25]张晓鸣.食品风味化学[M]. 北京:中国轻工业出版社, 2009:325.
[26]丁耐克.食品风味化学[M]. 北京:中国轻工业出版社.1999:101-123.
[27]黄梅丽, 王俊卿.食品色香味化学[M]. 北京:化学工业出版社, 2008:250-262.
[28]Kajiwara T, Kodama K, Matsui K. Volatile compounds from Japanese marine brown algae[J]. American Chemistry Society, 1993, 525: 103-120.
[29]胡传明, 徐继林, 朱建一,等.紫菜特征挥发性物质分析[J]. 海洋科学,2011,35(5):106-111.
[30]夏延斌.食品风味化学[M].北京:化学工业出版社,2008: 110-113.
[31]Norici A, Hell R, Giordano M. Sulfur and primary production in aquatic environments: an ecological perspective[J]. Photosynth Res, 2005, 86:409-417.
[32]Charlson R J, Lovelock J E, Andreae M O. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate[J]. Warren S G Nature, 1987, 326:655-661.
