可口革囊星虫肾管肌组织的结构特征
2014-03-22龙玲利卢明明丁理法竺俊全
龙玲利,盛 樟,卢明明,丁理法,竺俊全
(1. 宁波大学 教育部应用海洋生物技术重点实验室,宁波 315211;2. 温岭市水产技术推广站,浙江 温岭 317500)
肾管是星虫类动物、环节动物及扁形动物等的排泄器官,它除行使排泄及身体体积调节功能外,还兼具生殖管的作用[1, 2]。肾管一般由上皮层、肌层、细胞外基质及外膜构成。环节动物的肾管结构已见在利氏才女虫(Polydoraligni)[3]、生殖浮蚕(Tomopterishelgolandica)[4]及双齿围沙蚕(Perinereisaibuhitensis)[5]等种类中研究报道;星虫类动物的肾管结构已见在黑色缨心星虫(Thysanocardianigra)[6]、Phascolosomagranulatum星虫[7,8]等种类中研究报道,其中,Serrano等[8]对Phascolosomagranulatum星虫肾管肌组织的超微结构进行了观察,发现肌纤维内含有粗、细两种肌丝、胞质致密体及膜相关电子致密斑等。
可口革囊星虫(Phascolosomaesculenta)属星虫动物门、革囊星虫科。有关该物种的基础研究已涉及生殖与发育[9-12]、生化与分子[13-16]、消化管及体壁组织结构[17,18]等方面,但其肾管肌组织的结构未见详细报道。本文采用显微及亚显微技术观察了该物种肾管肌组织的结构特征,为其肾管结构及机能的深入了解积累基础资料。
1 材料与方法
1.1 材料
2011年4月,从浙江温岭养殖池塘采得可口革囊星虫200余条,体质量1.5~3.0 g/条,活体带回宁波大学实验室暂养于水槽中(海水水温15~16℃、盐度23),24 h后供实验用。
1.2 方法
1.2.1 解剖及组织切片观察
挑选活力好的个体20余条,活体解剖观察肾管的形态,并取肾管用Bouin氏液固定24 h,乙醇梯度浓度脱水,石蜡包埋,切片,HE染色后于Olympus BX51显微镜下观察并拍照。
1.2.2 透射电镜观察
取肾管用2.5%戊二醛(4℃)固定过夜,然后用1%锇酸(4℃)固定2 h,乙醇梯度浓度脱水,Epon 812环氧树脂渗透并包埋,LKB型超薄切片机切片,醋酸铀及柠檬酸铅染色,日立H-7650透射电镜观察与拍照。
2 结果
2.1 可口革囊星虫肾管的基本形态
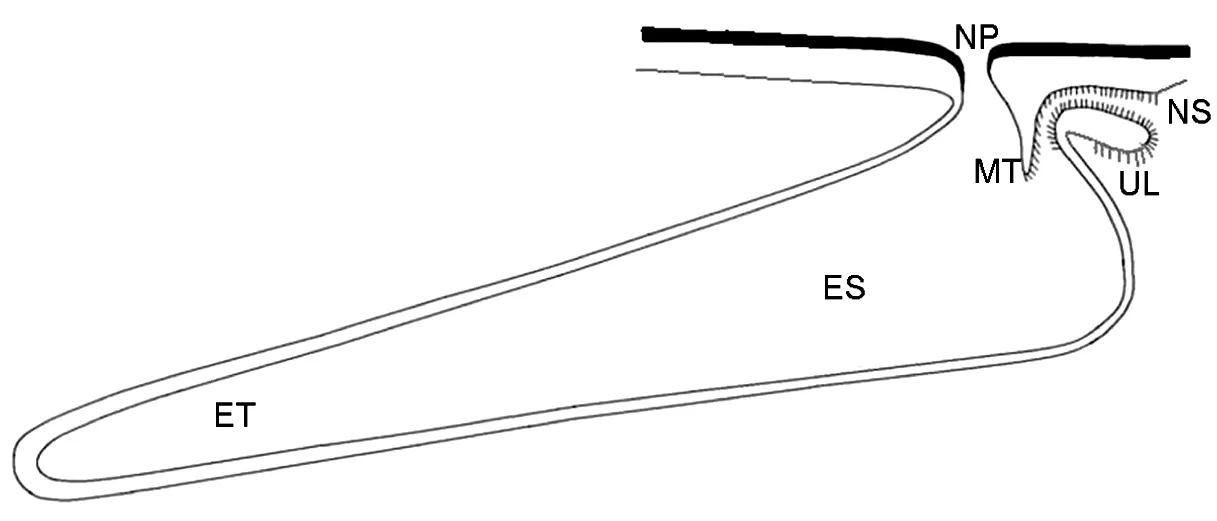
ES—排泄囊;ET—排泄管;MT—舌头;NP—肾孔;NS—肾口;UL—上叶。
图1可口革囊星虫肾管的形态
Fig 1 The nephridial morphology ofPhascolosomaesculenta
可口革囊星虫有一对肾管,呈长囊状,位于身体前端腹神经索的两侧,对称悬挂于体腔中。肾管前端稍膨大部分为排泄囊,往后逐渐变细,为排泄管。每个肾管有两个开口,分别为通体腔的肾口和通体外的肾孔,其中肾口为一喇叭形结构,内表面着生纤毛,肾口下叶也着生纤毛(图1)。
2.2 可口革囊星虫肾管肌组织的结构特征
可口革囊星虫肾管外表面具瓶形突起,肾管壁由内向外依次为上皮层(柱状上皮和立方上皮)、肌层、细胞外基质及外膜。肌层位于柱状上皮层下,由纵肌及环肌组成,纵肌沿肾管长方向排列,环肌与纵肌垂直(图版Ⅰ:1、2)。肌纤维聚集成束,嵌入到细胞外基质中,肌纤维与肌纤维之间、肌纤维束与肌纤维束之间均由细胞外基质分隔(图版Ⅰ:3)。
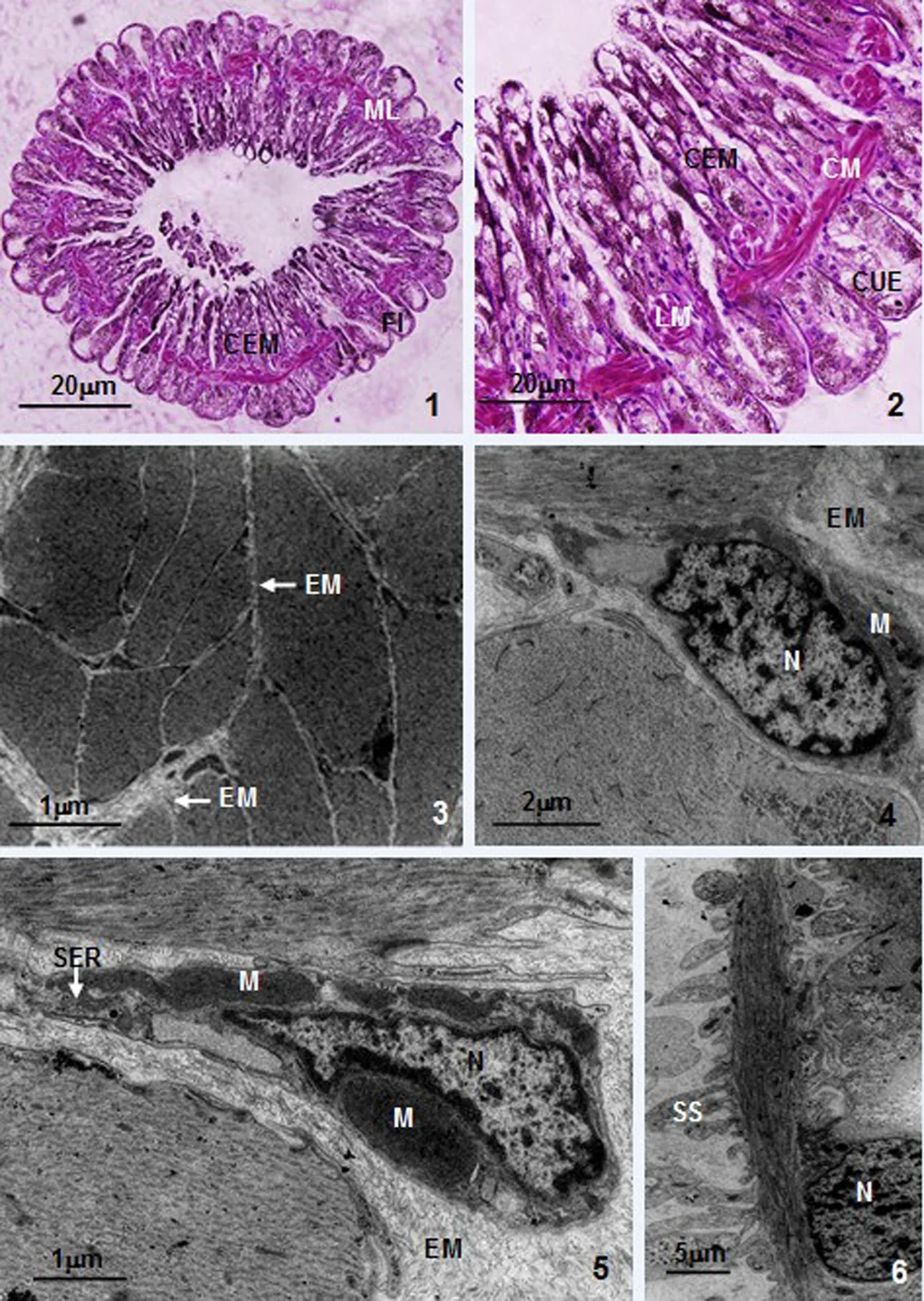
1—肾管横切面,示柱状上皮、肌组织及瓶形突起;2—图1局部放大,示立方上皮、柱状上皮、环肌及纵肌;3—肌纤维切面,示细胞外基质;4—肌纤维交界处切面,示细胞外基质、细胞核及线粒体;5—肌纤维交界处切面,示细胞外基质、细胞核、线粒体及光面内质网;6—肌纤维纵切面,示细胞核及肌质囊。CEM—柱状上皮;CM—环行肌;CUE—立方上皮;EM—细胞外基质;FI—瓶形突起;LM—纵形肌;M—线粒体;ML—肌组织;N—细胞核;SER—光面内质网;SS—肌质囊。1~2—组织切片观察;3~6—透射电镜观察。
图版Ⅰ可口革囊星虫肾管的组织学及透射电镜观察
PlateⅠ Histological and transmission electron microscopical observation of nephridium inP.esculenta
肌纤维的纵切面观呈长梭形,核被挤至细胞边缘形成核极区并明显突向细胞外基质中(图版Ⅰ:6)。核形态因切面的不同呈椭圆形或不规则形,核周胞质中有较多线粒体及少量内质网,线粒体形态多样(图版Ⅰ:4、5)。
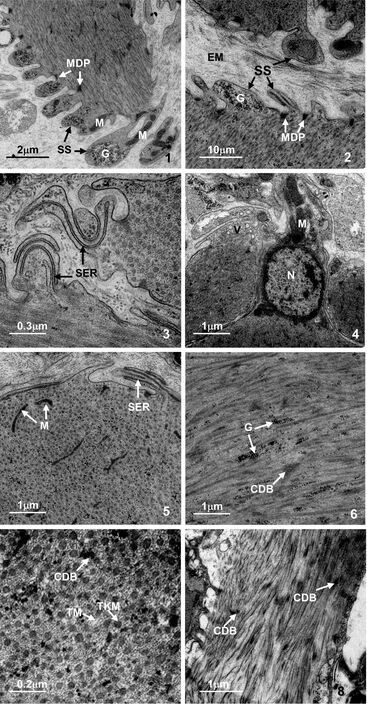
1—肌纤维局部纵切面,示线粒体、糖原颗粒、肌质囊及膜相关电子致密斑;2—肌纤维交界处切面,示细胞外基质、肌质囊、糖原颗粒、膜相关电子致密斑;3—肌纤维交界处切面,示肌质囊及光面内质网;4—肌纤维交界处切面,示细胞核、线粒体、囊泡;5—肌纤维横切面,示内质网及线粒体;6—肌纤维纵切面,示糖原颗粒及胞质致密体;7—肌纤维横切面,示粗肌丝、细肌丝及胞质致密体;8—肌纤维纵切面,示胞质致密体。CDB—胞质致密体;G—糖原颗粒;MDP—膜相关电子致密斑;TKM—粗肌丝;TM—细肌丝;V—囊泡。
图版Ⅱ可口革囊星虫肾管肌组织的透射电镜观察
PlateⅡ Transmission electron microscopical observation of nephridium inP.esculenta
肌细胞表面有许多囊状或指状突起,伸入到细胞外基质中,称之为肌质囊(sarcoplasmic sac)(图版Ⅰ:6;图版Ⅱ:1、2)。肌质囊内无肌丝分布,但含肌浆、光面内质网、线粒体及糖原颗粒等,糖原颗粒大小基本一致。紧贴肌膜内面含有电子密度高的膜相关电子致密斑,多位于肌质囊之间(图版Ⅱ:1、2、3)。肌膜下可见小囊泡(图版Ⅱ:4)。
肌纤维主要由粗、细两种肌丝组成,细肌丝围绕在粗肌丝周围,粗肌丝直径约为41 nm,细肌丝直径约为6 nm(图版Ⅱ:7)。肌丝之间也含糖原颗粒及线粒体,糖原颗粒大小均匀,线粒体多呈线状或杆状(图版Ⅱ:5、6)。肌丝之间分散有电子密度高的斑块,为胞质致密体(图版Ⅱ:6、7、8)。
3 讨论
可口革囊星虫肾管肌组织位于柱状上皮之下的细胞外基质中,环肌与纵肌聚集成束,与黑色缨心星虫[6]及Phascolosmagranulatum星虫[8]肾管的肌层结构类似,而且,肌纤维呈梭形,无横纹结构,类似于平滑肌纤维。杨淑兰等[19]根据平滑肌细胞的形态,将其分为收缩型和合成型,其中收缩型肌细胞呈梭形,肌丝丰富,而合成型肌细胞为多边形,肌丝较少。可口革囊星虫肾管肌细胞肌丝含量丰富,属收缩型平滑肌细胞。Serrano等[8]根据平滑肌细胞粗肌丝直径的不同,将Phascolosmagranulatum星虫肾管肌细胞分为A、B和C 3种类型,其粗肌丝直径分别为52 nm、43 nm和36 nm。本研究的可口革囊星虫肾管肌细胞中粗肌丝的直径基本相同,约41 nm,与Phascolosmagranulatum星虫肾管中的B型肌细胞相似。
可口革囊星虫肾管肌细胞核和Phascolosmagranulatum星虫一样,均位于细胞边缘,与高等动物平滑肌细胞的细胞核居细胞中央不同[20,21]。此外,可口革囊星虫肾管肌纤维的肌质囊及胞质中央区均含大小均一的糖原颗粒,与Notoplanaacticola涡虫体壁平滑肌纤维内的糖原颗粒相似,而Hymenolepisdiminuta绦虫及Lacistorhynchustenuis绦虫的吸盘平滑肌纤维中含两种大小不同的糖原颗粒,即α-糖原颗粒和β-糖原颗粒[22]。线粒体及糖原可为肌纤维的代谢提供能量。
膜相关电子致密斑及胞质致密体是可口革囊星虫肾管肌纤维的两种致密体结构,它们普遍存在于无脊椎动物的平滑肌细胞中,如Hymenolepisdiminuta绦虫吸盘平滑肌[22]、栉孔扇贝(chlamysnobilis)内收肌[23]及大鼠血管平滑肌[24]等肌细胞中。本研究中膜相关电子致密斑一般位于肌细胞的肌质囊之间,紧贴肌膜内面,胞质致密体于细胞内与肌丝相连。Serrano等[8]对Phascolosmagranulatum星虫肾管平滑肌细胞的超微结构进行了研究,发现膜相关电子致密斑紧密相连的细胞外区域存在一些细丝样结构,推测电子致密斑和细丝结构可能将肌纤维产生的张力传递到细胞外基质与相邻肌纤维,从而引起整个肾管肌组织的收缩;并认为胞质致密体的功能类似于脊椎动物横纹肌的Z线,锚定肌丝。依此推测,可口革囊星虫肾管肌细胞的膜相关电子致密斑及胞质致密体可能与Phascolosmagranulatum星虫肾管肌细胞中的两种致密体结构有类似的功能。
星虫肾管肌组织对肾管功能的发挥起着重要的作用。Serrano等[25]研究认为,Phascolosmagranulatum星虫肾管肌组织的收缩有利于发挥其过滤功能;Adrianov等[6]对黑色缨心星虫肾管结构的研究后认为,肌纤维的同步收缩有利于肾管对体腔液的过滤作用,同时阻止其滤液倒流,在繁殖季节还可促进生殖细胞进入肾管腔。可口革囊星虫肾管肌组织较发达,其收缩对促进肾管的过滤排泄及繁殖时配子进入肾管可能起重要作用。
参考文献:
[1]李 诺. 无脊椎动物的排泄器官[J]. 生物学通报, 2002, 37(5): 26-28.
[2]Bartolomaeus T, Quast B. Structure and development of nephridia in Annelida and related taxa[J]. Hydrobiologia, 2005, 535/536(1): 139-165.
[3]Rice S A. Ultrastructure of the male nephridium and its role in spermatophore formation in spionid polychaetes (Annelida) [J]. Zoomorphologie, 1980, 95(3): 181-194.
[4]Bartolomaeus T. Structure and development of the nephridia ofTomopterishelgolandica(Annelida) [J]. Zoomorphology, 1997, 117(1): 1-11.
[5]宋贞坪, 李 霞, 王福景, 等. 双齿围沙蚕主要器官组织学的研究[J]. 大连海洋大学学报, 2010, 25(4): 320-323.
[6]Adrianov A V, Maiorova A S, Malakhov V V. Microscopic anatomy and ultrastructure of nephridium in the sipunculanThysanocardianigraIkeda, 1904 from the sea of Japan[J]. Zoology, 2002, 28(1): 19-29.
[7]Serrano T, Angulo E, Mateo A, et al. Three types of thick myofilaments in the nephridial muscle cells of the sipunculanPhascolosomagranulatum[J]. Cell Structure and Function, 1990, 15(2): 73-78.
[8]Serrano T, Angulo E, Mateo A, et al. Fine structure of the nephridial muscle layer cells ofPhascolosomagranulatum(Sipuncula) [J]. Morphology, 1993, 217: 45-54.
[9]顾晓英, 竺俊全, 许式见, 等. 可口革囊星虫(Phascolosomaesculenta)卵子发生的组织学研究[J]. 海洋与湖沼, 2009, 40(3): 283-288.
[10]Ying X P, Dahms H U, Liu X M, et al. Development of germ cells and reproductive biology in the sipunculidPhascolosomaesculenta[J]. Aquaculture Research, 2009, 40: 305-314.
[11]金春华, 竺俊全, 许式见, 等. 可口革囊星虫(Phascolosomaesculenta)胚胎及幼虫发育研究[J]. 海洋与湖沼, 2011, 42(1): 94-100.
[12]竺俊全, 王 伟, 丁理法. 可口革囊星虫(Phascolosomaesculenta)卵黄合成期卵母细胞发育及卵黄发生卵膜形成的超微结构[J]. 海洋与湖沼, 2012, 43(4): 870-876.
[13]杜莉利, 李太武, 苏秀榕, 等. 可口革囊星虫(Phascolomaesculenta)铁结合蛋白基因的研究[J]. 海洋与湖沼, 2008, 39(3): 252-256.
[14]Wang M Q, Su X R, Li Y, et al. Cloning and expression of the Mn-SOD gene fromPhascolosomaesculenta[J]. Fish & Shellfish Immunology, 2010, 29(5): 759-764.
[15]Su X R, Du L L, Li Y Y, et al. Cloning and expression of HSP70 gene of sipunculaPhascolosomaesculenta[J]. Fish & Shellfish Immunology, 2010, 28(3): 461-466.
[16]雷世勇,丁理法,黄福勇,等.可口革囊星虫不同组织同工酶的比较[J].生物学杂志, 2013, 30(4):11-14.
[17]雷世勇,卢明明,丁理法,等.可口革囊星虫消化道的形态结构特征[J].生物学杂志, 2013, 30(2):33-36,39.
[18]邓日中, 黄 渤, 方再光. 可口革囊星虫体壁形态和组织学结构[J]. 水产科学, 2007, 26(6): 335-339.
[19]杨淑兰, 田 蕾, 娄书艳, 等. 510.6 nm激光照射对兔在体血管平滑肌细胞超微结构的影响[J]. 中国激光医学杂志, 2008, 17(2): 98-101.
[20]章 杰, 刘 伟. 平滑肌细胞的培养及应用[J]. 江西医药, 2006, 41(5): 330-333.
[21]周晓莉, 雷 寒, 柳 青. 血管平滑肌细胞的培养及鉴定[J]. 重庆医学, 2005, 34(6): 877-878.
[22]Lumsden R D. The ultrastructure of cestode muscle[J]. The Journal of Parasitology, 1967, 53(2): 326-342.
[23]Matsuno A, Ishida H, Hori H. Two kinds of thick filament in smooth muscle cells in the adductor of a clam,Chlamysnobilis[J]. Tissue and Cell, 1993, 25(3): 325-332.
[24]王生兰, 苏 娟, 徐一洲, 等. 大鼠血管平滑肌细胞体外培养的表型转换及其鉴定[J]. 中国动脉硬化杂志, 2008, 16(4): 268-272.
[25]Serrano T, Angulo E, Mateo A, et al. The fine structure of the nephridial coelothelium ofPhascolosomagranulatum(Leuckart, 1828) (Sipuncula, Phascolosomatidae)[J]. Zeitschrift für Mikroskopisch-anatomische Forschung (Leipzig), 1989, 103(3): 414-424.
