黄姑鱼(Nibea albiflora)与大黄鱼(Pseudosciaenacrocea)精子超微结构的观察与比较
2014-03-22李明云王金华王天柱
胡 谋,苗 亮,李明云,张 浩,王金华,王天柱,潘 娜
(宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
黄姑鱼(Nibeaalbiflora)和大黄鱼(Pseudosciaenacrocea)分别属于鲈形目(Perciformes)、石首鱼科(Sciaenida)的黄姑鱼属(Nibea)和黄鱼属(Pseudosciaena),都是中国重要的海水养殖经济鱼类[1]。鉴于这两种鱼类经济性状有一定互补性,且繁殖季节重叠,马梁等[2]开展了大黄鱼♀×黄姑鱼♂人工杂交试验,但杂交胚胎呈典型的单倍体症状,无法获得存活鱼苗。王德祥等[1]、Miao等[3]的研究均显示黄姑鱼精子可作为诱导大黄鱼雌核发育的异源激活源。这些研究结果说明黄姑鱼和大黄鱼的精子可能有较高的相似性,但二者在超微结构上有何异同尚未见报道。
目前国内外学者已研究了多种硬骨鱼类精子的超微结构,不仅可以为其繁殖生物学提供必要的信息,而且对于鱼类分类也有一定的借鉴作用。本研究使用扫描电镜(Scanning electron micrographs, SEM)和透射电镜(Transmission electron micrographs, TEM)技术对黄姑鱼和大黄鱼两种精子的超微结构进行了观察和比较,旨在为其繁殖生物学的研究和繁殖养殖的开展提供基础资料。
1 材料和方法
于2012年4月从宁波象山港湾水产苗种有限公司的海水网箱中取性成熟的黄姑鱼和大黄鱼雄鱼,通过人工挤压腹部获取精液,PBS液稀释并离心,弃去上清液,用2.5%戊二醛前固定。扫描电镜样品:经前固定后,PBS漂洗,1%锇酸后固定,再PBS漂洗,乙醇逐级脱水和叔丁醇脱水,经临界点干燥、离子溅射后用Hitachi S-3400N型扫描电子显微镜观察并拍照。透射电镜样品:经前固定后,漂洗,梯度乙醇脱水,Epoon812树脂包埋,超薄切片后经醋酸双氧铀和柠檬酸铅双染色,用Hitachi H-7650型透射电子显微镜观察并拍照。
2 结果与分析
2.1 外部形态
黄姑鱼和大黄鱼精子均为鞭毛型精子,无顶体,均由头部、中段和尾部3部分组成;精子头部和中段界限不明显,头部近椭圆形;尾部(鞭毛)可分为主段和末段,主段较粗,至末端逐渐变细,最后消失成一点(图 1-a,图 2-a,)。经测量,黄姑鱼和大黄鱼精子在全长、头长、头宽、中段长、尾长、尾径等参数上均无显著差异(P>0.05)(表1)。
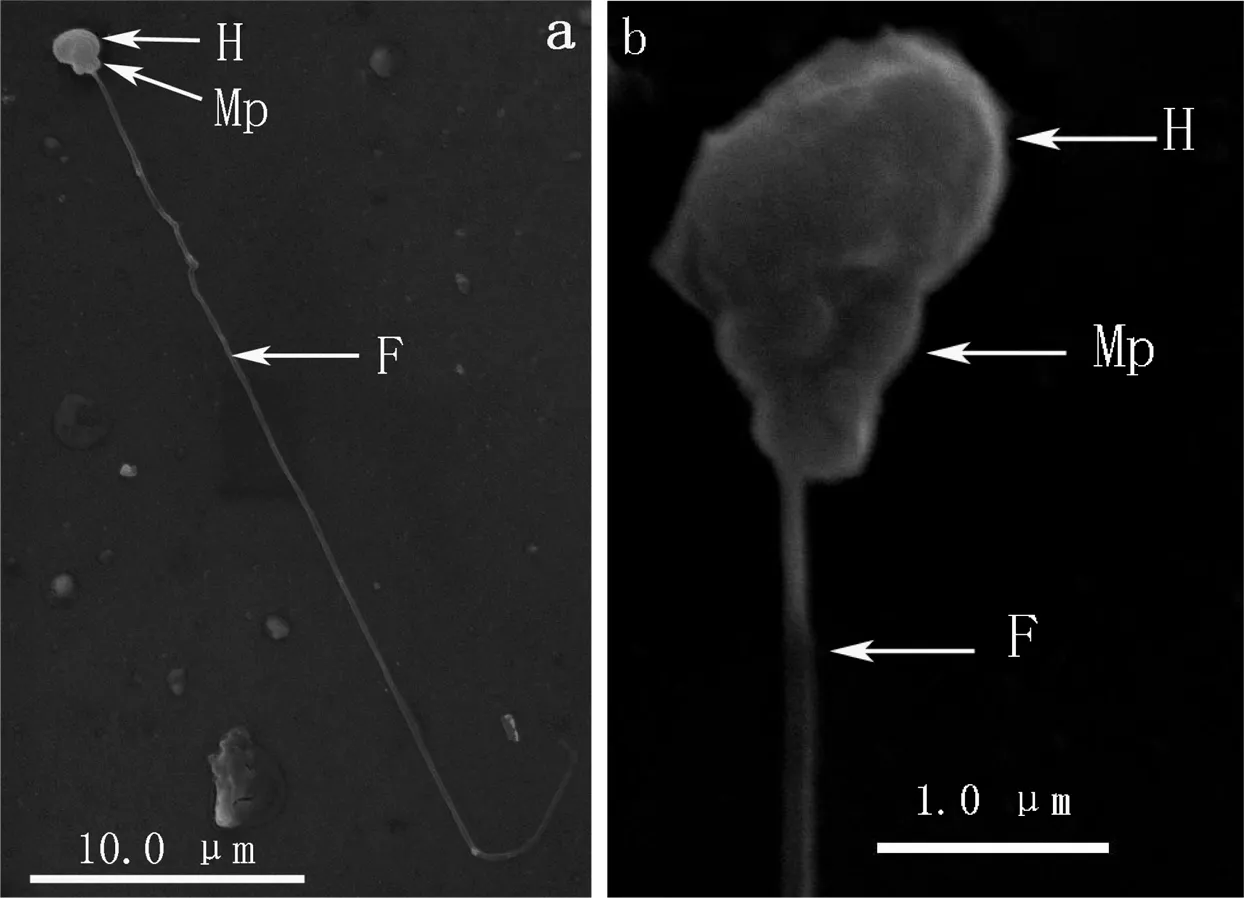
a—精子外观(appearance of a spermatozoon);b—精子头部放大图(enlarge figure of the spermatozoon head);H—精子头部(head of spermatozoon);Mp—精子中段(midpiece of spermatozoon);F—精子尾部(flagellum of spermatozoon)。

图 1 黄姑鱼精子外部形态
2.2 头部
黄姑鱼和大黄鱼精子头部形态相似,结构基本相同。精子头部均有背腹面之分,无顶体(acrosome);细胞核呈肾形,位于腹面,细胞核中染色质高度浓缩,形成致密的团块状,在团块状染色质之间分布着松散不规则排布的染色质纤维和位置不定的网络状间隙(图 3-a,图 4-a)。中心粒复合体(centriolar complex)位于头部的背面,近端中心粒(preximal centriole)和远端中心粒(distal centriole)均为“9+0”微管结构,二者的长轴相互垂直,远端中心粒向后延伸出轴丝(图3-a,图4-a)。

a—精子外观(appearance of a spermatozoon);b—精子头部放大图(enlarge figure of the spermatozoon head);H—精子头部(head of spermatozoon);Mp—精子中段(midpiece of spermatozoon);F—精子尾部(Flagellum of spermatozoon);EP—尾部末段(endpiece of the ta)。
图2大黄鱼精子的外部形态
Fig 2 Morphology of spermatozoon inPseudosciaenacrocea
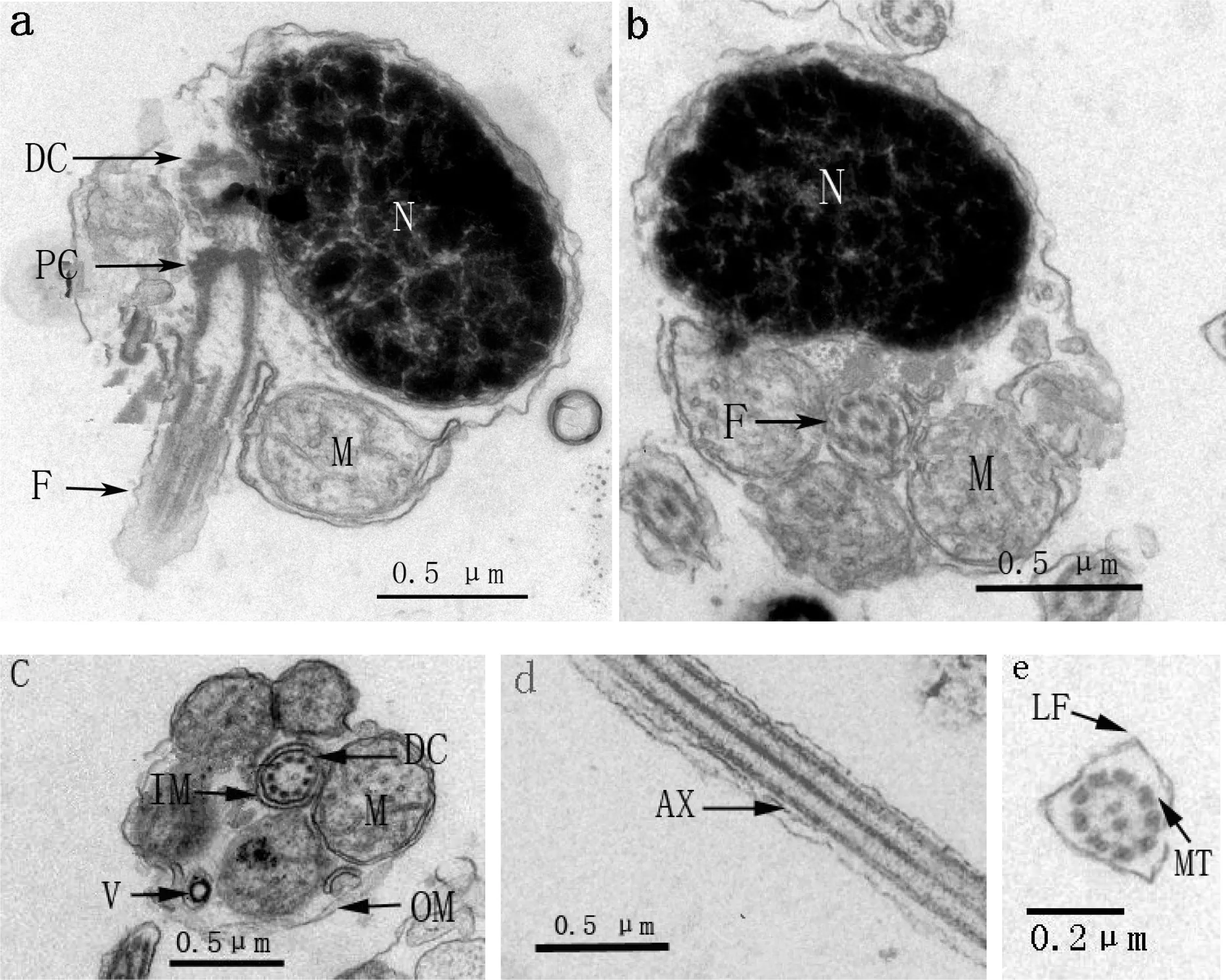
a—精子纵切(Longitudinal section of sperm);b—精子细胞核横切(Cross section of nucleus);c—精子中段横切(Cross section of midpiece);d—鞭毛纵切(Longitudinal section of flagellum);e—鞭毛横切(Cross section of flagellum);PC—近端中心粒(proximal centriole);DC—远端中心粒(distal centriole);M—线粒体(mitochondrion);F—鞭毛(flagellum);N—细胞核(nucleus); OM—袖套外膜(outer membrane of sleeve);IM—袖套内膜(inner memberane of the sleeve);V—囊泡(vesicle);MT—微管(microtubule;);LF—侧鳍(lateral fin); AX—轴丝(axoneme)。
图3黄姑鱼精子的超微结构
Fig 3 Ultrastructure of the spermatozoon inN.albiflora
2.3 中段
黄姑鱼和大黄鱼精子中段均包括线粒体和袖套(sleeve)两部分。袖套位于头部的最后端,呈筒状(图 3-c;图 4-c),袖套中有少量的囊泡(vesicle)(图 3-b;图 4-b);线粒体呈圆形,一般有4~5个,彼此间不融合,围绕轴丝呈环形排列(图3-c;图4-c)。

a—精子纵切(Longitudinal section of sperm);b—精子细胞核横切(Cross section of nucleus);c—精子中段横切(Cross section of midpiece);d—鞭毛纵切(Longitudinal section of flagellum);e—鞭毛横切(Cross section of flagellum);PC—近端中心粒(proximal centriole);DC—远端中心粒(distal centriole);M—线粒体(mitochondrion);F—鞭毛(flagellum);N—细胞核(nucleus);IF—植入窝(implantation fossa);OM—袖套外膜(outer membrane of sleeve);IM—袖套内膜(inner memberane of the sleeve);MT—微管(microtubule;);LF—侧鳍(lateral fin);AX—轴丝(axoneme)。
图4大黄鱼精子的超微结构
Fig 4 Ultrastructure of the spermatozoon inPseudosciaenacrocea
2.4 尾部
黄姑鱼和大黄鱼精子均为单鞭毛,细长,鞭毛起始于袖套腔中,尾部表面的质膜形成不规则的短鳍,在尾部纵切面上呈波纹状向两侧突出而成的侧鳍(lateral fin),横切面上可见轴丝为典型的“9+2”结构(图3-e,图4-e);尾部末梢均变细(图1-a,图2-a)。
3 讨论
硬骨鱼种类繁多,生殖特点不尽相同,受精方式分为体内受精和体外受精两种类型。Jamieson等[4]将体外受精的硬骨鱼类精子分为I型精子(鞭毛长轴与细胞核底部垂直)和II型精子(鞭毛长轴与细胞核横向平行),II型精子因在鲈形目中最为常见而又被称为“鲈型目精子”。现已研究的鲈形目各科鱼类精子中,石首鱼科鱼类(包括本文的黄姑鱼和大黄鱼)全为II型精子[5],雀鲷科、慈鲷科和鲷科为I型精子[6],隆头鱼科中I型和II型精子同时存在[7],而马鲅科精子则是介于I型和II型之间的中间型[8]。
3.1 头部
黄姑鱼和大黄鱼精子头部的形状均类似椭圆形,细胞核呈卵圆形或肾形。这与鮸鱼[9]、大黄鱼[10]等大多数石首鱼科鱼类的精子头部非常相似。在体外受精的硬骨鱼中,精子的形状有所不同。如头石脂鲤(Bryconcephalus)[11]精子头部为规则的圆形。鲑鳟鱼(Salmogairdneri)和亚东鲑(Salmotruttafario)精子头部为卵圆形[12]。另外,中华鲟(Acipensersinensis)、西伯利亚鲟(Acipenser,baeriiBrandt)、小体鲟(Acipenser,ruthenusLinnaeus)和白鲟(Scaphirhynchusalbus)[13]中均发现了圆柱形的头部。
硬骨鱼类精子的植入窝多为细胞核表面一个凹陷,深浅不一。植入窝(implantation fossa)多位于核的后端,也有位于核的一侧[14]。本文中黄姑鱼和大黄鱼精子的植入窝位于细胞核表面,为一条浅沟状结构,其走向与细胞核长轴接近于平行,这与尤永隆等[10]描述的大黄鱼精子的植入窝一致,与鮸鱼、银鲳精子的植入窝也非常类似[9],而与鲤鱼、黄颡鱼精子的植入窝则不同[15],鲤鱼精子的植入窝位于细胞核一侧,而黄颡鱼精子的植入窝位于核后端。
一般硬骨鱼类中,近端中心粒和远端中心粒的排列表现为两种形态。一种是近端中心粒与精子长轴垂直,呈现为“T”型;另一种是远端中心粒与精子长轴平行,呈现为“L”型[16]。在已研究过的鲈形目鱼类精子中,近端中心粒与远端中心粒大多相互垂直,呈“T”型排列,如蓝头锦鱼(Thalassomabifasciatum)、黄鳍鲷(Acanthopagrusberda)、澳洲黑鲷(Acanthopagrusaustralis)、菱体兔牙鲷(Lagodonrhomboids)、羊头鲷(Archosargusprobatocephus)、黑枪鱼(blackmarlin)[17]以及本文中的黄姑鱼和大黄鱼,但也有少数种类是非垂直排列,如斜带石斑鱼(Epinepheluscoioides)精子的近端中心粒与远端中心粒呈120°夹角[18];大菱鲆(Lachnolaimusmaximus)精子的近、远端中心粒互成135°[17]。
3.2 中段
在石首鱼科鱼类中,精子中段线粒体通常呈圆形,数量一般不超过10个[5,9,10];而鲈形目的鲷科(Sparidae)和马鲅科(Polynemidae)鱼类的精子则只有一个线粒体[6,8]。本研究观察到黄姑鱼和大黄鱼精子中线粒体的数量均为4~5个,程顺等[19]在大黄鱼精子中观察到了5个线粒体,而尤永隆等[10]研究发现大黄鱼精子中段内有6个线粒体,大黄鱼线粒体个数不一致可能与个体差异或切片角度不同有关。
3.3 尾部
包括黄姑鱼和大黄鱼在内,石首鱼科鱼类的精子均为单鞭毛,轴丝为“9+2”结构[5,9,10]。到目前为止,除大西洋鳗(Anguillaanguilla)和康吉鳗(Congeranguilla)精子的轴丝缺少一对中央微管,为“9+0”结构外,其它绝大多数鱼类精子的轴丝都为“9+2”结构。某些鲇形目鱼类精子具有双鞭毛,如棘甲鲶科的(Doradidae)韦氏上棘鮠(Anadorasweddellii)和钝囊鲶属(Amblydoras)[20];鲈形目的慈鲷科(Satanopercajurupari)鱼类精子也具有双鞭毛[6],而天竺鲷科(Apogonidaeimberbis)鱼类精子则包含单鞭毛和双鞭毛两种类型[21]。
许多硬骨鱼类精子鞭毛轴丝的外面都能看到由细胞质向两侧扩张而成的侧鳍[14],石首鱼科中,鞭毛膜上都存在不规则的侧鳍[5,9,10],本研究发现黄姑鱼和大黄鱼精子鞭毛上也存在不规则的侧鳍。Mattei等[22]认为鞭毛膜的扩张对于提高精子的活动能力是一种有效的补充。Stoss等[23]均认为侧鳍结构与精子的运动相适应,可提高精子的游动速度,有助于鱼类受精;而Afzelius等[24]则认为侧鳍与精子游泳速率的提高无多大关系。关于精子侧鳍的具体作用还有待进一步研究验证。另外,尤永隆等[10]在大黄鱼精子尾部超微结构中观察发现,鞭毛主段的末端呈现膨大的瓶状,其中存在由微管螺旋而成的篓状结构。而本研究并未发现大黄鱼精子尾部主段末端有类似膨大的篓状结构,程顺等[19]在大黄鱼精子的超微结构研究中也未提及该结构。
3.4 黄姑鱼和大黄鱼精子比较
黄姑鱼和大黄鱼精子无论在形态、大小还是超微结构上都十分相似,这也是黄姑鱼精子可以激活大黄鱼卵的原因之一,但由于二者的遗传物质可能存在不相容性,不能获得存活的大黄鱼♀×黄姑鱼♂杂交子代。包括黄姑鱼和大黄鱼在内,现已研究的石首鱼科鱼类的精子在超微结构上表现出高度的相似性。Sasaki等[25]根据对石首鱼科鱼类的形态学、骨骼学和肌肉学特性分析,认为该科是单系统起源的。石首鱼科中鱼类精子的高度相似性支持了这一观点,同时也支持了“同科中不同种精子的细胞器分布一致”这个假说[26]。
参考文献:
[1]王德祥, 苏永全, 王世峰, 等. 异源精子诱导大黄鱼雌核发育的研究 [J]. 高技术通讯, 2006, 16(11): 1206-1210.
[2]马 梁, 王 军, 陈武各. (鮸)状黄姑鱼与大黄鱼人工杂交子代的胚胎发育 [J]. 厦门大学学报:自然科学版, 2002, 41(03): 378-382.
[3]Miao L, Tang X N, Li M Y, et al. Artificial gynogenesis inPseudosciaenacrocea(Perciformes, Sciaenidae) with heterologous sperm and its verification using microsatellite markers [J]. Aquaaculture Research, 2012: 1-7.
[4]Jamieson B G M. Reproductive biology and phylogeny of fishes (Agnathans and bony fishes)[M]. Science Publishers, Enfield, NH, USA, 2009: 768.
[5]Gusmaeo P, Foresti F, Quagio-Grassiotto I. Ultrastructure of spermiogenesis inPlagioscionsquamosissimus(Teleostei, Perciformes, Sciaenidae) [J]. Tissue Cell, 1999, 31(6): 627-633.
[6]Matos E, Matos P, Corral L, et al. Ultrastructural study of the spermatozoon ofCrenicichlasaxatilis Linnaeus [J].1758, pisces, teleosfei from the Amazon region[J] Morphol Sci, 1995,12(2): 109-114.
[7]Mattei X. Spermatozoon ultrastructure and its systematic implications in fishes [J]. Can J Zool, 1991, 69(12): 3038-3055.
[8]Gusmaeo-Pompiani P, Oliveira C, Quagio-Grassiotto I. Spermatozoa ultrastruture in Sciaenidae and Polynemidae (Teleostei: Perciformes) with some consideration onPercoideispermatozoaultrastructure [J]. Tissue and Cell, 2005, 37(3): 177-191.
[9]Miao L, Li M Y, Tang X N, et al. Sperm ultrastructure ofMiichthysmiiuy(Perciformes: sciaenidae) [J]. The Israeli Journal of Aquaculture, 2013, 64(842): 1-7.
[10]尤永隆, 林丹军. 大黄鱼精子的超微结构 [J]. 动物学报, 1997, 43(2): 119-126.
[11]Romagosa E, Narahara M Y, Borella M I, et al. Ultrastructure of the germ cells in the testis of matrinx ,Bryconcephalus(Teleostei, Characidae) [J]. Tissue Cell, 1999, 31(6): 540-544.
[12]Billard R. Ultrastructure of trout spermatozoa: changes after dilution and deep freezing [J]. Cell Tissue Res, 1983, 228(2): 205-218.
[13]Psenicka M, Alavi S M H, Rodina M, et al. Morphology and ultrastructure of Siberian sturgeon (Acipenserbaerii) spermatozoa using scanning and transmission electron microscopy [J]. Biol Cell, 2007, 99(2): 103-115.
[14]Poirier G R, Nicholson N. Fine structure of the testicular spermatozoa from the channel catfishIctaluruspunctatus[J]. J Ultrastruct Res, 1982, 80(1): 104-110.
[15]尤永隆, 林丹军. 鲤鱼精子超微结构的研究 [J]. 动物学研究, 1996(b), 17(4) : 377-383.
[16]Billard R. Spermatogenesis and spermatology of some teleost fish species [J]. Reprod Nutr Develop, 1986, 26(4): 877-892.
[17]Robinson M P, Prince J S. Morphology of the sperm of two wrasses,ThalassomabifAsciatumandLachnolaimusmaximus(Labridae Perciformes) [J]. Bulletin of Marine Science, 2003, 72(1): 247-252.
[18]赵会宏,刘晓春,林浩然,等.斜带石斑鱼精子超微结构及盐度、温度、pH对精子活力及寿命的影响[J]. 中国水产科学, 2003, 10(4): 286-292.
[19]程 顺, 闫家强, 竺俊全, 等. 大黄鱼(Pseudosciaenacrocea)精子冷冻前后的活力及超微结构变化 [J]. 海洋与湖沼, 2003, 44(1): 56-61.
[20]Quagio-Grassiotto I, Gameiro M C, Schneider T, et al. Spermiogenesis and spermatozoa ultrastructure in five species of the curimatidae with some considerations on spermatozoal ultrastructure in characiformes [J]. Neotropical Ichthyology, 2003, 1(1): 135-145.
[21]Lahnsteiner F. The spermatozoa and eggs of the cardinal fish [J]. J Fish Biol, 2003, 62(1): 115-128.
[22]Mattei X. The flagellar apparatus of spermatoza in fish. Ultrastructure and evolution [J]. Bio Cell, 1988, 63(2): 151-158.
[23]STOSS J. Fish gamete preservation and spermatozoon physiology [M]//Hoarws, Randall D J. Fish Physiology. New York: Academic Press, 1983: 307-308.
[24]Afzelius B A. Fine structure of the gargish spermatozoon [J]. Journal of Ultrastructure Research, 1978, 64(3): 309-314.
[25]Sasaki K. Phylogeny of the family Sciaenidae with notes on its zoogeography (Teleostei Perciformes) [J]. Mem Fac Fish Hokkaido Univ, 1989, 36(1-2): 1-137.
[26]Baccetti B, Burrini A G, Callaini G, et al. Fish germinalcells I. Comparative spermatology of seven cyprinid species [J]. Gamete Res, 1984, 10(4): 373-396.
