纳豆脂肽对人乳腺癌细胞MCF-7的作用
2014-03-22,,,
,,,
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100191)
乳腺癌作为最常见的恶性肿瘤,发病率居高不下。2012年美国A Cancer Journal for Clinicians公布的数据显示,预计2022年美国乳腺癌患病率为41%,与宫颈癌(8%)、大肠癌(8%)相比,排名女性恶性肿瘤发病率第一位[1],在我国乳腺癌的患病率也比较高[2]。近年来,乳腺癌在治疗方面取得了很大的进展,但其易转移、愈后易复发以及耐药性的特点仍是治疗乳腺癌的关键问题。纳豆是用纳豆芽孢杆菌发酵大豆制成的食品,与未发酵大豆相比,纳豆中的大豆甙元和染料木素含量是发酵前的数十倍,而且在发酵过程中还产生降血脂、溶血栓作用的纳豆激酶[3]以及具有良好表面活性的纳豆脂肽[4]。目前国内外对纳豆脂肽的研究多集中于表面活性剂[4-7]、抗真菌[8-9]和抗细菌[10-13]方面,对其抗肿瘤[14]活性研究的较少。本论文从纳豆发酵液中提取纯化得到纳豆脂肽,研究其对人乳腺癌细胞MCF-7增殖和凋亡的影响。
1 材料与方法
1.1 材料与仪器
纳豆芽孢杆菌 由本实验室从纳豆发酵液中提取;人乳腺癌细胞株MCF-7 北京中医药大学;胎牛血清 杭州四季青生物工程材料有限公司;DMEM/F12培养基、0.25% EDTA-胰酶 美国Gbico;MTT(溴化-3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四氮唑)、DMSO 北京鼎国昌盛生物技术有限公司;AnnexinV-APC/7-AAD细胞凋亡检测试剂盒 南京凯基生物有限公司;细胞周期与细胞凋亡检测试剂盒 上海碧云天生物技术有限公司;其它试剂均为国产分析纯。
HZQ-X100恒温震荡培养箱 太仓市实验设备厂;GI54DWS高压灭菌锅 美国ZEALWAY;5804R高速离心机 德国eppendorf;DMI6000B活细胞工作站 德国Leica;SG603A-HE-INT生物安全柜 美国BAKER公司;FACSCalibur流式细胞仪 美国BD Biasciences。
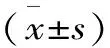
表1 纳豆脂肽对MCF-7细胞增殖的影响Table1 Effect of natto lipopetide on the cell proliferation of MCF-7
1.2 纳豆脂肽的提取和纯化
1.2.1 培养基的配制 培养基配制参考曹小红[11]的文献。配制好的培养基,121℃下灭菌20min。
1.2.2 纳豆芽孢杆菌的培养 纳豆芽孢杆菌活化2~3次后,接种于种子液培养基,35℃,140r/min摇床培养24h。将种子液以5%的接种量接种于发酵培养基,35℃,140r/min摇床培养48h。
1.2.3 纳豆脂肽的提取纯化 脂肽提取纯化方法参考吕应年[15]的文献。发酵液4℃,10000r/min,离心10min,收集上清液用浓盐酸调pH2.0,4℃静置后离心收集沉淀。加适量NaOH使沉淀溶解,再加活性炭吸附,离心取上清液,真空旋转蒸发得褐色固体。所得固体用二氯甲烷索式抽提12h后旋转蒸发去掉二氯甲烷,得纳豆脂肽粗提物,记为N1。
将粗品N1溶于适量丙酮中,浸提过夜后超声3h,4℃,10000r/min,离心20min得上清液,真空旋转蒸发去掉上清液,所得固体即为纳豆脂肽,记为N2。
取少量N1和N2溶于二氯甲烷,点样于薄层硅胶板,在氯仿∶乙酸=8∶2(V/V)的展开剂中展开,喷水显色。
1.3 纳豆脂肽诱导人乳腺癌细胞MCF-7凋亡的作用
1.3.1 MCF-7的培养与传代 将MCF-7培养在含10%胎牛血清的DMEM/F12培养基中,置于37℃、5% CO2培养箱中培养,待细胞铺满80%时,胰酶消化,按1∶3的比例传代。
1.3.2 纳豆脂肽对MCF-7的体外增殖抑制实验 采用MTT法测定纳豆脂肽对MCF-7体外增殖的抑制情况。取对数生长期的MCF-7细胞2×104个/mL接种于96孔培养板上。设置不同浓度的实验组(0.25、0.5、1、2、4、8μg/mL)和空白对照组,各组设6个平行孔。细胞贴壁后加入不同浓度的脂肽,培养12h。然后每孔加MTT溶液20μL,继续培养4h。小心吸取上清,加150μL DMSO,吹打均匀,在波长570nm处用酶标仪测定各孔吸光度值,计算抑制率(IR)和半数致死浓度(IC50)。其中抑制率的计算公式为:
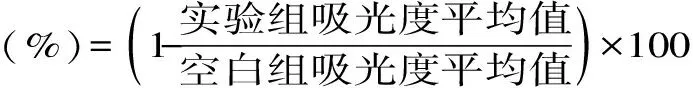
1.3.3 纳豆脂肽对MCF-7细胞凋亡和周期的影响 取对数生长期的MCF-7细胞1×105个/mL接种于6孔培养板上。细胞贴壁后加入不同浓度的脂肽(0、1、2、4μg/mL),继续培养12h。参照AnnexinV-APC/7-AAD细胞凋亡检测试剂盒和细胞周期与细胞凋亡检测试剂盒的说明书,流式细胞仪检测细胞凋亡率和细胞周期。
1.4 统计学分析
采用SPSS12.0统计学软件,单因素方差分析,p<0.05表示有显著性差异,p<0.01表示有极显著性差异。
2 结果与分析
2.1 纳豆脂肽的分离纯化
提取纯化后,N1、N2的得率分别是0.029g/L和0.021g/L。其薄层结果见图1。

图1 纳豆脂肽的薄层分析 Fig.1 TLC analysis of the natto lipopeptide
2.2 纳豆脂肽对MCF-7存活率的影响
表1表明,纳豆脂肽浓度为0.25、0.5μg/mL时,对MCF-7存活率的影响不显著。当浓度为1、2、4、8μg/mL时,对MCF-7存活率的影响显著(p<0.05),且呈一定的剂量效应关系,12h的IC50是3.68μg/mL。
2.3 纳豆脂肽对MCF-7细胞形态的影响
图2为不同浓度纳豆脂肽作用MCF-7细胞12h后的细胞形态。正常细胞呈不规则梭形,随着纳豆脂肽浓度的增大,细胞数量不断减少且形态上逐渐皱缩变为圆形。

图2 纳豆脂肽作用MCF-7细胞后的细胞形态(×200) Fig.2 Cell morphology of MCF-7 after being treated with natto lipopeptide(×200)
2.4 纳豆脂肽对MCF-7细胞凋亡率的影响
表2表明,纳豆脂肽浓度为1、2、4μg/mL时,与空白对照组(0.32%)相比,MCF-7细胞的凋亡率显著升高,分别为8.47%、9.47%和31.04%(p<0.05),且呈一定的剂量效应关系。
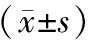
表2 纳豆脂肽作用MCF-7细胞后的凋亡率Table 2 Apoptosis rate of MCF-7 after being treated with natto
2.5 纳豆脂肽对MCF-7细胞周期的影响
表3表明,纳豆脂肽(0、1、2、4μg/mL)作用MCF-7细胞12h后细胞周期分布发生明显改变:G0/G1期细胞所占百分比从68.17%下将至47.98%;S期细胞所占百分从19.72%上升至41.04%,表明纳豆脂肽可以在将细胞周期阻滞在S期。
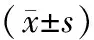
表3 纳豆脂肽作用MCF-7细胞后的 细胞周期分布Table 3 Cell cycle distribution of MCF-7 after being treated with natto
3 讨论
纳豆中含有的脂肽类物质主要有surfactin、Iturin、Fengycin。其中surfactin由一个七肽和β-羟基脂肪酸组成,其作用机理可能是surfactin嵌入到磷脂双分子层中,改变靶细胞的细胞膜通透性和脂肪酸组成,造成脂膜的破坏[16-17],进而诱导癌细胞的凋亡[18-19]。乳腺癌作为发病率较高的恶性肿瘤,严重威胁女性的健康,因此开发研究抗乳腺癌药物在预防和治疗乳腺癌方面具有重要的意义。但是目前国内外对脂肽在抑制乳腺癌方面的研究较少,曹小红等人[20]发现surfactin可以抑制人乳腺癌细胞MCF-7的增殖,作用MCF-7细胞24h后的IC50是27.3μmol/L。本次实验研究证实纳豆脂肽对人乳腺癌细胞MCF-7的增殖有抑制作用,并呈一定的剂量效应关系,且12h后的IC50是3.68μg/mL。通过活细胞工作站镜检和流式细胞仪测细胞凋亡和细胞周期,证实纳豆脂肽可使细胞形态发生改变,诱导MCF-7细胞凋亡,并将细胞周期阻滞在S期,其诱导MCF-7细胞凋亡的机理将在后续的实验中继续研究。
[1]Siegel R,DeSantis C,Virgo K,etal. Cancer treatment and survivorship statistics[J]. CA:A Cancer Journal for Clinicians,2012,62(4):220-241.
[2]杨玲,李连弟,陈育德,等. 中国乳腺癌发病死亡趋势的估计与预测[J]. 中华肿瘤杂志,2006,28(6):438-440.
[3]Milner M,Makise K. Natto and its active ingredient nattokinase:A potent and safe thrombolytic agent[J]. Alternative & complementary therapies,2002,8(3):157-164.
[4]肖兵,杨德玉,史荣久,等. 一株高效表面活性剂产生菌的筛选及其活性产物的结构与性质[J]. 生态学杂志,2013,32(3):779-786.
[5]Sriram MI,Kalishwaralal K,Deepak V,etal. Biofilm inhibition and antimicrobial action of lipopeptide biosurfactant produced by heavy metal tolerant strain Bacillus cereus NK1[J]. Colloids and Surfaces B:Biointerfaces,2011,85(2):174-181.
[6]Sriram MI,Gayathiri S,Gnanaselvi U,etal. Novel lipopeptide biosurfactant produced by hydrocarbon degrading and heavy metal tolerant bacterium Escherichia fergusonii KLU01 as a potential tool for bioremediation[J]. Bioresource technology,2011,102(19):9291-9295.
[7]王大威,刘永建,杨振宇,等. 脂肽生物表面活性剂在微生物采油中的应用[J]. 石油学报,2008,29(1):111-115.
[8]徐杨,王楠,李伟,等. 海洋枯草芽孢杆菌3512A抗真菌脂肽的分离纯化及结构特性鉴定[J]. 中国生物防治,2009,25(4):328-333.
[9]徐菱菱,王丽,陈龙男,等. 1株广谱拮抗植物病原真菌的芽孢杆菌HNA3的鉴定及其活性成分分析[J]. 华中农业大学学报,2013,32(3):21-27.
[10]Qian CD,Wu XC,Teng Yi,etal. Battacin(octapeptin B5),a new cyclic lipopeptide antibiotic from paenibacillus tianmuensis active against multidrug-resistant gram-negative bacteria[J]. Antimicrobial agents and chemotherapy,2012,56(3):1458-1465.
[11]曹小红,廖振宇,王春玲,等. Bacillus natto TK-1 产脂肽的纯化,抑菌活性及其表面活性剂特性[J]. 中国生物工程杂志,2008,28(1):44-48.
[12]刘唤明,孙力军,王雅玲,等. 纳豆菌抗菌脂肽对副溶血弧菌的抑菌机理[J]. 食品科学,2012,33(15):201-205.
[13]杨丽莉,吕凤霞,别小妹,等. 枯草芽孢杆菌抗菌脂肽对嗜水气单胞菌抑菌效果[J]. 食品科学,2011,32(1):193-198.
[14]Xie JJ,Zhou F,Li EM,etal. Fw523-3,a novel lipopeptide compound,induces apoptosis in cancer cells[J]. Molecular medicine reports,2011,4(4):759.
[15]吕应年,杨世忠,牟伯中. 脂肽的分离纯化与结构研究[J]. 微生物学通报,2005,32(1):67-73.
[16]Seydlová G,Svobodová J. Review of surfactin chemical properties and the potential biomedical applications[J]. Central European Journal of Medicine,2008,3(2):123-133.
[17]Heerklotz H,Seelig J. Leakage and lysis of lipid membranes
induced by the lipopeptide surfactin[J]. European Biophysics Journal,2007,36(4-5):305-314.
[18]Kim S,Kim JY,Kim SH,etal. Surfactin from Bacillus subtilis displays anti-proliferative effect via apoptosis induction,cell cycle arrest and survival signaling suppression[J]. FEBS letters,2007,581(5):865-871.
[19]Liu XY,Tao XY,Zou AH,etal. Effect of themicrobial lipopeptide on tumor cell lines:Apoptosis induced by disturbing the fatty acid composition of cell membrane[J]. Protein & cell,2010,1(6):584-594.
[20]Cao XH,Wang AH,Jiao RZ,etal. Surfactin induces apoptosis and G2/M arrest in human breast cancer MCF-7 cells through cell cycle factor regulation[J]. Cell biochemistry and biophysics,2009,55(3):163-171.
