乙醇-硫酸铵双水相体系提取柠檬渣中 柠檬苦素研究
2014-03-22,,,*,
,, ,*,
(1.内江师范学院 化学化工学院,四川内江 641112;2.四川省高等学校“果类废弃物资源化”重点实验室,四川内江 641112)
柠檬是一种营养丰富的柑橘属植物,广泛用于餐饮、烹调、美容、医药、轻纺、香精香料、食品加工、酿造、航空航天等行业[1-2]。中国是柠檬的主要产地之一,2011年全国柠檬产量达到30万吨以上[3]。巨大的柠檬产量促进了柠檬生产加工产业的蓬勃发展,但也产生了大量的柠檬渣等废弃物,不仅浪费了资源,也对环境带来了巨大的压力。柠檬苦素是柠檬渣中的一种重要的有效成分,该化合物具有镇痛抗炎、抗氧化、抗癌、抑制HIV和抑制真菌、防虫杀虫等活性[4-8]。将柠檬渣中提取的柠檬苦素应用于食品、药用等领域,既可实现其经济价值,又符合新时代环保的绿色化理念。
目前从天然产物中提取有效成分的方法主要有:水提取法[9-10]、有机溶剂提取法[10-12]、酶辅助提取法[13]、超声波辅助萃取法[11,14-15]、微波辅助萃取法[11,16]、超临界流体萃取法[17]等。水提取法操作简便,污染小,但提取效率较低;普通的有机溶剂提取法操作简便,但提取时间较长,有时还用到有毒试剂,污染环境和产品;酶辅助提取法条件温和,提取效率较高,但影响因素较多,酶容易失活;超声波辅助萃取法操作简便,条件温和,时间短,成本低,得率较高,但超声波对人体有较大危害,低剂量的超声波是潜在的致癌和致畸形因素;微波辅助萃取法操作简便,耗时短,消耗溶剂少,萃取效率较高,但微波对人的危害较大;超临界流体萃取法萃取效率高,能耗较少,溶剂消耗较少,但设备复杂,提取成本高。双水相萃取法条件温和,操作简便,提取效率较高,且几乎不使用有毒溶剂,还避免了超声波、微波对人体带来的伤害,是一种新型的绿色环保的液-液萃取技术,很有发展前途[18]。本文以乙醇水溶液和硫酸铵按照一定比例组成的双水相体系提取柠檬渣中的柠檬苦素,并通过单因素实验和正交实验考察了乙醇浓度、硫酸铵用量、料液比、提取温度、提取时间对柠檬苦素得率的影响,确定用此双水相体系提取柠檬渣中柠檬苦素的最佳工艺条件。
1 材料与方法
1.1 材料与仪器
柠檬苦素标准品 优级纯;乙醇、对二甲氨基苯甲醛、硫酸、三氯化铁、硫酸铵 均为分析纯;柠檬 四川安岳。
HK-04A型手提式高速粉碎机 广州旭朗机械设备有限责任公司;DF-101S型集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;SHB-B95型循环水式多用真空泵 郑州长城科工贸有限公司;T-6新世纪型紫外可见分光光度计 北京普析通用仪器有限责任公司;BT-323S电子分析天平 北京赛多利斯仪器系统有限公司。
1.2 实验方法
1.2.1 显色剂的配制 显色剂A:按照资料所述[19],准确称取125mg 对二甲氨基苯甲醛于100mL硫酸乙醇(V硫酸∶V乙醇=65∶35)混合液中溶解,放置备用。显色剂B:准确称取三氯化铁9.0g,用蒸馏水溶解并定容至100mL,放置备用。使用时往100mL显色剂A中加入0.05mL显色剂B,混匀。
1.2.2 柠檬苦素的提取与测定 标准溶液的配制:准确称取10.00mg柠檬苦素标准品于50mL容量瓶中,加入无水乙醇,待溶解后,定容,得标准溶液,浓度为0.20mg/mL。
测定波长的选择:准确量取1.00mL柠檬苦素标准溶液于10mL比色管中,加入5.00mL显色剂混合溶液,摇匀,用无水乙醇定容,摇匀,显色30min后,在300~600nm之间进行扫描,发现在500nm处出现强吸收峰,因此选择500nm作为测定波长。
标准曲线的绘制:分别精确量取柠檬苦素标准溶液0.50、1.00、1.50、2.00、2.50mL于5支带刻度试管中,用无水乙醇稀释至10mL,分别加入5.00mL显色剂,摇匀,显色30min,在500nm处测定其吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,求出直线回归方程。
柠檬苦素的提取与测定:取柠檬渣粉末3.0000g于250mL圆底烧瓶中,按照设定的固液比加入一定浓度的乙醇溶液和一定量的硫酸铵,在一定温度下,提取一定时间,抽滤,用分液漏斗将两相分开,取上层清液,减压浓缩,用无水乙醇溶解,转移至25mL容量瓶中,定容。
准确移取提取液0.50mL于25mL比色管中,用无水乙醇稀释至15mL,加入5mL显色剂混合溶液,显色30min后,在500nm波长处测定吸光度。根据标准曲线回归方程,得到提取液浓度。柠檬苦素得率按照下式计算:
Et(%)=(C×V×n)/W×100
式中,Et为得率(%),C为测得的提取液浓度(g/mL),V为提取液体积(mL),n为稀释倍数,W为原料的质量(g)。
1.2.3 乙醇浓度对提取效果的影响 在温度为40℃,硫酸铵用量9g,乙醇用量30mL,提取时间1h的条件下,研究了乙醇体积浓度(20%、30%、40%、50%)对柠檬苦素提取效果的影响。
1.2.4 正交实验 柠檬苦素的得率除受到乙醇浓度的影响外,还受制于很多其他因素。参考文献方法[18],在乙醇体积浓度30%恒定的情况下,以提取温度、时间、料液比(m柠檬:V乙醇)、硫酸铵用量为考察因素,每个因素选取4个水平,使用L16(44)正交表来安排实验,每组实验条件做了3次平行实验。
2 结果与讨论
2.1 标准曲线
柠檬苦素标准曲线如1所示:
从图1可知,其柠檬苦素标准曲线的线性回归方程为A=7.20C-0.0025,R2=0.9962。
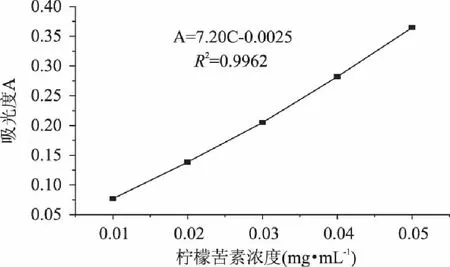
图1 柠檬苦素标准曲线 Fig.1 The standard curve of limonin
2.2 乙醇浓度对提取效果的影响
可供选择的双水相体系较多,本实验选择乙醇-硫酸铵双水相体系,所用试剂无毒,条件温和,其中乙醇浓度是提取效果的一个重要影响因素[18],如图2所示。
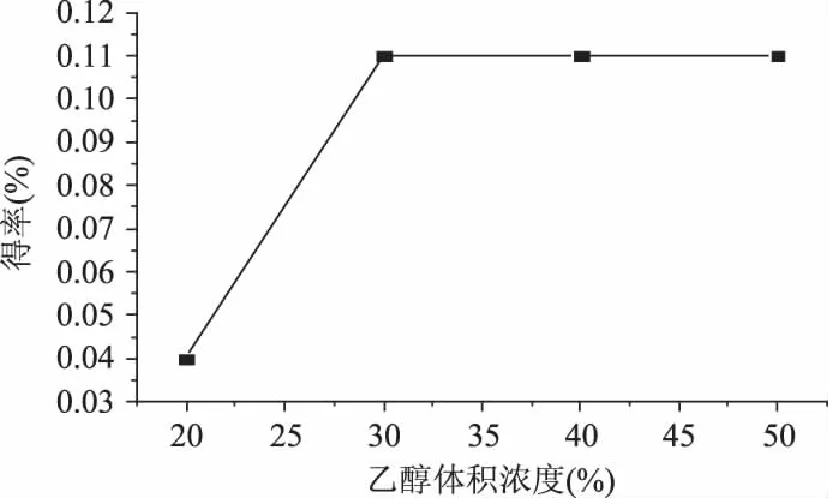
图2 乙醇体积浓度对柠檬苦素得率的影响 Fig.2 Effect of the ethanol concentration on the extraction of the limonin
从图2可知,在硫酸铵用量一定的情况下,随着乙醇浓度增加,柠檬苦素得率逐渐增加,当乙醇体积浓度达到30%时,达到最大,此后乙醇浓度继续增大,柠檬苦素得率没有明显变化。其主要原因可能是,柠檬苦素在乙醇中的溶解度比水中大得多,随着乙醇浓度增加,双水相体系分相能力增加,乙醇在上层的浓度也逐渐增加,柠檬苦素的溶解度增加,当乙醇体积浓度达到30%时,柠檬苦素的浸出率趋于饱和,继续增加乙醇浓度不会给柠檬苦素得率带来明显的变化。从节约资源的角度考虑,确定最佳的乙醇体积浓度为30%。
2.3 正交实验结果分析
正交实验设计、实验结果及极差分析结果见表1。
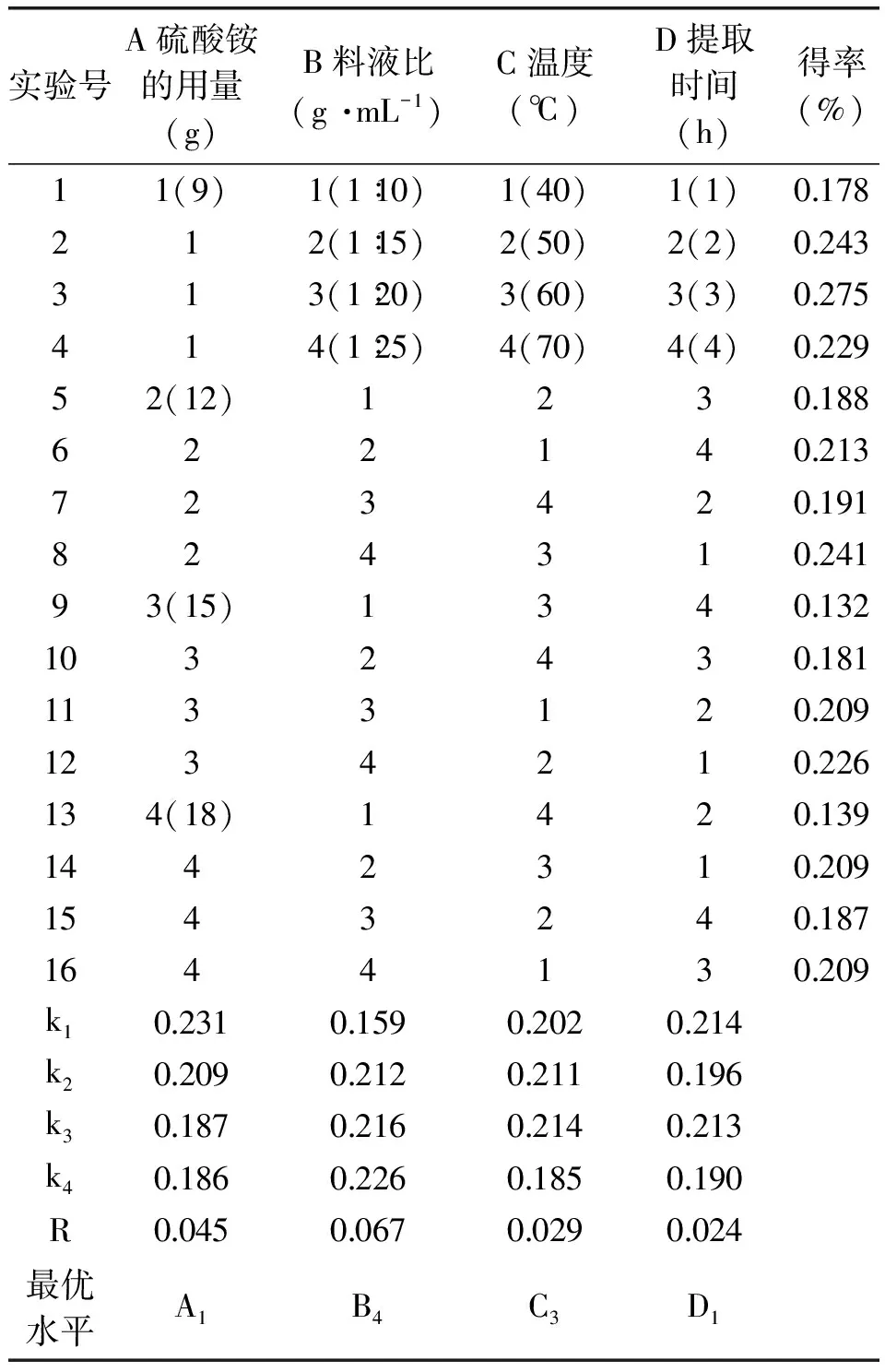
表1 L16(44)正交实验设计及结果Table 1 L16(44)orthogonal experimental design and results
由表1极差R值可知,影响柠檬渣中柠檬苦素得率的因素主次次序为:B>A>C>D,即料液比>硫酸铵用量>提取温度>提取时间。
从对正交实验结果直观分析的角度看,条件A1B3C3D3时,柠檬苦素得率最高;但根据表1极差分析可知,柠檬渣中提取柠檬苦素的最佳工艺条件应为A1B4C3D1,即硫酸铵用量9g,柠檬渣和乙醇的料液比1∶25,提取温度60℃,提取时间1h。由于此最佳组合不在正交实验表中,为验证此条件,对此组合再做了3个验证性平行实验,柠檬苦素的得率分别为0.276%,0.278%,0.283%,平均值0.279%,高于A1B3C3D3时的得率,即正交实验中的最大值,表明A1B4C3D1确实为柠檬渣中提取柠檬苦素的最优工艺参数组合。
3 结论
本文通过设计单因素实验和正交实验,得出了乙醇-硫酸铵双水相体系中影响柠檬苦素得率指标的因素大小顺序为:料液比>硫酸铵用量>提取温度>提取时间;提取柠檬渣中柠檬苦素的最佳工艺条件为:乙醇体积浓度30%,硫酸铵用量9g,柠檬渣和乙醇的料液比1∶25,提取温度60℃,提取时间1h。进而通过实验在最佳工艺条件下提取柠檬渣中柠檬苦素,不但得率较高,而且实验重现性好,说明正交实验得出的结论是正确的。该研究结果对于天然产物中有效成分的提取研究具有一定的参考价值。
[1]陈劲. 柠檬加工利用研究[J]. 四川食品与发酵,2005,41(1):11-15.
[2]高俊燕,朱春华,李进学,等. 柠檬加工综合利用的研究进展[J]. 亚热带农业研究,2009,5(4):64-67.
[3]龚琪,朱春华,多建祖. 柠檬保鲜技术研究现状及前景展望[J]. 安徽农业科学,2012,40(20):10585-10587.
[4]Sun C D,Chen K S,Chen Y,etal. Contents and Antioxidant Capacity of Limonin and Nomilin in Different Tissues of Citrus Fruit of Four Cultivars during Fruit Growth and Maturation[J]. Food Chemistry,2005,93(4):599-605.
[5]施英,徐玉娟,陈卫东,等. 桔核中柠檬苦素类物质最佳提取条件的探讨及清除DPPH 活性研究[J]. 食品与机械,2006,(6):74-76.
[6]Battinelli L,Mengoni F,Lichtner M. Effect of Limonin and Nomilin on HIV-1 Replication on Infected Human Mononuclear Cells[J]. Planta Med,2003,69(10):910-913.
[7]彭腾,邱建平,李鸿翔,等. 川产柑橘属不同品种成熟果皮中柠檬苦素的含量测定[J]. 成都中医药大学学报,2012,35(4):36-38.
[8]温靖,施英,徐玉娟,等. 柑桔果实中柠檬苦素抗炎镇痛作用的研究[J]. 食品科学,2007,28(11):515-518.
[9]田洛,宣依,范荣军,等. 醇碱提取法提取黄芪多糖[J]. 吉林大学学报:理学版,2006,44(4):652-657.
[10]朱菊花. 甘草黄酮类化合物提取分离的研究进展[J]. 中国药业,2010,19(7):88-90.
[11]张珉,钟晓红. 柑橘功能性成分研究进展[J]. 中国农学通报,2009,25(11):137-140.
[12]高一勇. 椪柑中类柠檬苦素提取及产业化研究[J]. 食品工业科技,2009,30(7):359-362.
[13]秦菲,王龙. 原花青素提取方法的研究进展[J]. 北京联合大学学报:自然科学版,2012,26(4):36-39.
[14]汤建国,汪秋安,单杨. 从柑橘皮中超声提取橙皮甙[J]. 精细化工,2004,21(3):171-173.
[15]李建凤,廖立敏,王碧. 超声波提取柠檬皮渣总黄酮研究[J]. 华中师范大学学报:自然科学版,2011,45(3):426-429.
[16]王艳,张铁军. 微波萃取技术在中药有效成分提取中的应用[J]. 中草药,2005,36(3):470-473.
[17]曾祥燕,赵良忠. 响应面分析法优化超临界二氧化碳萃取橘皮中类柠檬苦素工艺[J]. 食品科学,2011,32(22):65-69.
[18]汪建红,廖立敏,王碧. 乙醇-硫酸铵双水相体系提取柠檬渣中总黄酮研究[J]. 华中师范大学学报:自然科学版,2013,47(1):78-81.
[19]汪钊,何晋浙,郑裕国,等. 柑桔果醋加工中柠檬苦素的微生物酶降解研究[J]. 中国酿造,2002(4):21-23.
