软枣猕猴桃果酒酿造工艺的研究
2014-03-22,
,
(沈阳农业大学食品学院,辽宁沈阳 110866)
软枣猕猴桃(Actinidia arguta),俗称软枣子,又名奇异莓(英文:Kiwi berry)或是迷你奇异果,为猕猴桃科猕猴桃属的植物。软枣猕猴桃是猕猴桃属中在中国地域分布最广泛的野生果树之一,分布于东北、华北、山东、西北及长江流域,其中以东北三省的资源最为丰富 。
软枣猕猴桃果实风味独特,柔软多汁,酸甜适口,芳香浓郁,含大量维生素C、淀粉、果胶质等,以及多种微量元素,因此软枣猕猴桃具有较高营养价值,和良好的医疗保健效果,是理想的绿色食品和食疗食品。目前国内外对野生猕猴桃产品研究较少,本实验将软枣猕猴桃破碎后加入辅料,立即入罐带皮渣发酵,一方面可以较好地保留果酒中的营养成分和风味物质,避免了清汁发酵工艺的损耗,同时也简化了工艺流程;另一方面也使果皮及果肉中的色素和风味物质等更好的融入到果酒中,使酒体丰满,口味纯正[1]。软枣猕猴桃果酒酿造的研究不仅充分利用了野生资源,同时提高了软枣猕猴桃果酒的技术含量,促进了软枣猕猴桃的栽培,对野生猕猴桃资源的开发利用有重要意义[2]。
1 材料与方法
1.1 材料与仪器
软枣猕猴桃 采摘自东北野生软枣猕猴桃实验基地;安琪活性干酵母 安琪酵母股份有限公司;白砂糖 食用,市售,湖北亿龙源食品有限公司;NaOH分析纯 上海计量测试技术研究院;酒石酸 食用级,天津市科密欧化学试剂有限公司;亚硫酸氢钠 北京恒业中远化工有限公司;2,6-二氯酚靛酚 天津市科密欧化学试剂有限公司。
PHS-2-型数显酸度计 上海天达仪器有限公司;SL280A榨汁机 浙江苏泊尔炊具股份有限公司;HHS型恒温水浴锅 上海博迅实业有限公司;WYT-32 型手持糖度计 成都光学仪器厂;SS-325型高压灭菌锅 上虞市青峰仪器设备有限公司;数显式恒温水浴锅 上海亚荣仪器制造有限公司;比重计 北京中西远大科技有限公司。
1.2 实验方法
1.2.1 软枣猕猴桃酿造工艺流程 新鲜软枣猕猴桃→分选清洗→破碎榨汁→果汁成分调整→灭菌→酒精发酵→澄清过滤→原酒→调配成品
1.2.2 软枣猕猴果酒发酵工艺的研究
1.2.2.1 单因素实验 本实验选取对软枣猕猴桃果酒酒度和感官品质影响较大的五个因素进行考察[3-4]。
糖含量的确定:分别将果汁糖含量调至为17%、20%、23%、26%、29%,调制酸度pH为3.3按1.5 ‰接种,SO2添加量为70mg/L在26℃条件下进行发酵,至含糖量基本保持不变时停止发酵,测所得酒液的酒精度。
酸度的确定:将软枣猕猴桃果浆用酒石酸分别调整pH至2.9、3.1、3.3、3.5、3.7,SO2添加量为70mg/L在26℃,酵母接种量为1.5‰条件下进行发酵,至含糖量基本保持不变时停止发酵。测得所得酒液的酒精度。
SO2添加量的确定:软枣猕猴桃压榨成汁后分别加入30、50、70、90、110mg/L的SO2,调整含糖量为20%,pH为3.3,SO2添加量为70mg/L在26℃,按1.5 ‰接种,至含糖量基本保持不变,停止发酵测所得酒液的酒精度。
接种量的确定:将软枣猕猴桃果汁的含糖量调整为20%,pH调整至3.3,SO2添加量为70mg/L在26℃,分别按0.5‰、1‰、1.5‰、2‰、2.5‰接种酵母菌进行发酵,至含糖量基本保持不变,停止发酵,测所得酒液的酒精度以及发酵时间。
发酵温度的确定:将软枣猕猴桃果汁含糖量调整为20%,pH调整至3.3,按1.5‰接种,SO2添加量为70mg/L分别在20、22、24、26、28℃条件下进行发酵,至含糖量基本保持不变,停止发酵,测所得酒液的酒精度以及发酵时间。
1.2.2.2 响应面分析 在单因素实验的基础上,选取对果酒的口感和风味影响较大的三个因素作为主要的考察因子。通过 Box-Benhnken 中心组合设计,以三个因素为自变量(分别为X1、X2、X3),以感官评价值为响应值,感官评价人员由经过专业培训的20人组成,分别从口感、风味、色泽三方面重复品评。实验采用Minitab15.0三因子三水平共15个实验点的响应面分析实验来优化软枣猕猴桃果酒的最佳工艺条件[5],实验因子水平编码表见表1,感官评分标准见表2。
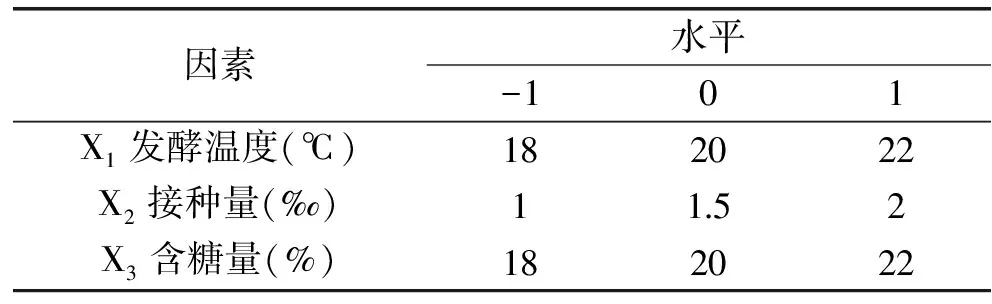
表1 实验因子水平编码表Table 1 Codes and levels of factors chosen for test

表2 感官评定标准Table 2 Criterion of sensory evaluation for fruit wine
1.2.3 理化指标检测方法 软枣猕猴桃果酒酒精度采用比重法测定;果酒中总糖和还原糖采用斐林试剂滴定法测定;利用手持折光仪测定果酒中可溶性固形物的含量;果酒的pH用 pH 计测定;果酒中滴定酸(以酒石酸计)含量采用滴定法测定,成品果酒进行大肠杆菌的测定以及菌落总数的检测。
2 结果与分析
2.1 初始糖含量对软枣猕猴桃汁酒精发酵的影响
制作果酒时酵母将发酵醪中的糖转化为乙醇,为使生成的乙醇含量达到成品酒标准要求,通常需要对果酒中的糖分进行调整。由图1可以看出,随着加糖量的增加,酒精度也随之升高,当初始含糖量在20%左右时,酒精度最大,当糖度在20%~29%时,随着加糖量的增加酒精度反而降低,这是因为糖含量高,虽然酒精度也会提高,但高浓度的糖会对酵母造成过高渗透压而影响酵母的发酵,从而导致酒精度的降低[6]。因此本实验选取起始含糖量20%。
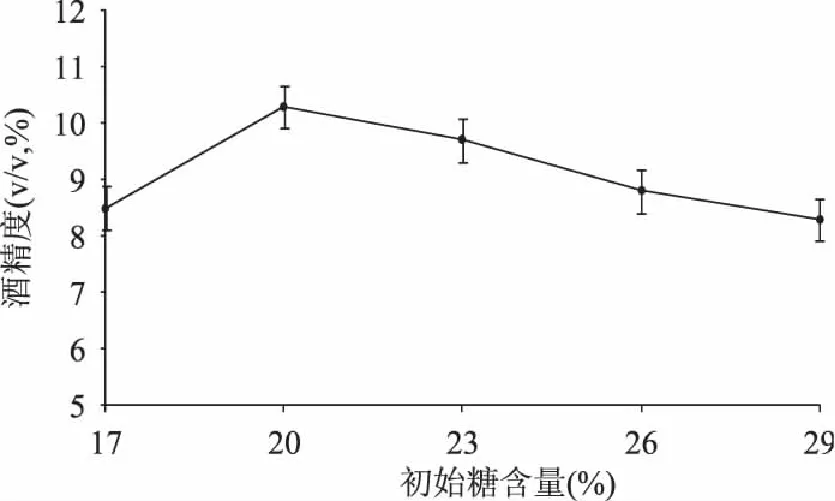
图1 初始含糖量对酒精发酵的影响 Fig.1 Effect of sugar content on alcohol fermentation
2.2 酸度对酒精发酵的影响
酵母菌在微酸(pH4)条件下最适合生长繁殖,但较低的pH有利于某些氨基酸的吸收,有助于SO2的杀菌作用,而且会促使乙基酯和乙酸酯的水解,生成挥发性酸,改善果酒的口味,故本实验选取的酸度范围在pH为2.9~3.7。由图2可知随着pH的增大,所得酒精度逐渐升高,pH过高会使人不快,酒味香气均不纯正,pH过低很难将果汁发酵彻底,且会使果酒不易保存,SO2达不到要求,风味平淡[7-13]。故选取pH为3.3较为适宜。
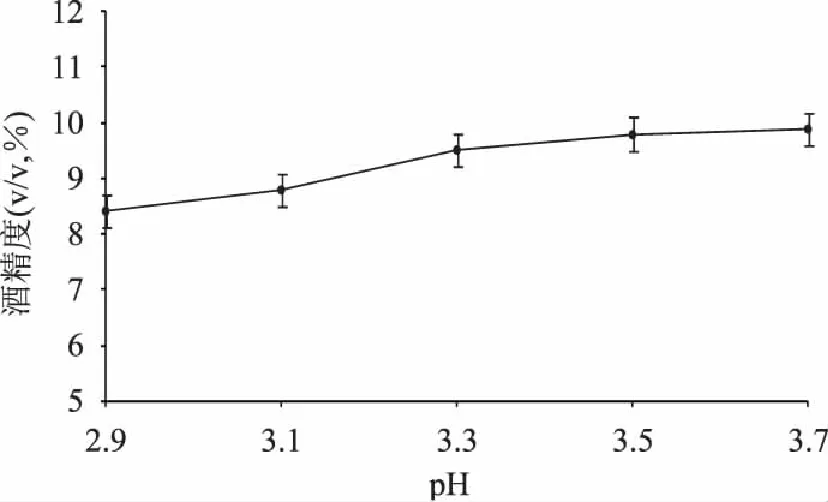
图2 pH对酒精发酵的影响 Fig.2 Effect of initial pH on alcohol fermentation
2.3 SO2对酒精发酵的影响
在整果破碎后,应立即加入SO2,这样不仅迅速抑制了果汁的进一步氧化,而且在随后的24h内,果酒基质立刻达到所需要的分子态二氧化硫浓度,保证菌种添加后向正确方向进行。由图3可知,当SO2浓度超过70mg/L时,酒精度逐渐降低,这是因为过高的SO2浓度抑制了酵母的生长繁殖,杀死了部分酵母从而影响了酒精度[8]。故本实验选取SO2浓度为70mg/L。

表3 pH对果酒品质的影响Table 3 Effect of pH on wine quality

图3 SO2添加量对酒精发酵的影响 Fig.3 Effect of the amount of SO2 on alcohol fermentation
2.4 接种量对酒精发酵的影响
由图4可知,接种量大,菌体繁殖率高,发酵速度快,发酵周期短。接种量过大,发酵培养基中的营养物质多消耗在菌体繁殖上,会导致酵母活性不足,酒精度降低;接种量太少,会造成酒精发酵不完全、发酵迟缓、酒度低、易引起杂菌繁殖。因此选择接种量1.5‰为宜。

图4 接种量对酒精发酵的影响 Fig.4 Effect of inoculation quantity on alcohol fermentation
2.5 发酵温度对酒精发酵的影响
温度是影响发酵的重要因素之一,温度过高或过低都会引起酵母的死亡。果酒的酿造过程不仅仅是乙醇的生成,还包括香气物质的生成和保留,因此综合各方面考虑果酒发酵温度应低于乙醇的最适温度。本实验选取18~26℃进行发酵,由图5可知,随着温度升高发酵时间缩短,酒精度也随之升高,当高于20℃后酒精度有所降低,这是因为虽然温度升高使酵母繁殖快,但是由于酵母的快速繁殖使得发酵周期变短,酵母衰老变快,发酵结束较早。所以会使得产品酒度低。故本实验采取低温发酵控制温度在20℃[9-10]。
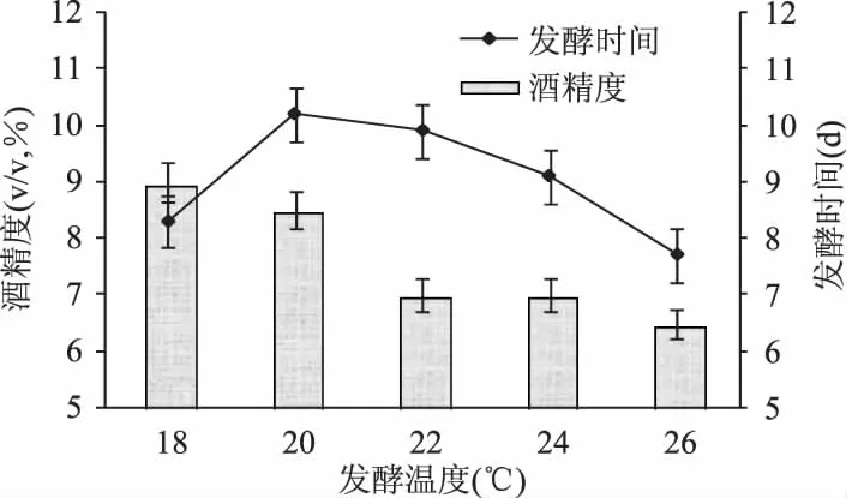
图5 温度对酒精发酵的影响 Fig.5 Effect of fermentation temperature on alcohol fermentation
2.6 酒精发酵工艺的优化
响应面法以最经济的方式、较少的实验次数和较短的时间对所选的实验参数进行全面研究。根据 Box-Benhnken 的中心组合实验设计原理,根据单因素实验结果选取影响较大的三个因素:温度(X1)、接种量(X2)、初始糖含量(X3)进行组合,采用Minitab15.0软件对所得数据进行回归分析,实验设计及结果见表4。
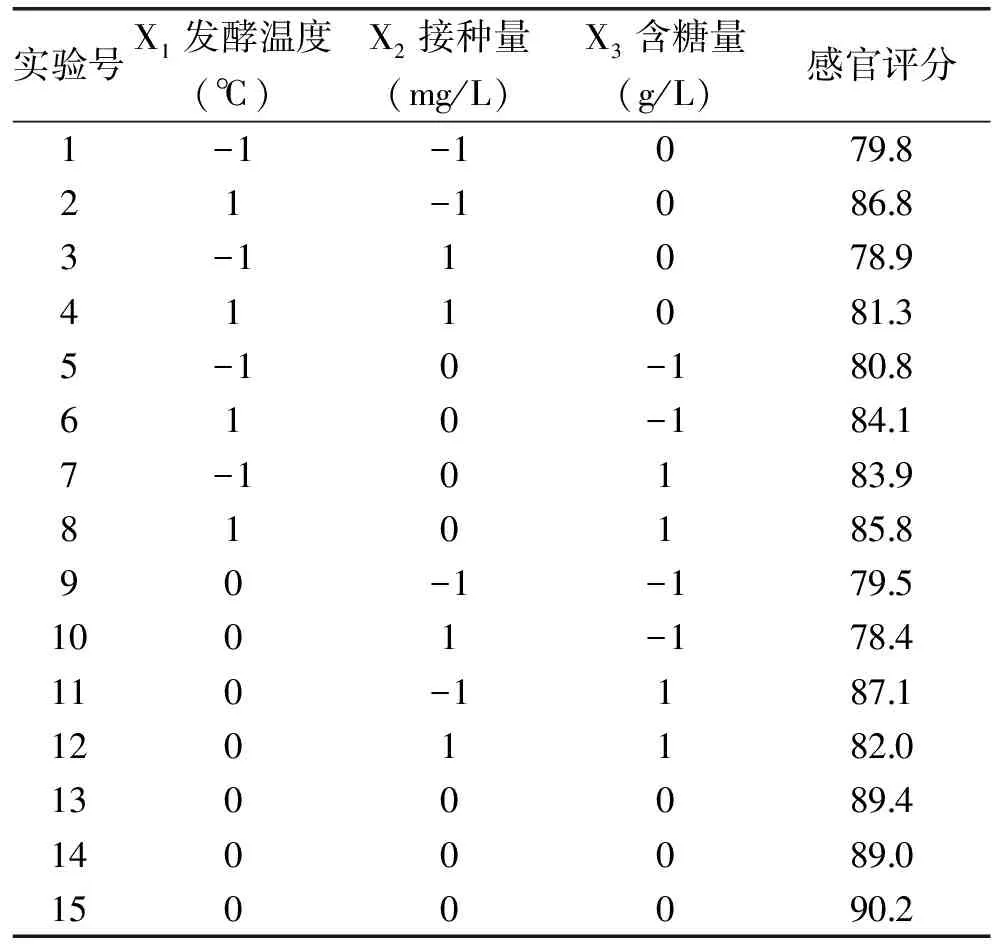
表4 Box-Behnken 设计方案及结果Table 4 Program and results of Box-Behnken design
用Minitab15.0软件对表2中数据进行数据分析得到感官评价值对自变量发酵温度、接种量、含糖量的二次多项回归模型方程:
Y=89.5+1.83X1-1.58X2+2X3-2.97X12-4.87X22-2.92X32-1.15X1X2-0.35X1X3-X2X3
2.6.1 回归模型方程的建立及其显著性检验 对该模型方程进行方差分析及显著性检验,结果见表5和表6。

表5 回归方程方差分析Table 5 Variance analysis of regression equation
由表5可知,回归方程的p=0.004<0.01极显著,失拟项p=0.135>0.05,说明方程不失拟,可以用此模型分析和预测软枣猕猴酒精发酵的最佳条件。从表6回归方程系数显著性检验可知:方程一次项中X1发酵温度(p=0.010≤0.01)和X3含糖量(p=0.007<0.01)影响极显著,X2接种量(p=0.017<0.05)影响显著;二次项中三者影响均为极显著;交互项p值均大于0.05影响不显著,说明软枣猕猴桃果酒发酵工艺的三个因素之间对酒精发酵工艺没有明显的交互作用[5]。

表6 回归方程系数显著性检验Table 6 Significance test for regression coefficients
2.6.2 软枣猕猴桃果酒发酵最佳工艺的响应面分析与优化 根据回归方程,采用 Minitab15.0统计软件绘制响应曲面图,考察所拟合的响应曲面的形状。响应面图可直观地反映各因素的交互作用对响应值的影响,如图6所示。
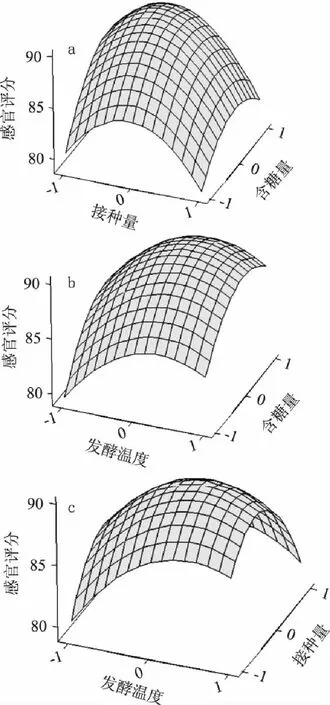
图6 含糖量、接种量和发酵温度对感官评价影响的响应面 Fig.6 Response surface plot of sensory evaluation effects for content of sugar content,inoculation quantity and fermentation temperature
图6a显示了软枣猕猴桃果酒发酵的含糖量和接种量对感官评价的影响。当含糖量为0.4水平(即20.8%)、接种量为-0.2水平(即1.4‰)时果酒感官评价值最大。图6b显示了含糖量和发酵温度对感官评价的影响。当含糖量为0.3水平(即20.6%)、发酵温度为0.3水平(即20.6℃)时,果酒风味和口感较好。图6c为发酵温度和接种量对感官评价的影响。当发酵温度为0.3水平(即20.6℃)、接种量为0.2水平(即1.6‰)时,果酒的感官评价值较高。
2.6.3 响应面验证实验 为了进一步确证软枣猕猴桃果酒的最佳发酵工艺条件,对拟合的二次回归模型方程取一阶偏导等于零并整理得:X1≈0.3332;X2≈-0.2389;X3≈0.3634。与其相对应的软枣猕猴桃果酒发酵最佳工艺条件为:糖含量为20.7%,接种量为1.4‰,发酵温度20.7℃,此时果酒的口感和风味均为最佳。
2.7 理化指标
根据响应面法优化的结果,以糖含量为20.7%,接种量为1.4‰,发酵温度20.7℃,酿制软枣猕猴桃果酒,成品于冰箱中冷藏,将贮酒容器添满,1个月后取出,并对其质量指标进行分析[12]。
2.7.1 软枣猕猴桃果酒的感官指标 该酒浅金黄色、有光泽、澄清透明、酒体圆润、无沉淀物、口感清爽、回味悠长、典型性好、浓郁优雅、具有软枣猕猴桃的果香。
2.7.2 软枣猕猴桃的理化指标和生物指标 酒精度(V/V,20℃)11.2%±1%;总糖(以葡萄糖计)≤4g/L;总酸(以酒石酸计)4~8g/L;挥发酸(以醋酸计)≤1g/L细菌总数≤100CFU/mL;大肠菌群≤3CFU/100mL;致病菌不得检出。
3 结论
通过对酒精发酵阶段工艺参数的响应面分析,确定了最适合本工艺的参数为含糖量20.7g/L、酵母接种量1.4‰、发酵温度20.7℃,发酵完全结束后可得到酒精度为10.4%的软枣猕猴桃果酒。此法生产的软枣猕猴桃果酒呈浅黄色,果香浓郁酸甜适口,风味独特,营养丰富,感官评分为92.1。
经发酵后,软枣猕猴桃果实自身的大部分营养物质得到保存,融入到了软枣猕猴桃果酒当中,使果酒有了软枣猕猴桃特有的风味。同时,酵母菌发酵过程中产生多种风味物质,使果酒形成特殊风味。因此软枣猕猴桃果酒发酵工艺的研究对软枣猕猴桃果实的开发利用具有重要理论意义[13-14]。
[1]张超,徐洲,游玲,等.野生猕猴桃果酒带渣发酵的研究[J].食品研究与开发,2012,33(8):23-27.
[2]朴一龙,赵兰花.软枣猕猴桃研究进展[J].北方园艺,2008(3):76-78.
[3]沈红侠,赵庆阳.野生猕猴桃果酒酿制工艺流程[J].农家参谋·种业大观,2011(10):39.
[4]王燕,唐梅,刘杨,等.液态发酵生产峨眉山野生猕猴桃酒工艺探索[J].中国酿造,2010(8):178-180.
[5]王海平,黄和升,郭雷,等.响应面法优化樱桃果酒发酵条件[J].中国酿造,2011(9):75-79.
[6]杨幼慧,张莉萍,郑素霞,等.影响果酒发酵质量的因素及其控制方法[J].中国酿造,2002(1):28-30.
[7]Seungmi Woo,Myunghee Lee,Jihyung Seo,etal.Quality Characteristics of Kiwi Wine on Alcohol Fermentation Strains[J].Journal of the Korean Society of Food Science and Nutrition,2007,36(6):800-806.
[8]赵中胜,韦娜,富维纳,等.猕猴桃酒发酵工艺研究[J].安徽农业科学,2012(6):3548-3550.
[9]徐清萍,朱广存.野生猕猴桃酒发酵工艺研究[J].酿酒科技,2010(10):79-81.
[10]张雪松,张婧.猕猴桃酒的酿制技术[J].中小企业科技,2004(11):42.
[11]王燕.野生猕猴桃果酒发酵原料筛选与最佳配比研究[J].酿酒科技,2011(10):32-34.
[12]GB/T15038-2006[S]葡萄酒、果酒通用分析方法.
[13]曾洁,李颖畅.果酒生产技术[M].北京:中国轻工业出版社,2011:187-208.
[14]杜金华,金玉红.果酒生产技术[M].北京:化学工业出版社,2010:126-128.
