响应面法优化天蚕素抗菌肽培养条件的研究
2014-03-22,,,,,
, , ,,,
(广州市微生物研究所,广东广州 510663)
抗菌肽属于生物体内诱导而产生的一种生物活性多肽小分子,分子量在2000~7000左右,由20~60个氨基酸残基组成[1]。抗菌肽抗菌谱比传统抗生素广,抗菌活性高[2],既能抗革兰氏阳性菌和革兰氏阴性菌,又有抗真菌和病毒的作用[3]。
天蚕素抗菌肽在1972年首次分离得到是第一个被发现的动物抗菌肽[4],其作用机理是破坏病原菌细胞膜,从而达到抗菌作用,其作用不涉及特定靶位,因此几乎不产生抗药性。比起传统抗生素,天蚕素抗菌肽具有无残留、低耐药性的特点,因此具有广阔的前景。目前天蚕素抗菌肽发现大约有89种[5],部分已被利用基因工程技术方法将其表达[6]。其中利用枯草芽孢杆菌表达载体表达的天蚕素抗菌肽具有比其他抗菌肽活性更高的特点[7]。
目前,对抗菌肽的发酵已展开广泛的研究,近年已有报道用传统单因素法和正交设计法对天蚕素类抗菌肽的培养基进行优化[8],但该方法优化出的方案具有局限性,会忽略多个因子之间的交互作用,得到的方案通常不是最优方案。Plackett-Burman和响应面分析法,在微生物培养条件的优化工作中取得良好的效果,本研究选取8个对天蚕素抗菌肽生产菌株的相关因子进行设计,筛选出对其分泌抗菌肽显著影响因子,再采用响应面分析的方法,以产生的抗菌肽杀菌效价为响应值,研究显著因子对效价的影响,得到最优条件,并在500L中试水平的发酵罐上进行验证,以期为工业生产提供理论依据。
1 材料与方法
1.1 材料与仪器
抗菌肽生产菌KJ05和大肠杆菌K12D31为本课题组保藏。种子培养基:甘油2%,蛋白胨2%,酵母膏1%,pH自然。发酵培养基:葡萄糖3%,蛋白胨1%,酵母膏2%,NaCl 0.5%,pH自然。固态大肠杆菌培养基:蛋白胨1%,酵母粉0.5%,NaCl 0.5%,琼脂粉2%,pH自然。
pHS-25 数显酸度计 上海雷磁仪器厂;ZY-3000IV抑菌圈自动测量分析仪 北京先驱威锋技术开发公司;50L、500L不锈钢发酵罐 上海洋格生物工程设备有限公司。
1.2 培养方法
斜面菌株活化后,接入种子摇瓶中,200r/min、30℃培养20h后接种5%到发酵培养基中,200r/min、30℃培养24h后取样进行效价测定。
1.3 效价测定方法
配制固态大肠杆菌培养基,灭菌后冷却至50℃时加入6mL至已灭菌平皿(Φ=75mm)中,指示菌大肠杆菌K12D31菌液(浓度约106cfu/mL)5μL加入以上平皿中,迅速震荡摇匀,水平放置,凝固后用打孔器按指定位置(2.7mm)打孔,备用。
发酵液3000r/min离心5min后,取5μL加入到打孔处,每个样品重复3次,37℃培养18h,用抑菌圈测定仪测定抑菌圈直径(mm),按照下列公式进行效价计算[9]:
杀菌效价(U/mL)=2x×1000
其中x=(抑菌圈直径-2.7)/2.1
1.4 培养基优化方法
1.4.1 Plackett-Burman法筛选影响分泌抗菌肽效价的重要因素 影响天蚕素抗菌肽分泌杀菌效价的可能因素包括:葡萄糖、酵母膏、蛋白胨、氯化钠、接种量、接种龄、初始pH以及培养温度等8个因素,用Design Expert(version 8.0.5)软件进行N=11的Plackett-Burman设计[10]如表1所示,通过实验确定各因素的显著水平。
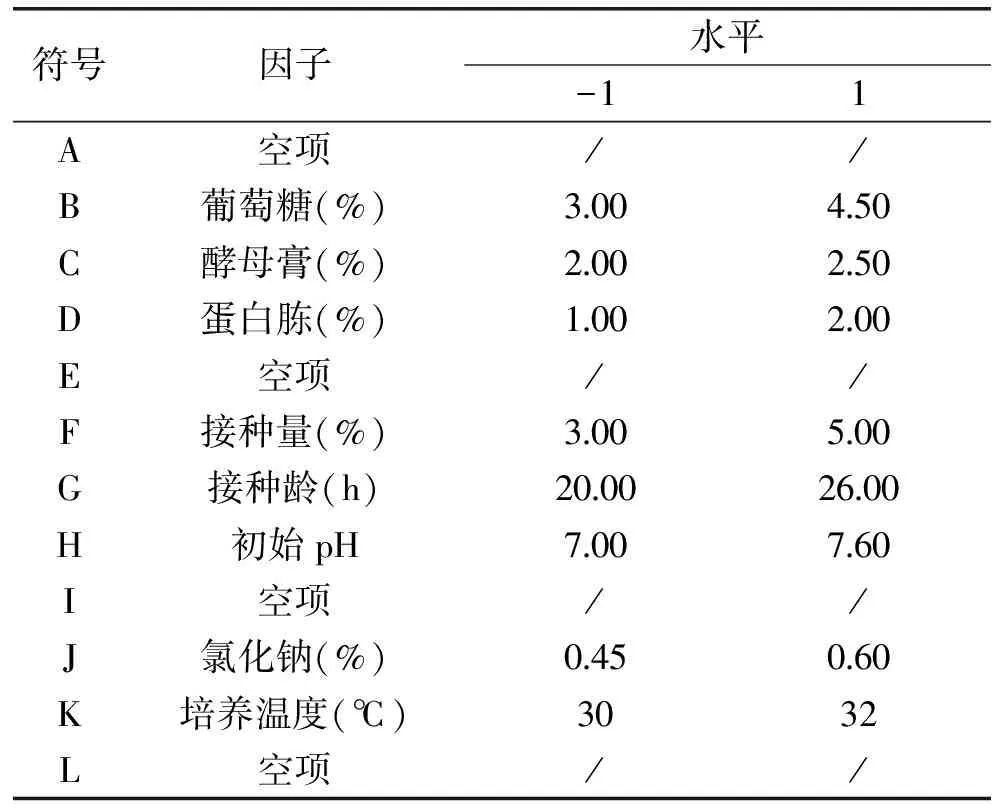
表1 Plackett-Burman设计因子水平表Table 1 Levels and factors of Plackett-Burman design experiment
1.4.2 中心组合实验设计 从Plachett-Burman实验结果可知,葡萄糖、接种量、起始pH为影响分泌抗菌肽杀菌效价的关键因素,因此选择该三因素作为研究对象,以抗菌肽的杀菌效价作为响应值设计中心组合实验,软件使用Design Expert(version 8.0.5)设计。中心组合实验设定实验因素水平和编码如表2所示。并得出最优条件。
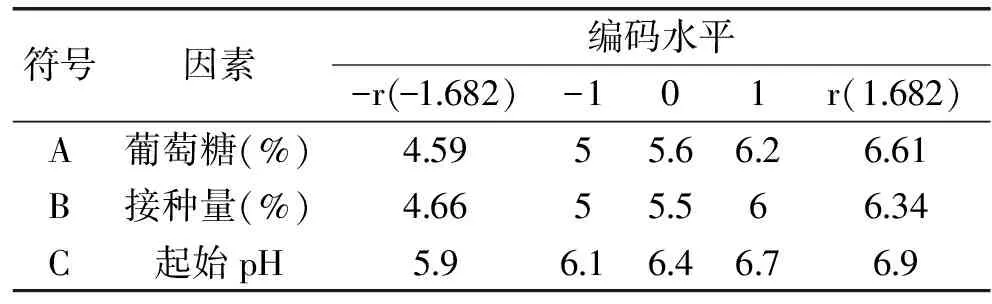
表2 实验因素水平编码Table 2 Factors and code levels of central composite design experiment
2 结果与分析
2.1 Plackett-Burman法筛选影响分泌抗菌肽效价的重要因素
以分泌的抗菌肽杀菌效价为响应值分别计算葡萄糖、酵母膏、蛋白胨、氯化钠、接种量、接种龄、初始pH以及培养温度的显著水平。按实验因素水平,设计出N=11的Plackett-Burman实验设计,进行14次,得到相应的天蚕素抗菌肽杀菌效价(U/mL)实验结果见表3。并对各个因素进行显著性分析,具体见表4。
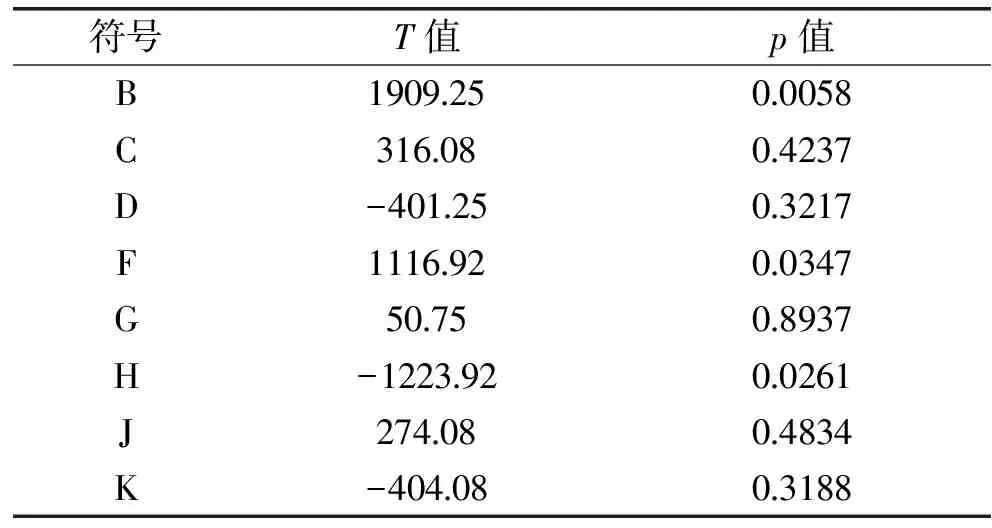
表4 Plackett-Burman实验各因素效应分析Table 4 Effect analysis of the Plackett-Burman design factors
从表4分析可知,因素B、F、H的p值均小于0.05,故为影响天蚕素抗菌肽效价的显著因子。所以选择该三个因素作为主要研究对象进行进一步优化工作,其余因素按照其相应的T值正负效应选择高水平与低水平:酵母膏、接种龄、氯化钠为高水平,蛋白胨、培养温度为低水平,即以后优化培养基为:酵母膏(2.5%)、蛋白胨(1%)、氯化钠(0.6%)、接种龄(26h)、培养温度(30℃)。
2.2 中心组合实验
2.2.1 最陡爬坡实验 根据Plackett-Burman实验的结果,选取对天蚕素抗菌肽效价影响最大的因子葡萄糖、起始pH和接种量进行最陡爬坡实验,以确定其浓度范围和步长。其他因子选取中心点值,根据分析计算得出葡萄糖、起始pH和接种量的步长,设计最陡爬坡实验表如表5所示,以抗菌肽效价为响应值进行实验。
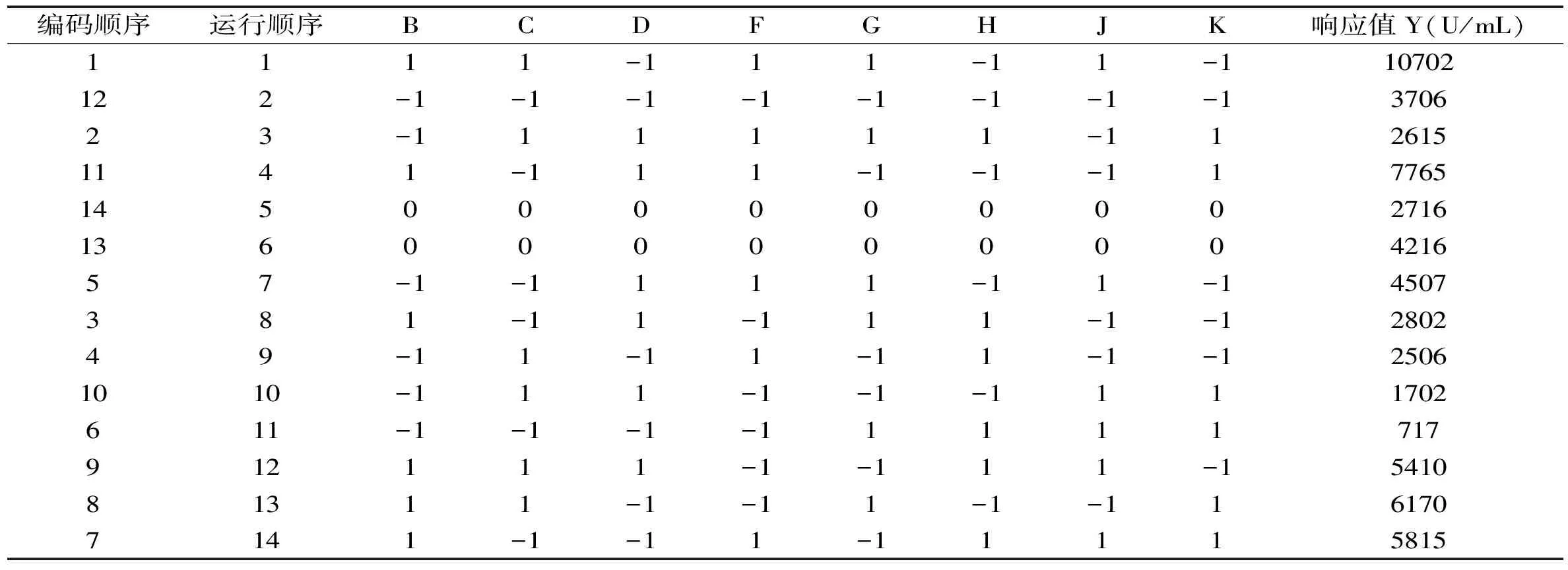
表3 Plackett-Burman实验设计及实验结果Table 3 Result of Plackett-Burman design
以上6组实验中,第三组中的抗菌肽效价最高,达12570U/mL。因此,响应面中心组合实验设计中选取第三组数据位实验中心点。
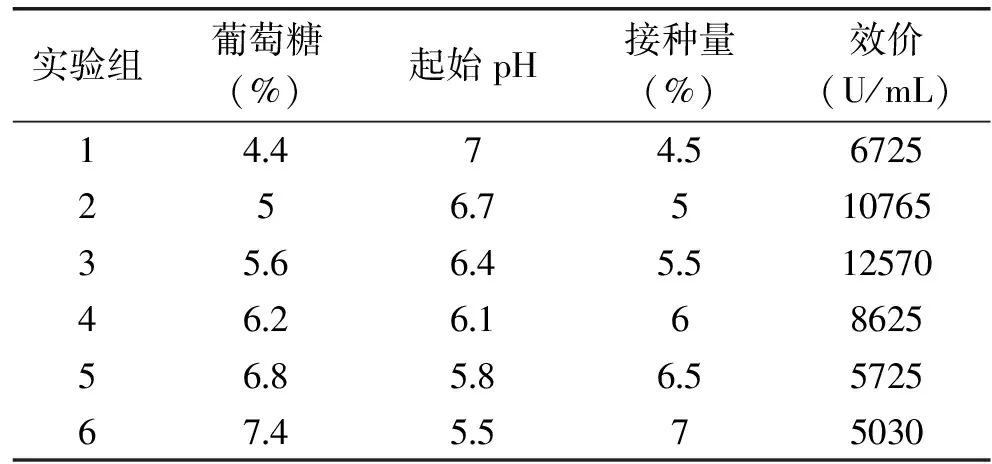
表5 最陡爬坡实验设计及实验结果Table 5 Results of steepest ascent experiment
2.2.2 中心组合实验设计 三个主要显著因素葡萄糖、起始pH、接种量分别设为因素A、B、C,抗菌肽效价为响应值Y,按照中心组合实验设定实验因素水平和编码。设实验中心点重复次数为6,设计中心组合实验,并根据20组实验条件测定各实验组抗菌肽效价,实验结果见表6。
根据实验结果,利用Design-Expert软件的分析功能进行分析如表7所示,得到编码制的回归方程:
Y=12639.19+605.05×A-197.04×B+605.05×C+203.13×A×B-374.37×A×C+334.38×B×C-1561.99×A2-861.95×B2-983.05×C2
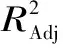
通过Design-Expert软件绘制结果响应面图,如图1~图3所示,可以看出该模型具有最优解,利用软件分析计算得最优解为:葡萄糖(5.7%),接种量(5.6%),起始pH(6.4)。
2.3 验证实验
对优化后培养条件进行验证实验:葡萄糖(5.7%),接种量(5.6%),起始pH(6.4)、酵母膏(2.5%)、蛋白胨(1%)、氯化钠(0.6%)、接种龄(26h)、培养温度(30℃),共进行3组250mL摇瓶实验,实验结果分别为:12806、13042、12710U/mL,平均效价为12852U/mL,证明该模型比较可靠,且较优化前效价提高30.7%。
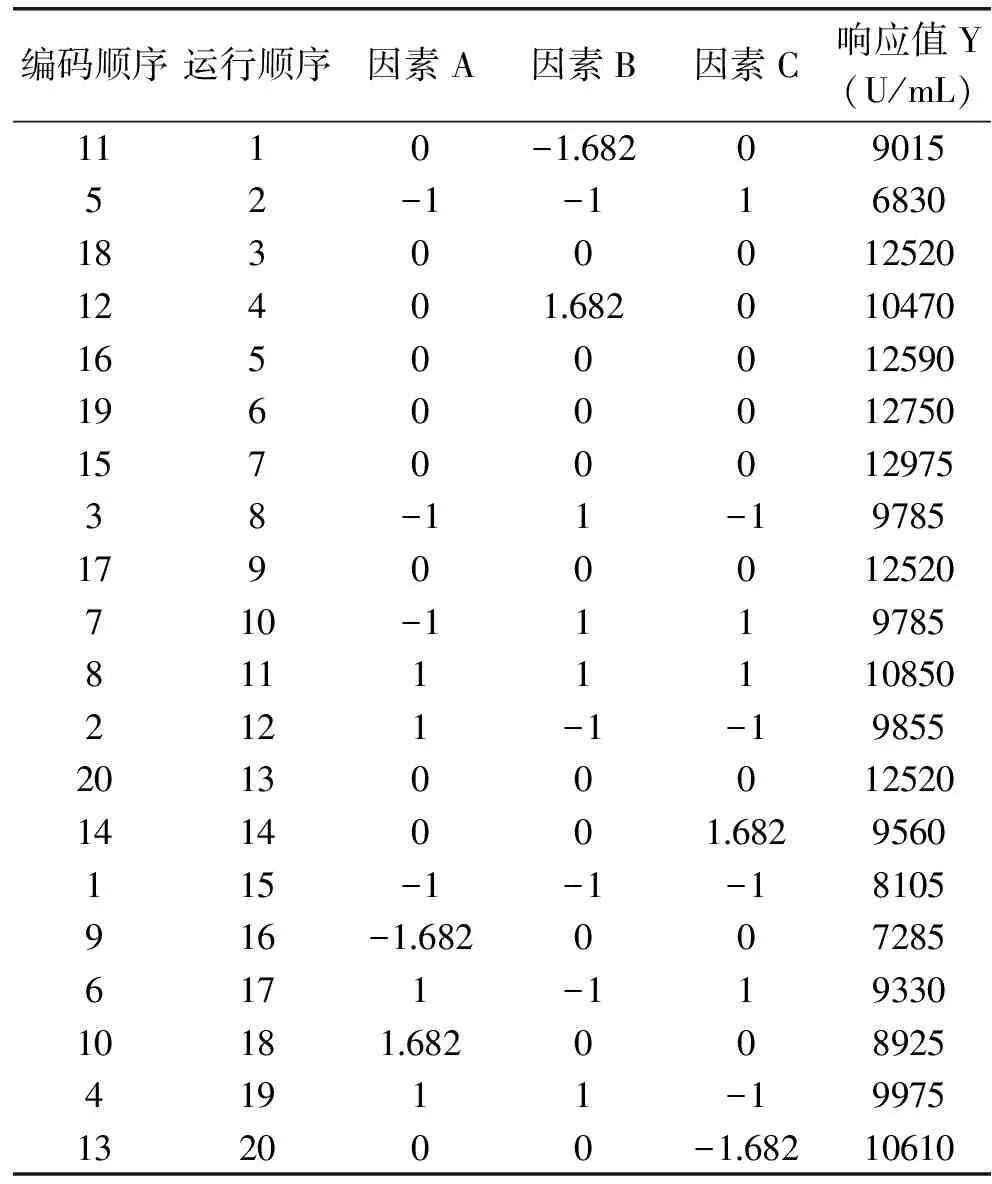
表6 中心组合实验设计及实验结果Table 6 Result of central composite design
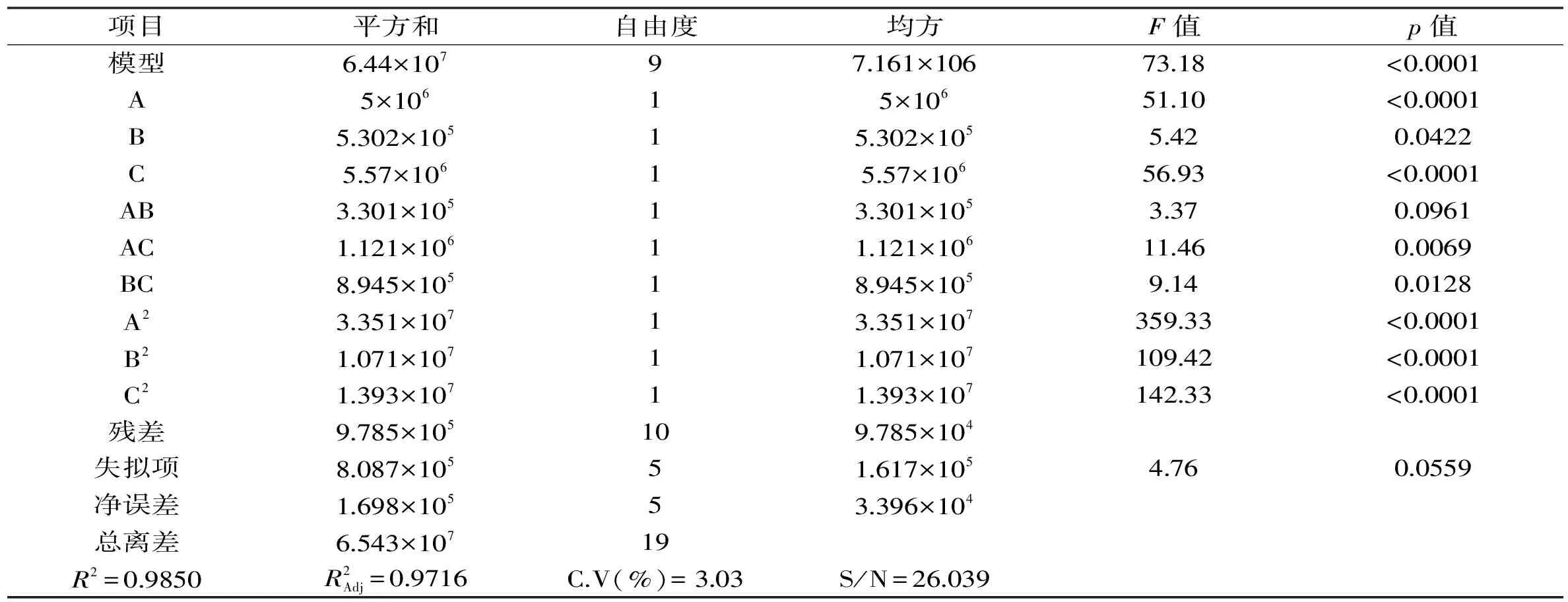
表7 回归方程方差分析表Table 7 Analysis results of regression and variance

图1 葡萄糖与接种量的响应面图 Fig.1 Response surface curve of the interaction between glucose and inoculation amount
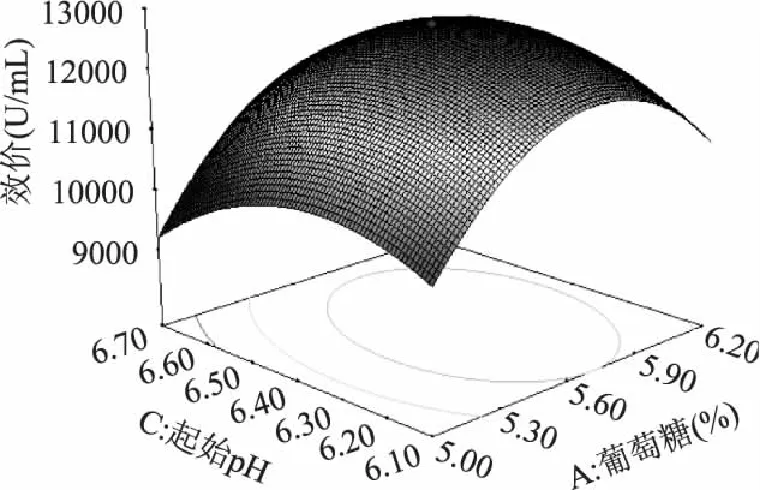
图2 葡萄糖与起始pH的响应面图 Fig.2 Response surface curve of the interaction between glucose and pH
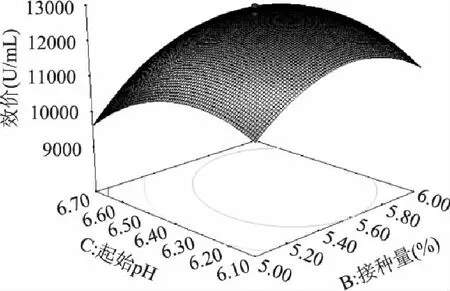
图3 接种量与起始pH的响应面图 Fig.3 Response surface curve of the interaction between inoculation amount and pH
2.4 发酵中试实验
为进一步确定该模型可靠性,在500L发酵罐上进行放大实验。培养条件按照优化后条件,其余条件为通风量0.6~0.8m3/h,搅拌转速为200r/min,罐压保持0.4~0.6MPa。发酵20h后测得杀菌效价达15520U/mL,该结果明显优于摇瓶实验结果,推测其原因在于发酵罐培养过程中溶氧量明显高于摇瓶,更利于菌体生长,代谢出的抗菌物质能快速扩散降低后期的反馈抑制作用。
3 结论
本文通过使用Plackett-Burman设计筛选出对天蚕素抗菌肽杀菌效价影响的显著因子,对其再进行梯度寻优确定中心点以及步长,进一步使用中心组合实验对显著因子进行优化,得到回归方程,求出最优解。优化后培养条件及培养基为:葡萄糖(5.7%),接种量(5.6%),起始pH(6.4)、酵母膏(2.5%)、蛋白胨(1%)、氯化钠(0.6%)、接种龄(26h)、培养温度(30℃)。优化后摇瓶杀菌效价为12852U/mL,较优化前提高了30.7%,优化后的培养基更适合KJ05的生长以及抗菌肽的合成与分泌,根据其条件进行500L发酵罐中试实验,利用50L发酵罐作为种子培养罐,使其接种量达到5.6%,其发酵液效价能达到15520U/mL。这表明该模型较可靠,具有实际应用价值,能在今后天蚕素抗菌肽大规模生产中提供理论依据。
[1]杜淑环,刘秀明,万秋,等.天蚕素抗菌肽的研究进展[J].动物营养学报,2012,24(1):41-47.
[2]Vunnam S,Iuvvadi P,Merrifield RB. Synthesis and antibacterial axtion of cecropin and praline-arginine-rich peptides from pig intestine[J]. J Pept Res,1997,49(1):59-66.
[3]Wachinger M,Kleinschmidet A,Winderd,etal. Antimicrobial peptides melittin and cecropininhibit replication of human immunodeficiency virus by suppressing viral gene expression[J].Journal of General Virology,1998,79(4):731-740.
[4]Boman H G,Nilsson I,Rasmuson B. Inducible antibacterial defence system in drosophila[J]. Nature,1972,237:232-235.
[5]韩晋辉,崔培,施用晖,等.设计天蚕素抗菌肽在E.coli中的表达及活性鉴定[J].食品与生物技术学报,2008,27(6):86-89.
[6]黄自然,黄亚东,温刘发,等. 抗菌肽生物工程及其应用[J].蚕业科学,2005,31(4):375-381.
[7]宋智娟,李希,李波,等. 天蚕素抗菌肽的优势及其应用新进展[J].生物饲料添加剂应用技术,2013,54(4):54-57.
[8]秦鹏,赵培静,梁淑娃,等. 天蚕素抗菌肽发酵培养基优化[J].现代食品科技,2012,28(8):1046-1048.
[9]梁洁,彭中键,梁淑娃,等. 转基因酵母菌深层发酵生产抗菌肽的研究[J].现代食品科技,2009,25(6):639-640.
[10]吴有炜.实验设计与数据处理[M].苏州:苏州大学出版社,2003.
