血清SOD、MDA、NO在波动性高血糖糖尿病大鼠中的表达
2014-03-22王露王薇杨咪咪包国荣索琳娜张微
王露,王薇,杨咪咪,包国荣,索琳娜,张微
(1.中国医科大学附属第四医院内分泌科,沈阳110032;2.山西医科大学公共卫生学院2010级预防医学,太原030001)
血清SOD、MDA、NO在波动性高血糖糖尿病大鼠中的表达
王露1,王薇1,杨咪咪2,包国荣1,索琳娜1,张微1
(1.中国医科大学附属第四医院内分泌科,沈阳110032;2.山西医科大学公共卫生学院2010级预防医学,太原030001)
目的观察血糖波动对糖尿病大鼠血清超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)表达水平的影响。方法SD大鼠60只,随机分成正常饲料喂养组(正常组,n=20)和高糖高脂饲料喂养模型组(模型组,n=40),模型组SD大鼠6周后用小剂量链尿佐菌素(STZ)建立SD大鼠糖尿病模型,之后随机分为持续高血糖组(MS组,n=20)和血糖波动组(MF组,n=20),MF组错时腹腔注射葡萄糖、胰岛素,制备糖尿病血糖波动大鼠模型,正常组和MS组均同时腹腔注射等量生理盐水。测定各组大鼠血糖(Glu)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)及血清超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)水平。结果(1)MS和MF组TG、LDL-C均明显高于正常组(P<0.01),而HDL-C均显著低于正常组(P<0.01);(2)与正常组比较,MS组和MF组SOD、MDA、NO值均有统计学差异(P均<0.05),MF组SOD、MDA、NO水平高于MS组(P<0.05)。结论2型糖尿病大鼠体内存在血管内皮损伤和氧化应激;持续高血糖可以损伤血管内皮细胞;血糖的剧烈波动较持续性高血糖引起SOD、MDA、NO变化更为显著,可能导致更为严重的血管内皮细胞损伤。
血糖波动;血管内皮细胞;超氧化物歧化酶;丙二醛;一氧化氮
糖尿病是一种常见的内分泌代谢障碍性疾病,高血糖是其标志,也是引起糖尿病慢性并发症的主要原因。糖尿病高血糖存在持续性高血糖和波动性高血糖两种表现。糖尿病慢性并发症的发生、发展与整体血糖水平相关,而血糖的波动性与其关系更加密切[1,2]。在糖尿病控制与并发症试验(diabetes control and complications trial,DCCT)、英国前瞻性糖尿病研究(united kingdom prospective diabetes study,UKPDS)等大型临床研究中发现,糖化血红蛋白(glycosylated hemoglobin,HbAlc)与糖尿病慢性并发症的风险呈正相关[3],但是在临床中存在很多这样的情况:糖化血红蛋白水平不高,糖尿病并发症出现较早,而相同的糖化血红蛋白水平,却出现不同的并发症。经过仔细分析,考虑可能与血糖波动程度关系密切[4]。有研究表明,血糖波动增加氧化应激,引起血管内皮损伤,促进糖尿病慢性并发症的发生发展[5]。因此,2009年Monnier等[6]提出“血糖四分体”的概念,即HbAlc、空腹血糖、餐后血糖和血糖波动。本研究借助波动性高血糖大鼠模型,检测不同高血糖状态(稳定性高血糖和波动性血高糖)下血清超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)的表达,以此来判断对血管内皮形态和功能损伤的影响。
1 材料与方法
1.1 实验动物分组和模型建立
6~8周龄SD大鼠60只(南京君科生物工程有限公司提供),体质量140~160 g,随机分为2组,高糖高脂饲料喂养模型组(模型组,n=40)和正常饲料喂养组(正常组,n=20),模型组喂养6周后,采用腹腔内注射链脲佐菌素(30 mg/kg)建立糖尿病大鼠模型,1周后测大鼠空腹血糖,结果均>15 mmol/L,提示糖尿病大鼠模型建立成功,然后将其随机分为2组:持续高血糖组(MS组,n=20)与波动高血糖组(MF组,n=20)。波动高血糖组建立方法为每日8时、15时腹腔注射葡萄糖,剂量为0.3 g/kg,08:30及15:30皮下注射普通胰岛素,剂量为1 U(剂量通过预实验确定),正常组和持续高血糖组同时腹腔注射等体积生理盐水[7]。
1.2 实验试剂与仪器
普通胰岛素(江苏万邦化医药);链脲佐菌素(STZ,美国Sigma公司);血糖试纸(451289,德国罗氏);高脂饲料:猪油15%、蛋黄10%、蔗糖15%、基础饲料60%(北京美森生物医药科技有限公司提供)。SOD、MDA、NO应用南京建成生物有限公司生产的试剂盒,血浆SOD活性用黄嘌呤氧化酶法测定,血清MDA含量测定采用硫代巴比妥酸比色法,NO测定采用化学发光法。全自动生化分析仪(Hitachi,7020)OneTouch DMS Pro分析软件(美国强生公司)
1.3 观察指标
1.3.1 体质量:实验开始前、糖尿病大鼠造模前及MF组造模12周后测定大鼠体质量。
1.3.2 生化指标:(1)注射链脲佐菌素,1周后,禁食12 h,检测各组大鼠空腹血糖。(2)血糖波动组造模第6周,连续7 d测定7个时间血糖(08:00、08:30、10:00、15:00、15:30、17:00、22:00)。
1.3.3 SOD、MDA、NO检测:血糖波动组造模12周后,各组大鼠腹主动脉取血,测定血TG、LDL-C及HDL-C,黄嘌呤氧化酶法测定血浆SOD活性,硫代巴比妥酸比色法测定血清MDA,化学发光法测定NO,具体操作严格按试剂盒说明书进行。
1.4 统计学处理
采用SPSS 13.0统计软件进行数据处理,正态分布资料用表示,采用单因素方差分析比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 实验动物的一般状况
正常组的大鼠精神状态良好、体质量增加、毛色光亮、摄食摄水量正常、动作自如;MF和MS组大鼠均出现明显的多饮多食多尿,毛竖无光泽,蜷卧少动。
实验前及糖尿病大鼠造模前,各组大鼠体质量比较无统计学差异(P>0.05);血糖波动造模第12周时,MS、MF 2组大鼠体质量较正常组均下降(P<0.01),MS组及MF组之间比较差异无统计学意义(P>0.05)。见表1。
表1 大鼠体质量的变化Tab.1 Changes of the rats’weight
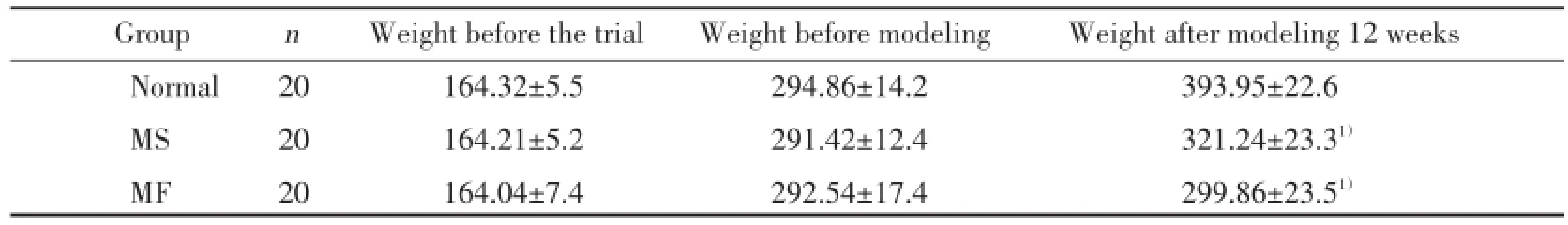
表1 大鼠体质量的变化Tab.1 Changes of the rats’weight
1)P<0.01 vs normal group.
2.2 各组大鼠第6周血糖变化
如表2所示,正常组大鼠血糖基本正常,模型组大鼠血糖持续在高血糖水平,MF组大鼠血糖分别在08:30、15:30形成波峰,10:00、17:00形成波谷,波动幅度显著高于MS组(P<0.01),提示血糖波动组造模成功。
表2 大鼠血糖波动造模第6周血糖比较Tab.2 Comparison of blood glucose after blood-glucose fluctuation rat model established 6 weeks
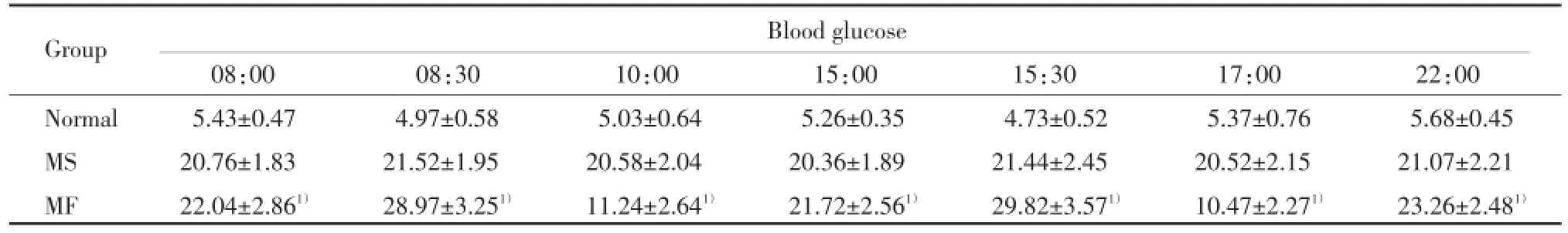
表2 大鼠血糖波动造模第6周血糖比较Tab.2 Comparison of blood glucose after blood-glucose fluctuation rat model established 6 weeks
1)P<0.01 vs group MS.
2.3 各组大鼠12周血脂变化
MS组、MF组TG、LDL较正常组明显升高(P<0.01),HDL-C则显著下降(P<0.01),MS、MF组间差异无统计学意义(P>0.05),提示2种不同糖尿病模型之间血脂存在可比性,见表3。
2.4 血糖波动大鼠造模第12周血清SOD、MDA、NO指标变化
结果显示,与正常组比较,各模型组SOD、MDA、NO均呈现显著性变化(P均<0.05),MF组SOD、MDA、NO变化水平高于MS组(P<0.05)。见表4。
表3 大鼠血糖波动组造模第12周TG、LDL-C、HDL-C水平比较Tab.3 Comparison of TG,LDL-C and HDL-C after blood-glucose fluctuation rat model established 12 weeks
1)P<0.01 vs normal group.
?
表4 大鼠血糖波动组造模第12周SOD、MDA、NO水平比较Tab.4 Comparison of SOD,MDA and NO after blood-glucose fluctuation rat model group established 12 weeks

表4 大鼠血糖波动组造模第12周SOD、MDA、NO水平比较Tab.4 Comparison of SOD,MDA and NO after blood-glucose fluctuation rat model group established 12 weeks
1)P<0.05,2)P<0.01 vs normal group;3)P<0.05 vs group MS.
3 讨论
在糖尿病心血管并发症发生发展中,内皮功能异常是其重要病理生理基础[8]。血糖波动时机体处于氧化应激状态,产生的活性产物(自由基、丙二醛等)直接或间接引起细胞坏死、细胞功能缺损[9]。SOD具有催化超氧阴离子自由基发生歧化反应的性质,可清除超氧阴离子自由基,防止细胞损伤,故可反映机体的抗氧化能力[10]。MDA是过氧化脂质降解的产物,可间接反映氧自由基对机体细胞的损伤程度。NO是一种内皮源性小分子物质,在体内具有血管活性和细胞毒性的双重作用,通过激活鸟苷酸环化酶,使细胞内cGMP水平升高,引起血管平滑肌松弛、血管扩张,在生理状态下与氧自由基处于平衡状态而无毒性作用,但由于各种原因平衡打破时,细胞内合成过多的NO与氧自由基生成羟自由基和过氧硝基阴离子,更具细胞毒性,后者可引起细胞损伤[11]。流行病学调查研究证实,血糖波动不仅是糖尿病患者高死亡率的独立预测因子,而且是血管并发症的独立危险因素[12]。
本实验中,MS组及MF组血MDA水平显著高于正常组(P<0.05),SOD活性及NO水平明显低于正常组(P<0.05),提示2型糖尿病大鼠体内存在氧化应激,抗氧化能力减弱,NO水平下降,这可能与血管内皮受损,NO合成和释放减少有关;血糖波动组MDA水平升高、SOD活性及NO水平下降较持续高血糖组更明显(P<0.05),提示血糖波动可加剧糖尿病机体的氧化应激反应,与持续性高血糖相比,波动性高血糖可能引起更严重的血管内皮损害,与其他因素共同参与糖尿病慢性并发症的发生。因而在临床工作中,积极降压、降脂、控制糖化血红蛋白、空腹及餐后血糖达标的同时,应重视血糖平稳,这对延缓糖尿病慢性并发症有重要意义。
目前,有关血糖波动与糖尿病慢性并发症的研究仍停留在实验阶段,具体机制尚不明确,有待进一步探索,此外,减少血糖波动对糖尿病患者心脑血管终点事件的影响需要进一步实验证实。
[1]王允彦,薛继强.血糖波动与糖尿病并发症关系的研究进展[J].临床合理用药杂志,2012,5(30):148-149.
[2]龙艳,苏珂,彭鹰,等.血糖波动与氧化应激对2型糖尿病微血管病变的影响[J].中华老年心脑血管病杂志,2014,16(2):147-150.
[3]Holman RR,Paul SK,Bethel MA,et al.10-year follow-up of intensive,glucose control in type 2 diabetes[J].New Engl J Med,2008,359(15):1577-1589.
[4]代喆,季振中,王桦,等.2型糖尿病患者血糖波动与血管并发症的关系及其相关因素分析[J].中华糖尿病杂志,2012,4(10):618-624.
[5]张凤林,李勤,李世云.波动性高血糖对机体氧化应激的影响[J].四川医学,2013,34(6):914-915.
[6]Monnier L,Colette C,Owens DR.Integrating glycaemic variabilityin the glycaemic disorders of type 2 diabetes:a move towards a unified glucose tetrad concept[J].Diabetes Metab Res Rev,2009,25(5):393-402.
[7]朱延涛,金蓉家,钟杰敏,等.Ⅱ型糖尿病大鼠血糖波动模型的初步建立及其特点[J].实验动物与比较医学,2012,32(6):512-515.
[8]王月琴,戴敏.高糖诱导内皮细胞损伤致动脉粥样硬化的分子机制研究进展[J].安徽医药,2012,16(5):564-567.
[9]戴青原,综述,郭涛,等.氧化应激与糖尿病及动脉粥样硬化研究进展[J].心血管病学进展,2013,34(5):664-668.
[10]张孝侠,李永华.氧化损伤与糖尿病发病的相关性[J].中国热带医学,2013,13(5):611-613.
[11]Guerci B,Kearney-Schwartz A,Bohmep,et al.Endothelial dysfunction and type 2 diabetes.Part1:physiology and methods for exploring the endothelial function[J].Diabetes Metab,2011,27(4pt1):425-434.
[12]Hirsch IB,Brounlee M.Should minimal blood-variability become the gold standard of glycemic control?[J].J Diabetes Complications,2005,19(3):178-181.
(编辑 武玉欣)
Expression of Serum SOD,MDAand NOLevelsin High Blood Glucose Fluctuation in Diabetic Rats
WANGLu1,WANGWei1,YANGMi-mi2,BAOGuo-rong1,SUO Lin-na1,ZHANGWei1
(1.Department of Endocrinology,The Fourth Affiliated Hospital,China Medical University,Shenyang 110032,China;2.2010 Grade,Preventive Medicine School,Public Health College,ShanxiMedicalUniersity,Taiyuan 030001,China)
ObjectiveTo observe the effects of blood-glucose fluctuation on serum superoxide dismutase(SOD),malondialdehyde(MDA),and nitric oxide(NO)levels in rat models of diabetes mellitus.MethodsSixty male Sprague-Dawley rats were randomly divided into normal group(n=20)and model group(n=40),The diabetic rat model was established by injection of a small dose of streptozotoein(STZ)after feeding the modelgroup SD rats with high-sugarhigh-fatdietfor6 weeks.The persistenthigh glucose diabetic ratmodelgroup(MS)wasestablished by intraperitoneal injection of glucose,and the blood-glucose fluctuation rat model group(MF)was developed by alternative intraperitoneal injection of insulin and glucose.Serum glucose(Glu)was measured at6 weeks after MF modelestablishment,triglyceride(TG),low density lipopretein(LDL-C),high density lipoprotein(HDL-C),SOD,MDA,and NO were measured at 12 weeks.Results(1)12 weeks after intravenous injection of STZ,the levels of TG and LDL-C in the MS and MF groups were significantly increased(allP<0.01),and HDL-C was significantly decreased compared with those of the N group(P<0.01).(2)Compared with the normal group,the expression levels of SOD,MDA,NO in the MS and MF groups were all changed significantly(allP<0.05),while the MF group were significantly higher than those of the MS groups(allP<0.01).Conclusion(1)Vascular endothelium cell(VEC)injury and oxidative stress exist in type 2 diabetic rat,(2)Hyperglycemia can lead to VEC injury.(3)Glucose fluctuation induces more obvious changes than hyperglycemia in express of SOD,MDA,and NO,which may consequently induces more serious endothelialdysfunction than hyperglycemia.
blood-glucose fluctuation;vascular endothelium cell;serum superoxide dismutase;malondialdehyde;nitric oxide
R587.1
A
0258-4646(2014)09-0806-04
辽宁省教育厅高校科研计划(2013021026)
王露(1968-),女,副主任医师,硕士. E-mail:wanglushiliang@sina.com
2014-06-05
网络出版时间:
