经直肠双平面腔内超声对直肠间质瘤的诊断价值
2014-03-21齐旭唐少珊金虹刘站潘福治
齐旭,唐少珊,金虹,刘站,潘福治
(中国医科大学附属盛京医院超声科,沈阳110004)
经直肠双平面腔内超声对直肠间质瘤的诊断价值
齐旭,唐少珊,金虹,刘站,潘福治
(中国医科大学附属盛京医院超声科,沈阳110004)
Application ofDouble-plane TransrectalUltrasound in Diagnosisof RectalGastrointestinalStromalTumor
采用经直肠双平面超声探头对14例经病理证实的直肠间质瘤患者术前行经直肠腔内超声检查,总结直肠间质瘤的超声表现特点并将超声判断的病变侵犯层次与病理结果相对照。经直肠双平面腔内超声检查在直肠间质瘤术前诊断及病变侵犯层次的判断中有重要价值,对直肠间质瘤手术方式的选择具有指导意义。
直肠间质瘤;经直肠超声;双平面超声探头
直肠间质瘤发病隐匿,早期多无临床表现及体征,呈膨胀性生长,可在发病部位形成巨大肿块。经直肠腔内超声检查已被大量用于直肠及肛周疾病的诊断,在直肠癌的术前分期中被认为是目前评估肿瘤浸润深度较准确的影像学方法之一[1,2]。但是应用经直肠双平面腔内超声对直肠间质瘤术前检查和分析的报道较少。本研究应用经直肠双平面腔内超声探头对14例直肠间质瘤患者术前行腔内超声检查,对照术后病理结果,拟探讨直肠间质瘤的超声声像图特点及经直肠双平面腔内超声在其术前诊断中的价值。
1 材料与方法
1.1 研究对象
选择2012年5月至2013年8月在我院怀疑为直肠肿物并行超声检查的64例患者,其中14例术后诊断为直肠间质瘤。14例间质瘤患者中男8例,女6例,年龄44~70岁,平均(55.1±7.1)岁。14例患者全部为首次发现,术前全部采用经直肠双平面腔内超声检查,并进行手术治疗和病理证实。出现大便习惯改变、便血等症状者11例,无临床症状而由体检发现2例,出现排尿困难者1例。
1.2 仪器与方法
采用百盛公司Mylab twice彩色多谱勒超声诊断仪,使用双平面腔内超声探头,凸阵频率3~9 MHz,线阵频率4~13 MHz。全部患者均于当日检查前行肠道准备,检查时取左侧卧位,下肢髋及膝均曲屈,双手抱膝,完全暴露肛门,向直肠内注入无菌耦合剂约150~200 mL,将探头外涂少量耦合剂,然后套上避孕套,其外再涂上表皮麻醉药,嘱患者深呼吸,将探头缓慢插入肛门。分别用凸阵和线阵行常规二维超声及彩色多普勒血流显像(color Doppler flow imaging,CDFI)检查。观察并记录肿物的位置、大小、内部回声、形态、边界、肿物侵犯的层次、与周围组织脏器的关系、血流信号及频谱等信息。观察直肠周围有无肿大淋巴结,记录每例肠周淋巴结数目及大小。
1.3 图像分析及判定标准
在患者肠道准备充分、肠腔内耦合剂充盈良好的情况下可以清晰显示正常肠壁的层次。正常直肠肠壁二维超声图像由内向外表现为强低回声交替的连续的5层结构(图1)。第1层强回声为黏膜上皮和固有层,第2层低回声为黏膜肌层,第3层强回声为黏膜下层,第4层低回声为肌层,最外层强回声为浆膜层或筋膜层。本研究对经直肠双平面超声检查判断直肠间质瘤病变侵犯层次的结果与病理结果进行对照分析,判断超声检查的准确率。
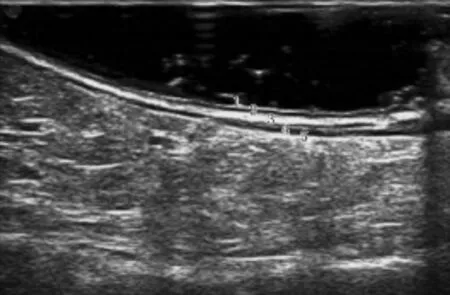
图1 正常肠壁二维超声声像图
2 结果
14例患者全部行手术治疗并经病理证实均为直肠间质瘤。14例中肿瘤最大直径在1.0~7.6 cm,平均最大直径约(2.8±1.9)cm,其中最大径≥5 cm的4例,最大径<5 cm的10例,其中最小者直径仅为1 cm(图2)。直肠间质瘤超声表现为直肠中下段肠壁肌层内低回声肿物,边界较清晰,形态规整,多呈圆形或椭圆形,偶见分叶状,呈膨胀性、外生性生长,14例间质瘤中有2例肿物内可见无回声区,提示液化坏死(图3),这2例肿瘤最大径都>5 cm。CDFI示肿瘤内部可探及丰富的血流信号,较大肿瘤内的血流信号呈树枝状分布(图4)。频谱呈高阻力动脉血流频谱(图5),血流速度平均值为(14.7±3.4)cm/s,阻力指数平均值为0.68±0.10。

图2 较小的直肠间质瘤
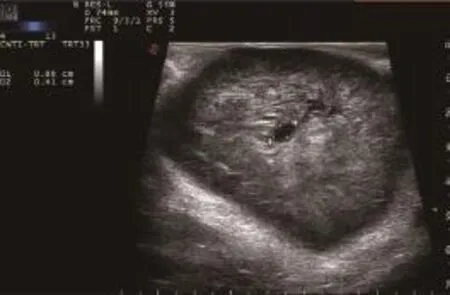
图3 直肠间质瘤液化坏死

图4 直肠间质瘤CDFI情况
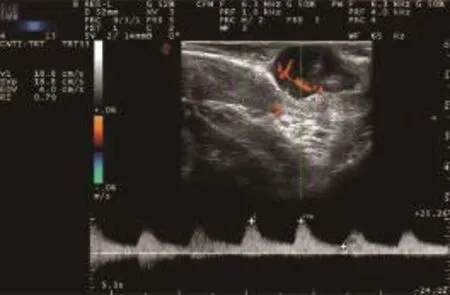
图5 直肠间质瘤频谱情况
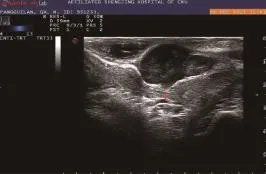
图6 直肠间质瘤局部侵犯
14例直肠间质瘤超声检查侵犯肠壁层次结果:13例超声显示病变位于肌层内,无内外侵犯;1例超声显示肿物向外侵犯突破肌层达肠周脂肪(图6)。超声显示无侵犯的13例中,病理结果显示12例病变位于肌层,1例侵犯黏膜下层。超声判断侵犯至肠周脂肪的1例与病理结果相符。超声判断直肠间质瘤病变侵犯层次与病理结果对照的准确性达92.9%(13/14)。直肠周围超声检查未见淋巴结转移。术后病理分型采用WHO颁布的改良NIH分级标准,14例间质瘤中,极低度危险性6例,低度危险性3例,中度危险性2例,高度危险性3例。免疫组化结果:CD34阳性12例,CD117阳性14例。直肠周围均未探及转移淋巴结,也未发现远处转移。
3 讨论
胃肠道间质瘤在消化道间叶组织源性的肿瘤中最为常见,来源于消化道固有肌层。由Mazur等[3]在1983年第一次提出,具有特异的分子遗传学特征及免疫组织学表型。胃肠道间质瘤可以在消化道的任何部位发生,占所有消化道肿瘤的1%~2%,其中最常见部位为胃,其余依次分别为小肠、结直肠和食管,发生在直肠的间质瘤的比例占所有胃肠道间质瘤的比例小于5%[4]。
直肠间质瘤中位发病年龄约为63~69岁,性别分布无明显差异[5]。本组资料与文献报道基本一致。直肠间质瘤患者早期当瘤体较小时可无任何症状和体征,一般于体检时无意中发现。随肿瘤增长变大可向直肠腔内或腔外突出,引起大便习惯(便秘、便频)、性状(变细)改变,浸润黏膜时出现便血,向前压迫尿道或膀胱时出现尿频、排尿困难等症状,肿瘤长到一定程度时可出现肠梗阻的表现,侵犯周围组织或神经时引起疼痛。本组中2例无症状,肿物均较小,于体检无意中发现,11例出现不同程度的便秘、大便变细、便血等症状。
直肠间质瘤超声表现为直肠肌层内向肠腔外或者向肠腔内隆起的圆形或者椭圆形肿物,形态多较规则,也可呈分叶状,境界相对清晰,内部多呈低回声,肿物较大时可伴有坏死液化,可见无回声区存在。直肠间质瘤肿物不直接沿肠壁浸润蔓延生长,邻近肠壁无增厚,肿瘤呈膨胀性生长,以外生为主。肿物向内浸润肠壁黏膜下层和黏膜层时,会出现相应层次的回声中断,本组中有1例浸润至黏膜下层,但是超声检查时未发现。回顾分析其原因,可能是由于肠壁炎性水肿,肠壁的层次显示模糊所致。间质瘤很少发生淋巴结转移,概率小于10%[6]。本组病例超声均未探及直肠周淋巴结,并经手术病理证实。
本研究应用的双平面腔内超声探头与端扫式腔内探头相比,在直肠肿物诊断中的应用价值有明显优势。端扫式探头由于扫查角度受限,不易完整地显示环肠壁结构的改变,需要根据肠道的生理弯曲来改变探头的方向,使检测方向较垂直于病变部位时才能得到图像[7],操作起来很不方便,对操作医生的技术水平要求较高,而得到的图像往往不够清晰和完整。双平面腔内超声探头克服了端射式探头观察角度受限的缺点,其发射出的声束与肠壁垂直,操作时只需旋转探头和控制探头的深浅就能显示直肠及肿物的全部信息,操作起来更简单方便。不但可以得到清晰完整的图像,而且可以减轻由于变换探头角度给患者带来的痛苦。由于直肠间质瘤多位于中下段直肠[8],距肛缘约2~5 cm,因此避开了直肠双平面腔内探头对远段直肠扫查受限的缺点。同时双平面探头最高频率可达13 MHz,能够更加清晰的显示肠壁的5层结构及与肿物的关系,对直肠间质瘤浸润深度的判断更加可靠,且对小病灶的检出率明显高于普通凸阵探头,最大程度的减少了漏诊的发生。本研究中,发现的最小病灶为1.0 cm×0.7 cm(图2),对直肠间质瘤浸润层次判断的准确率为92.9%(13/14)。
直肠间质瘤的超声表现与几种常见直肠肿物相比有明显的区别:(1)直肠癌、直肠息肉和直肠腺瘤可发生在直肠的任何部位,起源于黏膜层;直肠间质瘤多发生在直肠中下段,起源于肌层。(2)直肠腺瘤和直肠息肉是增生肥大的直肠黏膜组织隆起于黏膜表面而形成,超声表现为起源于直肠黏膜层的中等回声肿物,形态规则,大小不一,呈乳头样或核桃状,肿物与黏膜常以蒂相连,向肠腔突起,边界清楚,表面光滑,一般局限于黏膜层,恶变时向深层浸润。(3)直肠癌同样源于黏膜层,超声表现为直肠肠壁呈肿物样弥漫性增厚,范围大小不等,可环绕肠壁一周,呈低回声,边界模糊,形态不规则,可浸润肠壁各层及肠周组织脏器,超声可探及转移的肠周淋巴结。
本组资料显示,直肠间质瘤的超声表现具有特异性,经直肠双平面超声检查判断直肠间质瘤病变浸润肠壁层次与术后病理结果相对照的准确性高于以往常规经直肠探头检查结果[7]。目前公认手术切除是直肠间质瘤治疗的最佳方法[9],不同的手术方式对直肠间质瘤患者的治疗和预后生存质量都有着深远的影响。而手术方式的选择主要取决于肿瘤的位置、大小、浸润的深度、与周围脏器的关系及危险程度等信息,因此准确的术前诊断对直肠间质瘤治疗方案的选择至关重要[10]。
经直肠双平面腔内超声检查在直肠间质瘤术前诊断及病变浸润层次的判断中有重要价值,能够为临床医生提供准确的信息,对手术方式的选择具有指导意义。
[1]Krajewski KM,Kane RA.Ultrasound staging of rectal cancer[J]. Semin Ultrasound CT MR,2008,29(6):427-432.
[2]蔡多特.直肠内超声检查诊断直肠癌准确度的Meta分析[J].医学研究杂志,2012,41(6):163-166.
[3]Mazur MT,Clark HB.Gastric stromal tumors:reappraisal of histogenesis[J].Am J Surg Pathol,1983,7(6):507-519.
[4]Chandrasekhara V,Ginsberg GG.Endoscopic management of gastrointestinal stromal tumors[J].Curr Gastroenterol Rep,2011,13(6):532-539.
[5]Grover S,Ashley SW,Raut CP.Small intestine gastrointestinal stromal tumors[J].Curr Opin Gastroenterol,2012,28(2):113-123.
[6]Rossi R,Mocellin S,Mencarell R,et al.Gastrointestinal stromal tumors:from a surgical to a molecular approach[J].Int J Cancer,2003,107(2):171-176.
[7]林晓东,林礼务,薛恩生,等.端扫式直肠超声探头对直肠间质瘤的诊断价值[J].中华医学超声杂志,2010,7(12):2110-2116.
[8]Hassan I,You YN.Clinical,pathologic,and immunohistochemical characteristics of gastrointestinal stromal tumors of the colon and rectum:implications for surgical management and adjuvant therapies[J].Dis Colon Rectum,2006,49(5):609-615.
[9]刘骞.直肠间质瘤的外科治疗[J].实用肿瘤学杂志,2009,24(2):102-103.
[10]Chen D,Cui JH,Yang XJ,et al.Gastrointestinal stromal tumors of the rectum:clinical,pathologic,immunohistochemical charactristics and prognostic annlysis[J].Scand J Gastroenterol,2007,42(10):1221-1229.
(编辑 陈姜)
R445.1
B
0258-4646(2014)05-0458-03
齐旭(1984-),男,助教,硕士研究生.
唐少珊,E-mail:tangss@sj-hospital.org
2014-03-05
网络出版时间:
