肌糖蛋白TN-C促进人骨髓基质干细胞向成骨细胞的分化
2014-03-16曹玉净吕秋霞
曹玉净,吕秋霞
(河南省中医院创伤骨科,河南郑州450002
骨折愈合是一个极其复杂的修复过程,受诸多因素的影响,包括全身性因素和局部性因素。怎样早期促进骨折愈合,一直是骨伤科领域的重点课题之一。在骨折愈合的过程中,骨折部位的血液供应、感染的影响、软组织损伤程度、骨折端软组织嵌入等都会影响愈合过程[1]。
肌糖蛋白C(tenascin-c,TN-C),又被称为神经胶质/间叶细胞细胞外基质蛋白(GMEM)或肌腱抗原,是由分子质量在190~300 ku 的亚基通过二硫键连接的寡聚物。与其他的细胞外基质蛋白如纤连蛋白(fibronectin)和层粘连蛋白(laminin)相比,TN-C 的表达通常是瞬时的,并且高度控制在胚胎发育阶段。但在正常或病理的组织重塑时,成体器官的特定组织重新表达TN-C。在组织损伤中,TN-C介导炎性反应和纤维化进程,促进组织的再生修复[2]。近10年的研究发现:TN-C 在心肌和动脉损伤,肿瘤血管再生和肿瘤转移,以及调节干细胞的行为中有至关重要的作用[3,4]。但对于TN-C 是否能诱导骨再生尚缺乏相关的研究。本研究旨在探讨TN-C 对骨再生的影响及潜在的机制,为TN-C 在促进骨折愈合中的应用提供可参考的价值。
1 材料与方法
1.1 材料
DMEM 培养基(Gibco 公司);胎牛血清(FBS)(杭州四季青生物科技公司);0.25%胰蛋白酶、青霉素和链霉素(Hyclone 公司);碱性磷酸酶试剂盒(碧云天公司);BCA 蛋白定量试剂盒(Pierce 公司);骨钙素放免试剂盒(Immutopics 公司);24 孔细胞培养板和96 孔细胞培养板板(上海生工生物科技有限公司);细胞茜素红(上海杰美基因医药科技公司);cDNA 合成试剂盒、DMSO 和MTT(大连宝生物);鼠抗人TN-C 一抗及羊抗鼠二抗(Sigma 公司);RNAprep 总RNA 提取试剂盒和ECL 发光试剂盒(北京天根生物科技公司);重组人PDE1B(北京义翘神州生物技术有限公司)。
1.2 方法
1.2.1 人骨髓基质干细胞的分离培养与处理:所有材料的获取按照标准流程在本实验室高级实验员的监督下完成。本研究得到河南省中医院伦理委员会的同意。骨髓由2013年1月至6月于河南省中医院住院患者志愿捐献,所有患者均签订知情同意书。采用全骨髓培养法,多次消化以纯化人骨髓基质干细胞(hBMSCs)。分离纯化的hBMSCs 培养在含有10% FBS,100 μg/mL 青霉素和100 μg/mL 链霉素的DMEM 培养基中,于37 ℃恒温CO2培养箱中培养[5]。
1.2.2 重组TN-C 的制备:已有研究表明,骨肉瘤细胞MG-63 中TN-C 高表达[6]。因此本研究使用RNAiso 从人骨肉瘤细胞MG-63 中提取总RNA 并进行反转录获取TN-C cDNA。以2 μL TN-C cDNA 作为模板,使用特异性引物进行PCR 扩增TN-C。获得的TN-C DNA 纯化后插入pCDNA3.1(+)载体,并转染目的细胞人胚肾HEK293A 进行TN-C 的体外表达。重组表达的TN-C 经镍柱亲和层析纯化并进行Western blot 检测其表达。
1.2.3 Western blot 检测蛋白表达:上述制备纯化的rTN-C 经BCA 蛋白定量试剂盒测蛋白的浓度。取蛋白样品30 μg,进行SDS-PAGE 电泳。电泳结束后,通过电转移将凝胶上的蛋白质转移到硝酸纤维素膜上。然后,将膜置于10 mL 现配的封闭液中2%脱脂奶粉,TBS(Tris-buffered saline,150 mmol/L NaCl,10 mmol/L Tris-HCl,pH 7.5)封闭1 h;依次加入鼠抗人TN-C 一抗(1∶1 000 稀释),4 ℃过夜孵育;TBST(TBS 含0.02% Tween)洗3 次,加入HRP偶联的羊抗鼠二抗(1∶10 000 稀释)室温孵育2 h;TBST 洗膜3 次,TBS 洗膜1 次。使用ECL 发光试剂盒检测TN-C 的表达。
1.2.4 MTT 法检测细胞增殖能力:取生长良好的hBMSCs 细胞制备细胞悬浮液,计数后以2 ×104个/孔接种于96 孔板,每孔200 μL。待细胞贴壁后,更换含有不同浓度重组TN-C 蛋白的条件培养基并继续培养。12 h 后,向每孔加入5 g/L 的MTT 储存液20 μL,继续培养4 h;弃上清后,加入150 μL 二甲基亚砜(DMSO),置于低温摇床低速振荡10 min,使结晶物充分溶解,并于酶标仪上测定490 nm 处吸光度值(A)。
1.2.5 细胞茜素红染色:原代培养8~11 d 后细胞汇合成单层,按1 ∶ 3 的比例传代,细胞计数后以3 ×105个/孔接种到24 孔培养板中。待细胞汇合度基本达到50%,分别对细胞进行如下处理:实验组采用含有不同浓度重组TN-C(rTN-C)蛋白的条件培养液(0、1、10、50 和100 nmol/L)处理不同的时间,对照组采用不含TN-C 蛋白的完全培养液。不同处理的细胞培养一定的时间后,用细胞茜素红对细胞进行染色,检测hBMSCs 向成骨细胞的分化。
1.2.6 RT-qPCR 检测ALP 和OCN mRNA 的表达:收集实验组或对照组细胞,按照RNAprep 培养细胞总RNA 提取试剂盒说明书提取细胞总RNA,按照PrimeScript RT reagent Kit(Perfect Real Time)试剂盒说明书进行反转录获得cDNA。以获得的cDNA 为模板进行实时定量PCR,检测ALP 和OCN 的mRNA水平变化,并以β-actin 作为内参。本实验所使用的特异性引物序列如下:ALP:正义链:5'-GCACCATG ATTTCACCAT-3';反义链:5'-CTGGGCCCTCAGAAC AGGAC-3';OCN:正义链:5'-CGAGACACCATGAGA GCC-3';反义链:5'-GAGCGACACCCTAGACCG-3';β-actin:正义链:5'-CAACTTGATGTATGAAGGCTTT GGT-3';反义链:5'-ACTTTTATTGGTCTCAAGTCAGT GTACAG-3'。所有引物合成均由上海生工生物工程技术服务有限公司完成。
1.2.7 ALP 比活性的测定:传代的hBMSCs 细胞用含有不同浓度TN-C 重组蛋白的条件培养基以5 ×104/cm2接种于6 孔板中,在TN-C 重组蛋白作用的第3、6 和12 d 收集并裂解细胞,按照ALP 试剂盒说明书操作,并用BCA 蛋白定量试剂盒定量总蛋白。计算细胞内ALP 比活性,单位为U/L。
1.2.8 OCN 含量的检测:传代的hBMSCs 细胞用含有不同浓度rTN-C 的条件培养基以5 ×104/cm2接种于6 孔板中,在rTN-C 作用后按预计时间收集各组细胞,按骨钙素放免试剂盒说明书检测OCN含量。
1.3 统计学分析
采用SPSS 12.0 统计软件对数据进行t 检验,并用Graphpad prism 5.0 作图。结果用均数±标准差(±s)表示。
2 结果
2.1 重组TN-C 蛋白的检测
鼠抗人TN-C 抗体能与重组TN-C 蛋白免疫,显示单一的条带,而对照组蛋白(本实验采用含有GST标签的重组人PDE1B)蛋白未能显示条带(图1)。
2.2 rTN-C 促进hBMSCs 向成骨细胞分化
不同浓度的rTN-C(0、1、10、50 和100 nmol/L)处理hBMSCs 24 h 后,细胞数量无明显上升(图2A)。在rTN-C 处理细胞的第10 天,rTN-C 剂量依赖性促进成骨细胞的矿化(图2B)。

图1 Western blot 检测制备的TN-C 重组蛋白Fig 1 Detection of recombinant TN-C by Western blot

图2 rTN-C 对hBMSCs 增殖及矿化的影响Fig 2 The effect of rTN-C on the proliferation and mineralization of hBMSCs
2.3 rTN-C 对ALP 水平及比活性的影响
不同浓度rTN-C 处理hBMSCs 10 d 后ALP mRNA水平随rTN-C 浓度显著上升(P<0.05)。但在rTN-C >50 nmol/L 后,ALP mRNA 水平与50 nmol/L组相比没有显著性变化(图3 A)。
50 nmol/L rTN-C 处理hBMSCs 不同时间(3、6、9 和12 d)后,细胞内ALP 的比活性明显高于对照组(表1),并随诱导时间的延长而继续显著增高(P<0.05)。
2.4 rTN-C 对OCN 的影响
与ALP 类似,与对照组相比不同浓度rTN-C 处理hBMSCs 10 d 后,OCN mRNA 水平随rTN-C 浓度
显著上升。但rTN-C >50 nmol/L 时,OCN mRNA 水平与50 nmol/L 组相比没有显著性变化(图3B)。50 nmol/L rTN-C 处理hBMSCs 后,OCN 含量随着处理时间的延长而增加,从处理后第12 d 起实验组OCN 含量显著高于对照组(P<0.05)(表2)。
3 讨论
TN-C 是细胞外基质重要成分,最早发现其能调节细胞与纤连素之间的黏附,能被分类为抗黏附和黏附调节蛋白。TN-C 在发育阶段和成人中都能调节表达。组织学中观察到TN-C 在器官形成中短暂表达,而在已经完全发育成熟的器官中则丰度降低或者不表达。但是在一些病理情况下如感染,炎症和肿瘤情况下表达升高。研究表明TN-C 在调节细胞黏附、迁移和生长,影响肿瘤生长、侵袭、血管形成以及免疫抑制中有重要作用,另外TN-C 还参与炎症反应与组织重塑。骨折愈合过程是一个复杂而连续的过程,主要包括几个阶段:血肿炎症机化期、原始骨痂形成期、骨板形成塑形期。患者的年龄、健康状况、骨折的类型和数量、骨折部位的血液供应、软组织的损伤程度、软组织的嵌入和感染等都是影响骨折愈合的重要因素。
鉴于TN-C 在组织重塑、血管再生和炎症中的重要作用,本研究对TN-C 在骨折愈合中的潜在作用进行了初步的研究,发现rTN-C 能促进骨髓基质干细胞向成骨细胞分化,表现为增加骨基质干细胞碱性磷酸酶含量和骨钙素含量。

图3 实时定量PCR 检测rT-C 处理细胞对细胞内ALP 和OCN mRNA 水平变化的影响Fig 3 RT-PCR were employed to detect the mRNA level of ALP and OCN in cells treated with rT-C
表1 rTN-C 处理的实验组与对照组细胞ALP 活性测定Table 1 The activity of ALP in control group and experimental group treated with rTN-C(±s,U/L,n=3)

表1 rTN-C 处理的实验组与对照组细胞ALP 活性测定Table 1 The activity of ALP in control group and experimental group treated with rTN-C(±s,U/L,n=3)
*P<0.05 compared with control.
group culture time 3 days6 days9 days12 days control0.179 ±0.0250.210 ±0.0350.224 ±0.043 0.260 ±0.091 experimental0.362 ±0.033*0.561 ±0.022*0.570 ±0.018*0.705 ±0.113*
表2 不同时间OCN 含量的变化Table 2 The content of OCN in cells treated for different time (±s,ng/mL,n=3)
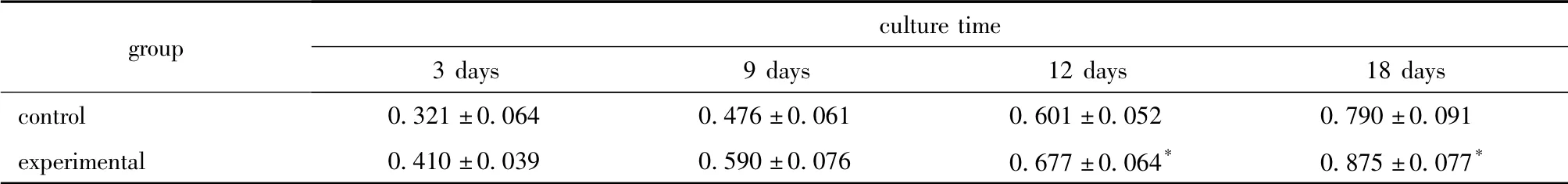
表2 不同时间OCN 含量的变化Table 2 The content of OCN in cells treated for different time (±s,ng/mL,n=3)
*P<0.05 compared with control.
group culture time 3 days9 days12 days18 days control0.321 ±0.0640.476 ±0.0610.601 ±0.052 0.790 ±0.091 experimental0.410 ±0.0390.590 ±0.0760.677 ±0.064*0.875 ±0.077*
ALP 是成骨细胞矿化过程中主要的功能活性酶,测定成骨细胞内ALP 活性变化可反应成骨细胞的分化成熟程度和细胞成骨矿化的能力,因此其常作为成骨细胞分化和功能成熟的早期标志分子。ALP 主要存在于胞质中,分解有机质中磷酸,增加局部无机磷酸浓度,促进矿化,在成骨细胞趋向成熟的转化限制点扮演重要角色。本研究中发现,重组TN-C 蛋白处理人骨髓基质干细胞一定时间后,ALP 活性较未做任何处理的对照组显著上升。
OCN 在维持正常骨钙化率和抑制软骨钙化中有重要作用,也常用作成骨细胞分化成熟的标志。本实验结果显示:在重组TN-C 处理细胞后的第12天开始,实验组OCN 含量与未做处理的对照组相比差异升高。重组TN-C 对ALP 和OCN 的活性的影响说明其对hBMCs 分化有促进作用。结合重组TN-C 在组织重塑及血管再生中的重要作用,TN-C可能在骨折愈合中有促进血管再生和促进成骨细胞成熟的双重作用。
[1]秦煜.骨折愈合,延迟愈合和骨不连[J].中华创伤骨科杂志,2004,6:1059-1062.
[2]Saika S,Sumioka T,Okada Y.Wakayama symposium:modulation of wound healing response in the corneal stroma by osteopontin and tenascin-C[J].Ocular Surface.2013,11:12-15.
[3]Orend G.,Chiquet-Ehrismann R.Tenascin-C induced signaling in cancer[J],Cancer letters,2006,244:143-163.
[4]Imanaka-Yoshida K.Tenascin-C in cardiovascular tissue remodeling:from development to inflammation and repair[J].Circ J,2012,76:2513-20.
[5]王忠,高毅,汪艳,等.人骨髓间充质干细胞分离培养与鉴定[J].中华神经医学杂志,2006,10:973-976.
[6]Zheng L,Zhang D,Zhang Y,et al.mTOR Signal Transduction Pathways Contribute to TN-C FNIII A1 Overexpression by Mechanical Stress in Osteosarcoma Cells[J].Mol Cell,2014,37:118-125.
