重组新城疫病毒rl-RVG抑制A549荷瘤鼠的瘤体生长
2014-03-16严玉兰贾丽娟步雪峰
严玉兰,贾丽娟,,刘 洋,张 金,张 杰,梁 冰,步雪峰
(江苏大学1.附属人民医院呼吸科,江苏镇江212002;2.临床医学院内科学,江苏镇江212013;3.附属人民医院普外科,江苏镇江212002)
肺癌被认为是目前对人类健康及生命威胁最大的恶性肿瘤,是当今世界各国常见的恶性肿瘤之一,据2012年美国癌症研究中心统计的数据显示,在新发的各种肿瘤中,肺癌的发病率在14%左右,位居第2 位[1]。长期以来,尽管积极采用各种治疗方法包括化疗、放疗及手术等,肺癌患者的5年生存率仍然不足15%[2]。
目前,各国学者致力于研究一种集基因治疗、免疫治疗于一体的新的生物治疗方法,即溶瘤治疗。新城疫病毒(newcastle disease virus,NDV)的抗肿瘤作用已经运用于临床实验研究,如急性单核细胞白血病、胶质瘤、人卵巢癌、骨肉瘤、乳腺癌及结肠癌等,均显示有明显的抑制肿瘤细胞生长作用[3-4]。其在肺癌研究国内外尚少。
1 材料与方法
1.1 材料
人肺腺癌细胞A549(本实验保存);SPF 级、4周龄、体质量18~22 g 裸鼠[扬州大学比较医学中心,实验动物质量合格证:SCXK(苏)2012-0004];表达狂犬病毒糖蛋白的重组新城疫病毒(recombinant avirulent NDV LaSota strain expressing the rabies virus glycoprotein,rl-RVG)与NDV 以及鸡抗NDV一抗(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室惠赠);DMEM 细胞培养基及胎牛血清(维森特公司);引物(上海捷瑞生物技术公司合成);反转录试剂盒(Fermentas);PCR 试剂盒(北京康维世纪有限公司);TUNEL 原位检测试剂盒(南京凯基生物科技发展有限公司);小鼠抗狂犬病毒G 蛋白一抗(Santa 公司),山羊抗鼠二抗、山羊抗兔二抗(北京康维世纪有限公司),兔抗鸡二抗(EARTHOX 公司),兔抗caspase-3,8,9,Bax 和Bcl-2 一抗(博士德公司)。
1.2 荷瘤鼠的建立
取裸鼠30 只,人肺腺癌细胞A549 复苏后移入含有10%胎牛血清的DMEM 培养基中,37 ℃、5%CO2培养,待细胞增殖至指数增长期,胰蛋白酶消化后用PBS 平衡盐液配制成5 ×108/mL 浓度的肺癌细胞悬液。给每只小鼠腋下皮下注射0.3 mL 细胞悬液,经10 d 左右,每只小鼠皮下均长出直径为5~20 mm 的瘤体。
1.3 分组实验
待荷瘤鼠皮下肿瘤长至5~20 mm 进行感染研究,将皮下成瘤的裸鼠平均分为3 组,每组10 只,随机分为rl-RVG 组、NDV 组及PBS 组。rl-RVG 组皮下瘤体注射rl-RVG 6 ×108pfu(空斑形成单位),NDV 组注射NDV 6 ×108pfu,PBS 组瘤体注射PBS液200 μL,每周2 次,持续3 周。自第一次注射日起0、7、14 和21 d 游标卡尺分别测量皮下肿瘤短径(a)及长经(b)(包括皮肤厚度在内),根据公式V=a2×b ×0.52 计算瘤体体积,根据末次测量肿瘤体积计算抑瘤率,抑瘤率=(对照组平均肿瘤体积-处理组平均肿瘤体积)/对照组平均肿瘤体积×100%。21 d 时处死全部小鼠,钝性剥离皮下肿瘤,部分组织4%多聚甲醛固定,部分组织-80 ℃保存待用。
1.4 RT-PCR 检测RVG 及NDV HN 基因表达
取小鼠新鲜皮下瘤体,Trizol 法提取瘤体组织总RNA,以Oligo dT 为反转录引物用Fermentas 反转录试剂盒反转录成cDNA 模板,引物分别为:RVG:上游5'-AGCCGATGCACTACAAG-3',下游5'-CTGGA GGAGGGATGATTGC-3',扩增长度:175 bp;NDV HN:上游5'-CTGGACGGTTTGGTGGGAA-3',下游5'-TAATGCGACTGCGGGATGTG-3',扩增长度:462 bp,进行PCR,PCR 的循环条件:94 ℃热启动预变性5 min,94 ℃30 s,53 ℃ 30 s(NDV HN 为55 ℃30 s),72 ℃30 s,共30 个循环,72 ℃延伸10 min,对扩增产物进行10 g/L 琼脂糖电泳分析。
1.5 凋亡检测
取小鼠的部分皮下瘤体组织,4%甲醛固定,石蜡包埋,5 μm 连续切片。用TUNEL 法检测细胞凋亡。按试剂盒的说明书操作,苏木素复染,倒置显微镜下观察分析。其中细胞核为棕色的为阳性细胞,在200 ×视野下选择阳性细胞分布均匀的区域,连续计数100 个细胞,并计数其中阳性细胞,重复3次。凋亡指数(AD = 凋亡细胞数/(凋亡细胞数+未凋亡细胞数)×100%)。
1.6 蛋白印迹法检测caspase 系列及Bax/Bcl-2
取小鼠新鲜皮下瘤体组织,提取组织蛋白后,行SDS-PAGE 电泳,转膜后分别使用兔抗caspase-3,8,9,Bax 和Bcl-2 为一抗,稀释比为1∶500,山羊抗兔IgGHRP 为二抗,稀释比为1∶10 000,行蛋白质印迹检测。
1.7 统计学分析
2 结果
2.1 3 周时各组荷瘤裸鼠肿瘤生长状况
rl-RVG 感染后21 d 时rl-RVG 组和NDV 组肿瘤体积明显小于对照组,且rl-RVG 组瘤体生长较NDV 组慢(P<0.05)。rl-RVG 的抑瘤率为54.5%,NDV 的抑瘤率为37.5%(图1,2)。
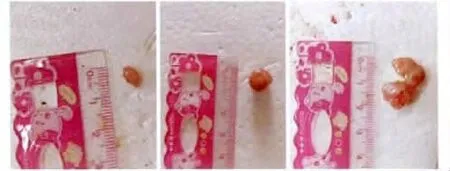
图1 3 周时各组荷瘤裸鼠肿瘤生长状况Fig 1 Status of tumor growth of experimenting group and control group at third week
2.2 RT-PCR 检测RVG 及NDV HN 基因表达
3 组均可在496 bp 出现GAPDH 基因条带(图3A);rl-RVG 组在175 bp 出现RVG 基因条带,NDV 组及PBS 组均无条带(图3B);rl-RVG 组及NDV 组在462 bp出现NDV HN 基因条带,PBS 组无条带(图3C)。
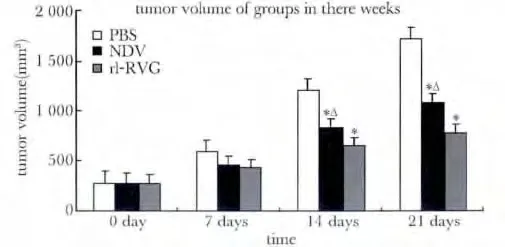
图2 3 周各组荷瘤裸鼠肿瘤瘤体积Fig 2 Tumor volume of experimenting group and control group in there weeks(±s,n=10)
2.3 肿瘤组织的细胞凋亡情况
rl-RVG 组及NDV 组凋亡细胞明显高于PBS组,且rl-RVG 较及NDV 组凋亡细胞较多(P<0.05)(图4,表1)。
表1 rl-RVG 感染A549 荷瘤鼠后肿瘤细胞的凋亡指数Table 1 The apoptosis index of tumor infected with rl-RVG(±s,n=10)
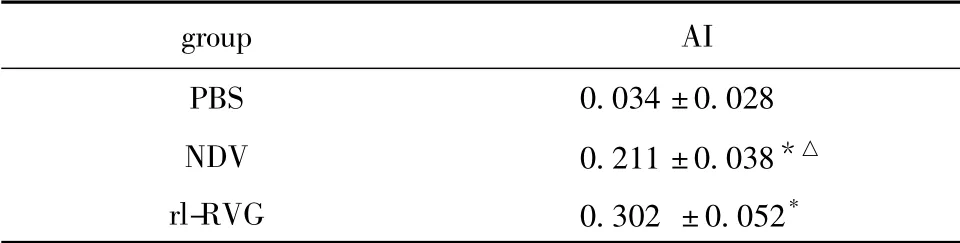
表1 rl-RVG 感染A549 荷瘤鼠后肿瘤细胞的凋亡指数Table 1 The apoptosis index of tumor infected with rl-RVG(±s,n=10)
*P<0.05 compared with PBS;△P<0.05 compared with rl-RVG.
groupAI PBS0.034 ±0.028 NDV0.211 ±0.038*△rl-RVG0.302 ±0.052*
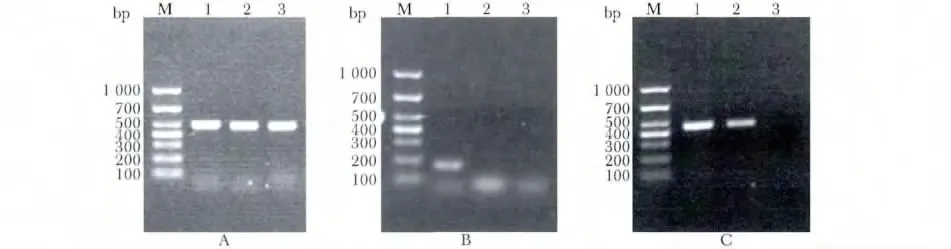
图3 RVG 及NDV HN 基因表达Fig 3 Expression of RVG and NDV HN gene in the tumor tissues

图4 rl-RVG 感染A549 荷瘤鼠后肿瘤细胞的凋亡Fig 4 The apoptosis of tumor infected with rl-RVG (×200)
2.4 Western blot 测caspase 系列及Bax/Bcl-2 比值
组织蛋白中表达的caspase-3,8,9 显示,rl-RVG组及NDV 组表达较PBS 组明显增多(P<0.05),rl-RVG较NDV 组表达增多(P<0.05);rl-RVG 组及NDV 组Bax 表达高于PBS 组,而rl-RVG 组及NDV组Bcl-2 表达低于PBS 组,rl-RVG 组及NDV 组的Bax/ Bcl-2 吸光度比明显高于PBS 组(P<0.05),且rl-RVG高于NDV 组(P<0.05)(图5,表2)。
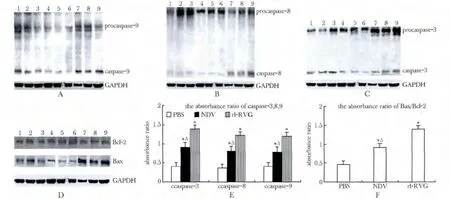
图5 Caspase3,8,9,Bax 和Bcl-2 的表达Fig 5 The expression of caspase-3,8,9,Bax and Bcl-2
表2 Caspase-3,8,9 和Bax/Bcl-2 的吸光度比值Table 2 The absorbance ratio of caspase-3,8,9 and Bax / Bcl-2(±s,n=10)

表2 Caspase-3,8,9 和Bax/Bcl-2 的吸光度比值Table 2 The absorbance ratio of caspase-3,8,9 and Bax / Bcl-2(±s,n=10)
*P<0.05 compared with PBS;△P<0.05 compared with rl-RVG.
groupcaspase-3caspase-8caspase-9Bax/Bcl-2 PBS0.46 ±0.110.36 ±0.130.46 ±0.110.46 ±0.15 NDV0.92 ±0.19*△0.80 ±0.22*△0.78 ±0.19*△0.92 ±0.24*△rl-RVG1.40 ±0.31*1.22 ±0.19*1.24 ±0.29*1.40 ±0.29*
3 讨论
肺癌是最常见的恶性肿瘤,中国肺癌的发病率一直呈上升趋势。溶瘤治疗是一种新的生物治疗方法,很多种病毒具有溶瘤作用,例如单纯疱疹病毒1 型,腺病毒等[5],NDV 是最常用的,被认为是一个很有潜力的溶瘤病毒。NDV 对肿瘤细胞具有选择性地复制,并摧毁肿瘤细胞,同时保留正常的细胞,由此可以运用于抗肿瘤的治疗中[6-7]。其在肺癌研究国内外尚少。NDV 对于人和动物来说也是一个很有前途的疫苗载体,通过对NDV 进行重组,更有效的作用于肿瘤细胞[8-9]。
新城疫病毒的直接溶瘤作用主要是通过诱导凋亡途径实现的,诱导凋亡途径的主要是激活内在的和外在的凋亡通路及激活内质网应激通路[10]。NDV 感染肿瘤细胞后引起肿瘤细胞分泌TNF-α 和TRAIL 激活caspase-8,也可引起肿瘤细胞线粒体膜电位下降,细胞色素C 释放,引起半胱氨酸天门冬氨酸蛋白酶的次序激活,并激活caspase-9,NDV 凋亡途径的激活可能是激活线粒体通路及caspase-9,以及后来激活的caspase-8 引起的[11]。
狂犬病毒的基因组为不分节段的单股负链RNA[12],从3'到5'的方向有5 个结构基因[13]。其中狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)在诱导狂犬病毒的凋亡中起着非常重要的作用。减毒的狂犬病毒ERA 株糖蛋白的表达可以触发人细胞发生涉及caspase-3,8 和9 的活化的细胞凋亡。
成功构建稳定表达狂犬病毒糖蛋白的重组新城疫病毒疫苗(rl-RVG),RVG 的表达使NDV 在细胞之间的扩散能力增强,使得rl-RVG 更有效的作用于肿瘤细胞;而RVG 的表达不会增强NDV 对老鼠及禽类的毒性[14]。
本实验运用中国农业科学院哈尔滨兽医研究所惠赠的rl-RVG 感染人肺腺癌细胞A549 荷瘤鼠,研究其体内抑制作用及部分机制,结果显示:组织Tunel 实验组凋亡细胞明显增多,表明rl-RVG 可以使肿瘤细胞凋亡增加;检测caspase-3,8,9 的蛋白表达,结果显示rl-RVG 组及NDV 组caspase-3,8,9 表达量明显高于PBS 组,表明rl-RVG 及NDV 诱导肿瘤细胞凋亡的途径之一是活化了 caspase-8,caspase-9 和caspase-3 蛋白信号通路;检测rl-RVG及NDV 组Bax 蛋白及Bax/Bcl-2 比值明显较PBS组的高,表明通过上调Bax 蛋白的表达,Bax/Bcl-2比值增高,进而促进肿瘤细胞凋亡是rl-RVG 及NDV 导致肿瘤细胞死亡的途径之一。
综上所述:本实验明确了重组新城疫病毒rl-RVG 对肺腺癌的荷瘤鼠的肿瘤生长有着明显的抑制作用,其可能机制与rl-RVG 导致的细胞凋亡有着密切的关系,为进一步研究rl-RVG 在肺癌方面的作用奠定了基础。
志谢:感谢葛金英及步志高所在的中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室赠与的重组新城疫病毒rl-RVG 与NDV 及技术支持,感谢钱海及陶燕博士给与的技术指导。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics 2012[J].CA Cancer J Clin,2012,62:10-29.
[2]Khuri FR,Herbst RS,Fossella FV.Emerging therapies in non-small-cell lung cancer[J].Ann Oncol,2001,12:739-744.
[3]张琪,杨呜琦.新城疫病毒和康莱特注射液联合抗肿瘤试验中瘤组织的病理变化及IL-6 表达的研究[J].中国兽医杂志,2010,l6:33-34.
[4]王亚君,宋纯.新城疫病毒抗人急性单核细胞白血病作用的实验研究[J].中国当代儿科杂志,2011,13:149-152.
[5]Mullen JT,Tanabe KK.Viral oncolysis[J].Oncologist,2002,7:106-119.
[6]Elankumaran S,Rockemann D,Samal SK.Newcastle disease virus exerts oncolysis by bothintrinsic and extrinsic caspase-dependent pathways of cell death[J].J Virol,2006,80:7522-7534.
[7]Hrabák A,Csuka I,Bajor T,et al.The cytotoxic antitumor effect of MTH-68/H,a live attenuated Newcastle disease virus is mediated by the induction of nitric oxide synthesis in rat peritoneal macrophages in vitro[J].Cancer Lett,2006,231:279-289.
[8]DiNapoli JM,Kotelkin A,Yang L,et al.Newcastle disease virus,a host range-restricted virus,as a vaccine vector for intranasal immunization against emerging pathogens[J].Proc Natl Acad Sci U S A,2007,104:9788-9793.
[9]DiNapoli JM,Nayak B,Yang L,et al.Newcastle disease virus-vectored vaccines ex-pressing the hemagglutinin or neuraminidase protein of H5N1 highly patho-genic avian influenza virus protect against virus challenge in monkeys[J].J Virol,2010,84:1489-1503.
[10]Letellier C,Burny A,Meujemam C.Construction of a pigeonpox virus recombinant:expression of the Newcastle disease virus (NDV)fusion glycoprotein and protection of chickens against NDV challenge[J].Areh Viml,1993,118:43-56.
[11]Dmitriy Zamarin,Peter Palese.Oncolytic Newcastle disease virus for cancer therapy:old challenges and new directions[J].Future Microbiol.,2012,7,3347-367.
[12]Inoue Ki,Shoji Y,Kurane I,et al.An improved method for recovering rabies virus from cloned cDNA[J].J Virol Methods,2003,107:229-236.
[13]Préhaud C,Lay S,Dietzschold B,et al.Glycoprtein of nonpathogenic rabies virus is a key determinant of human cell apoptosis[J].J Virol,2003,77:10537-10547.
[14]Ge J,Wang X,Tao L,et al.Newcastle disease virus-vectored rabies vaccine is safe,highly immunogenic,and provides long-lasting protection in dogs and cats[J].J Virol,2011,85:8241-8252.
